香椿种子人工老化过程中生理生化的变化
2020-11-27方娇阳王彩云叶可可高卫东张子晗闫晶晶李庆梅
方娇阳,祝 燕,王彩云,叶可可,高卫东,张子晗,闫晶晶,李庆梅
(中国林业科学研究院林业研究所,国家林业和草原局林木培育重点实验室,林木遗传育种国家重点实验室,北京 100091)
种子是植物的主要繁殖器官,种子质量的优劣往往会对种苗的培育以及种质资源的安全贮藏造成影响;但种子在完成生理成熟之后,其活力会不断下降直至完全丧失活力,该过程被称为种子老化[1-2]。种子老化会直接影响种子的质量,田间出苗率、出苗整齐度和幼苗质量也会受到一定程度的影响[3-4]。目前,关于种子老化的研究对象大多为蔬菜类和农作物的种子,对林木种子的相关研究数量较少。综合相关文献发现,在种子老化的同时伴随着众多复杂的理化变化,包括膜透性、酶活性、贮藏物质含量、有毒有害物质积累等多个方面的变化[1,5],但种子老化真正的机理目前尚无定论。
香椿(Toona sinensis(A. Juss.) Roem.)在我国种植广泛,具有材用、食用、药用和观赏等多种重要价值,在世界上享有“中国桃心木”的美称[6-7]。目前,香椿苗木的培育主要采用种子繁殖法[8],但香椿结实存在“大小年”现象,且种子在贮藏过程中极易丧失活力,常温贮藏半年后,种子发芽率由95%降至50%,贮藏1年后,种子完全失活[9-10],这严重限制了香椿种子在生产实际中的应用及香椿种质资源的保存。目前,对于香椿种子活力及种质资源保存的研究主要集中在种源[11]、贮藏温度和含水量[12]、植物生长调节剂[13]等方面,而对于香椿种子老化过程中生理生化的变化及其老化机理的探究相对较少。本文以香椿种子为试验材料,研究人工加速老化对于香椿种子萌发的影响以及生理生化的变化,分析各指标的变化规律及其与种子活力变化的关系,探究香椿种子老化的主要内因并筛选可用于衡量香椿种子活力水平的理化指标,以期为香椿种子活力修复及种质资源保存的相关研究提供理论依据。
1 材料与方法
1.1 试验材料
试验所用香椿种子采集于河南省栾川县,根据GB 2772—1999《林木种子检验规程》[14],测得种子千粒质量为9.334 g,初始含水量为7.4%,初始发芽率为88.5%。
1.2 试验方法
1.2.1 种子处理 采用高温高湿(温度40℃,相对湿度95%)的环境条件对种子进行人工加速老化。选取干净饱满的香椿种子置于网纱袋中,均匀放置在预先平衡好的老化箱内,处理1、2、3、4、5、6、7、8 d后,分期取出种子,进行发芽指标、幼苗形态指标和生理生化指标的测定,以未经老化处理贮藏于-20℃冰箱内的种子作为对照。
1.2.2 发芽试验 随机选取老化处理后的种子,用始温45℃的清水浸种12 h后,置于蛭石基质的发芽盒中进行发芽试验,每处理4个重复,每重复50粒种子,于环境温度25℃,每天光照8 h的人工气候箱中培养。从置床次日起每日透气30 min,及时补充水分,观察记录发芽种子数并剔除发霉种子,于21 d后结束发芽试验。
1.2.3 发芽指标 发芽试验结束后,统计计算发芽率(Gr)、发芽指数(Gi)和活力指数(Vi),公式如下:
发芽率(Gr)=(∑Gt/NT)×100%
发芽指数(Gi)=∑(Gt/Dt)
活力指数(Vi)=S×Gi
式中:Gt为在t天时的发芽种子数,NT为50(每重复的种子总数),Dt为相应的发芽天数,S为幼苗平均干质量。
1.2.4 幼苗形态指标 于发芽试验结束后随机选取10株幼苗(老化后期幼苗萌发数量较少,以实际测量株数为准),用直尺分别测量幼苗的苗高和根长,精度0.1 cm,每处理4个重复。
1.2.5 生理生化指标 试验测定的生理生化指标包括电导率、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性。电导率的测定采用电导率仪法[15],用相对电导率表示,每处理4个重复,每重复20粒种子。MDA含量、SOD活性和POD活性分别使用苏州科铭生物技术有限公司(江苏,中国)丙二醛(MDA)含量试剂盒、超氧化物歧化酶(SOD)试剂盒和过氧化物酶(POD)试剂盒进行测定,每处理4个重复。
1.2.6 数据分析 采用Excel 2013和SPSS 19.0处理试验数据,对数据进行单因素方差分析和Duncan多重比较(在0.05水平上检验不同处理间差异的显著性),并进行Pearson相关性分析。
2 结果与分析
2.1 人工老化对香椿种子萌发的影响
表1表明:高温高湿(温度40℃,相对湿度95%)的环境条件下,香椿种子活力明显降低。发芽率、发芽指数和活力指数变化一致,3个发芽指标在种子老化过程中均表现为逐步下降的变化规律。在老化初期1~4 d发芽率的降速较缓慢,后期5~7 d发芽率快速下降;发芽指数和活力指数的快速下降期为老化初期1~2 d,后期下降变缓,这表明香椿种子在老化初期活力虽然有所下降,但种子在发芽试验过程中仍然可以萌发。由表1中数据可得,老化后的香椿种子活力显著下降,老化4 d的种子发芽率较对照下降36%,发芽指数和活力指数的降幅分别为52%和50%;老化8 d的种子发芽率较对照下降98%,发芽指数和活力指数的降幅分别为98%和99%,种子活力基本完全丧失。分析数据可得,香椿种子老化天数相同时,发芽指数和活力指数的降幅(与对照相比)高于发芽率的降幅(与对照相比),这说明发芽指数和活力指数可以更好的反映香椿种子的质量,对于香椿种子老化程度的变化更敏感。在人工加速老化的条件下,香椿种子发芽率在8 d内从88.50%降至1.50%,发芽指数和活力指数分别从3.99、48.50降至0.06、0.57,这表明老化会对香椿种子造成严重损害,种子活力降低,萌发能力减弱,整齐度下降。

表 1 人工老化对香椿种子萌发的影响Table 1 Effect on seed germination of T. sinensis in artificial aging
2.2 人工老化对香椿幼苗苗高和根长的影响
由图1可看出:在人工老化过程中,香椿幼苗根长呈先下降后上升再下降的趋势,苗高在老化初期保持稳定,后期呈逐渐下降趋势。在老化初期1~3 d,幼苗根长显著降低,根部的生长受到抑制,根长较对照显著降低17%;老化末期8 d时,幼苗根长较对照显著下降22%;在老化3~7 d过程中,相邻两天幼苗根长无显著变化。在老化5 d时,幼苗苗高显著降低,幼苗的高生长受到抑制,苗高较对照显著下降11%;随着老化程度的加深,幼苗高生长受抑制程度不断加深,在老化7 d时,幼苗苗高较对照显著下降29%。由此可见,随着香椿种子活力的下降,幼苗的高生长和根部的生长均受到抑制,在老化前期,受到影响的主要是幼苗根部,表现为幼苗根长变短,而苗高的变化相对滞后,在老化后期,幼苗苗高显著降低,幼苗的高生长受到抑制。
2.3 老化过程中香椿种子浸出液相对电导率的变化

图 1 人工老化对香椿幼苗苗高和根长的影响Fig. 1 Effects on the seedling growth of stem height and root length of T. sinensis in artificial aging
由图2可看出:经人工老化处理后的香椿种子浸出液相对电导率均高于对照,表明膜系统可能在人工老化过程中受损。随着老化处理时间的延长,香椿种子浸出液相对电导率逐渐升高,与种子活力的变化规律相反,说明种子浸出液相对电导率的变化可能与香椿种子的活力水平有关。老化1~2 d的种子相对电导率与对照相比无显著差异,说明在老化初期膜系统受损程度较轻的情况下,香椿种子内部可能存在修复机制。随着老化天数增加,相对电导率显著升高,老化3 d的香椿种子浸出液相对电导率为30%,显著高于对照,增幅为51%;老化6 d时,种子浸出液相对电导率为35%,增幅为76%;老化7 d时,种子浸出液相对电导率达到峰值40%,是对照的2倍。这可能是由于在老化过程中,膜系统持续受损,生物膜透性不断增大,内含物质外渗量增加所致。
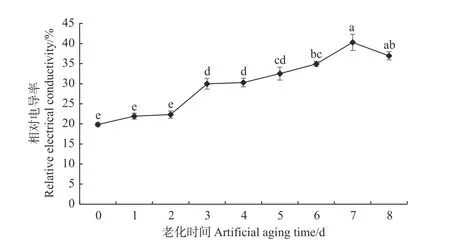
图 2 人工老化过程中香椿种子浸出液相对电导率的变化Fig. 2 Changes in relative electrical conductivity of T.sinensis seeds leachate during artificial aging
2.4 老化过程中香椿种子MDA含量的变化
图3表明:香椿种子MDA含量总体表现出上升的变化趋势,这与种子浸出液相对电导率的变化规律相一致,与种子活力的变化规律相反,意味着MDA含量或许可以在一定程度上反应香椿种子的活力水平。老化后的香椿种子MDA含量均高于对照,老化2 d的香椿种子MDA含量显著高于对照25%,老化6 d时,MDA含量显著高于对照52%,老化8 d时,MDA含量达到顶峰,显著高于对照62%。图3的变化趋势显示,在种子老化的过程中,随着种子活力的下降,MDA含量升高,而MDA是脂质过氧化的主要产物,因此,推测伴随着种子的老化,种子内不饱和脂肪酸可能受到活性氧攻击,脂质过氧化程度逐渐加深,致使MDA含量升高。

图 3 人工老化过程中香椿种子MDA含量的变化Fig. 3 Changes in MDA content of T. sinensis seeds during artificial aging
2.5 老化过程中香椿种子抗氧化酶(SOD和POD)活性的变化
从图4可看出:随着香椿种子老化程度的加深,种子SOD活性呈先上升后下降的变化趋势。老化1 d时,种子SOD活性显著升高,为对照的3倍;老化4 d时,种子SOD活性达到最大,为对照的6倍;在老化后期7~8 d时,SOD活性较老化4 d时显著下降;与老化4 d相比,老化7 d的种子SOD活性显著下降20%,老化8 d的种子SOD活性降低更多,显著下降53%,但老化后的香椿种子SOD活性均显著高于对照。这表明在高温高湿的环境条件下,香椿种子内的抗氧化酶系统可能产生了一定程度的应激反应,随着种子的老化,SOD活性显著升高,对超氧自由基的清除能力加强,同时产生大量过氧化氢。之后随着种子老化程度的加剧,SOD活性也随之降低,可能导致超氧自由基大量产生并发生积累,加重对种子的毒害。在香椿种子老化初期,SOD活性即出现显著升高,可见SOD对香椿种子老化反应灵敏,可能在香椿种子抗氧化酶系统中起主要作用。

图 4 人工老化过程中香椿种子SOD和POD活性的变化Fig. 4 Changes in SOD and POD activity of T. sinensis seeds during artificial aging
POD活性随着种子老化时间的延长,同样呈先上升后下降的变化趋势。老化2 d时,种子POD活性比对照显著升高27%;在种子老化3 d时POD活性达到顶峰,显著高于对照34%,随后开始下降;与老化3 d相比,老化4 d的种子POD活性显著下降28%,老化5 d时,种子POD活性显著下降44%;在老化后期5~8 d,种子POD活性存在略微波动,但差异不显著,与对照相比,老化5 d的种子POD活性显著下降25%。综上分析可得,在香椿种子轻度老化的 情况下,POD可能对其具有保护效应,表现为种子内POD活性在一定程度上有所上升,但随着种子老化时间的延长,POD活性显著下降,清除过氧化氢的能力降低,种子内过氧化氢可能大量积累,加速种子死亡。
2.6 香椿种子生理生化指标与发芽指标的相关性
表2表明:不同老化程度的香椿种子浸出液相对电导率和MDA含量与各发芽指标呈极显著负相关(α=0.01(双侧));相对电导率与发芽率的相关性最高,相关系数为-0.919,MDA含量与发芽指数的相关性最高,相关系数为-0.884;POD活性与各发芽指标呈极显著正相关(α=0.01),相关系数分别为0.599、0.546、0.508,SOD活性与发芽率呈显著负相关(α=0.05),相关系数为-0.393,与发芽指数和活力指数呈极显著负相关(α=0.01),相关系数分别为-0.485、-0.491。综合结果表明:相对电导率、MDA含量和POD活性这3个理化指标与香椿种子各发芽指标均呈极显著相关,适用于香椿种子活力评价。

表 2 香椿种子生理生化指标与发芽指标的相关性分析Table 2 The correlation analysis on the vigor of T. sinensis seeds and physiological and biochemical indexes in artificial aging
3 讨论
3.1 人工老化对种子萌发的影响
种子在完成生理成熟之后,活力开始下降,而种子的萌发情况可以直观反映种子的活力水平。本研究中,香椿种子在老化过程中,种子发芽率呈逐渐下降趋势,发芽指数和活力指数也表现出相同规律,这与朱世东等[8]对香椿种子老化的研究结果相符。老化后香椿种子萌发能力减弱,发芽率、发芽指数和活力指数显著降低,这表明香椿种子经人工老化后活力明显衰退。相同处理天数的香椿种子,发芽指数和活力指数的降幅(较对照)均高于发芽率的降幅(较对照),变化规律与毛竹[16]、大豆[17]等试验结果相似。将种子老化相关的4个生理生化指标与各发芽指标进行相关性分析表明,各理化指标与发芽指数和活力指数的相关性更好。由此可见,相较于发芽率,发芽指数和活力指数对于种子的老化反应更敏感,可以更好的反映香椿种子的活力水平。
3.2 人工老化对幼苗生长的影响
不同种类的种子经不同老化方式处理后,其幼苗所发生的变化也有所不同。王玉娇等[18]对老化处理下春小麦种子发芽指标和幼苗根系的研究发现,高温高湿的环境条件会延缓幼苗的生长发育,并对幼苗的根系造成伤害。何学青等[19]研究发现,老化并未对柳枝稷幼苗的生长造成影响,且提高了幼苗的根冠比。本研究中,老化后的香椿幼苗苗高和根长均小于对照,说明香椿种子在老化后,其幼苗的生长受到了一定程度的影响。分析发现,在老化前期,受到影响的主要是幼苗的根部,即幼苗的根长减小,而幼苗高生长的变化相对滞后;在老化后期,幼苗苗高显著减小。这可能是由于根是植物用于吸收水分和养分的器官,且胚根表皮细胞和内部的细胞器可能遭受破坏[20]。在老化4 d时,幼苗根长有所上升,可能是由于老化后存活下来的种子生活力较强,且在适宜环境下发芽,种子活力得到了一定程度的恢复[21-22]。老化4~7 d,幼苗根长无显著变化,可能是由于幼苗在萌发过程中抗氧化酶活性有所上升,抗性增强,且对于老芒麦的研究也发现,老化对于其幼苗根长的影响比苗高小[22-23]。本研究未测定幼苗的理化指标,因此,香椿种子老化后幼苗形态指标变化的具体原因仍有待探究。同时在老化后期萌发幼苗数减少,选取完整幼苗的代表性相对降低,在后续试验中将控制基质含水量并将相同处理下的幼苗混合后选取用于测定的幼苗,尽量减少干扰因素。
3.3 人工老化对种子膜系统的影响
种子浸出液相对电导率是反应种子膜系统是否完整的重要指标,老化可导致种子生物膜结构受损,膜透性增大,细胞内含物质外渗,种子浸出液电导率随之增大[24-25]。脂质过氧化会导致生物膜受活性氧的攻击而功能受损,MDA作为膜脂过氧化的主要产物可以在一定程度上反应细胞膜上不饱和脂肪酸被攻击的程度[26-27]。朱世东等[8]探究香椿种子衰老机理发现,随着种子老化程度加深,MDA含量增大,膜透性增加,超氧阴离子发生明显积累,认为香椿种子老化与活性氧的毒害相关,推测膜脂过氧化为香椿种子衰老的主要原因之一。张海波等[12]对香椿种子安全贮藏条件的探究发现,种子浸出液电导率和MDA含量与其老化程度密切相关,且随贮藏时间的延长逐渐升高。本研究中,香椿种子在老化过程中,种子浸出液相对电导率和MDA含量均呈逐渐上升趋势,与种子各发芽指标均呈极显著负相关,表明相对电导率和MDA含量与种子的活力水平相关,可用于评价香椿种子的活力水平。在种子不断老化的过程中,活性氧大量产生,促使不饱和脂肪酸发生过氧化反应,而构成生物膜的磷脂中含有大量不饱和脂肪酸,因此,细胞膜在种子老化过程中极易受到活性氧的攻击发生脂质过氧化,从而导致细胞膜受损。在脂质发生过氧化的同时会产生大量脂质自由基和有毒产物MDA,其中,MDA还可以结合抗氧化酶,使抗氧化酶活性下降,清除自由基能力减弱,导致自由基累积,进一步加速生物膜受损,致使膜内矿物质及无机物质外渗,浸出液电导率升高[28-29]。由此可见,膜脂过氧化会引起种子内部新陈代谢紊乱,进而加重香椿种子的老化。
3.4 人工老化对种子抗氧化酶系统的影响
SOD和POD是植物细胞及各细胞器内重要的抗氧化酶,通过相互协作清除自由基和过氧化物,维持自由基产生和清除的平衡[30-32]。张海波等[12]发现,随着贮藏时间的延长,香椿种子SOD活性先上升后下降,POD活性呈逐渐下降趋势。孙春青等[33]对不结球白菜的研究发现,抗氧化酶(SOD和POD)的活性随种子活力的下降而降低。本研究中,老化初期的香椿种子SOD活性显著上升,可能是由于种子在高温高湿的条件下产生了大量自由基,SOD产生应激反应,迅速提升活性以清除自由基维持代谢平衡。POD活性在种子老化初期也同样出现显著上升,这可能与植物两种POD机制中的保护效应有关[34]。活性氧随着种子的老化大量产生,抗氧化酶无法及时清除,细胞内活性氧产生和清除的平衡被打破,同时MDA作为过氧化产物与酶结合抑制酶活,导致POD活性和SOD活性分别在种子老化3 d和4 d后不断降低。SOD和POD活性的下降可能导致种子内超氧自由基和H2O2发生积累,加速种子老化[34]。综合香椿种子老化过程中SOD活性和POD活性的变化规律发现,SOD对于香椿种子的老化最敏感,可能是香椿种子抗氧化酶系统的第一道防线。进一步结合相关性分析的结果可得,SOD活性和POD活性可以在一定程度上反映香椿种子的活力水平。
4 结论
在高温高湿(温度40℃、相对湿度95%)的环境条件下,香椿种子活力显著降低,幼苗生长也受到一定程度的影响,相对电导率和MDA含量显著升高。在种子老化过程中,发芽率、发芽指数和活力指数逐渐下降,相对电导率和MDA含量总体呈逐渐上升趋势,SOD活性和POD活性则表现为先上升后下降的变化规律。表明随着香椿种子的老化,种子活力逐渐下降,种子膜系统不断受损,膜脂过氧化作用以及抗氧化酶系统功能失调是香椿种子老化的重要原因。综合相关分析认为,相对电导率、MDA含量和POD活性可以反映香椿种子的老化程度,适用于香椿种子活力水平的评价。
