马尾松β-蒎烯合酶基因克隆以及对松材线虫侵染的响应
2020-11-27刘青华周志春解懿妮陈献志
刘 彬,刘青华*,周志春,罗 柠,解懿妮,陈献志
(1. 中国林业科学研究院亚热带林业研究所,浙江省林木育种技术研究重点实验室,浙江 杭州 311400;
2. 浙江省临海市自然资源和规划局,浙江 临海 317000)
马尾松(Pinus massonianaLamb.)为松科(Pinaceae)松属(PinusL.)常绿乔木,速生、耐旱,广泛分布于我国亚热带地区,是我国速生丰产用材林和脂用林的先锋树种[1]。然而,马尾松也经受着多种病虫害的侵袭,以松材线虫病最为严重。松材线虫病是一种由松材线虫(Bursaphelenchus xylophilus(Steiner et Buhrer)Nickle; PWN)引起的毁灭性森林病害[2],由于其致病力强,传播速度快,导致全国马尾松出现大面积死亡,截止到2018年,松材线虫病已蔓延至18个省,超过500万m3马尾松林被松材线虫侵袭[3],生态系统遭到严重破坏,造成巨大经济损失[4]。
萜类化合物是植物主要的次生代谢物质,释放萜烯类化合物是植物应对多种生物与非生物胁迫最重要的防御措施之一[5]。松脂作为针叶树种的主要防御物质,包含100多种单萜、倍半萜和二萜[6-8],是针叶树种抵御植食性昆虫和病原体的重要屏障[9]。昆虫胁迫或机械损伤会激活植物合成大量的烯萜类化合物,阻止病原体入侵或趋避入侵的昆虫,从而起到物理防御以及化学防御作用[10-12]。已有研究表明,当云杉大墨天牛(Monochamus urussovi)入侵鱼鳞云杉(Picea jezoensisCarr)时,导致其烯萜类化合物如α-蒎烯、3-蒈烯、β-蒎烯、异柠檬烯等含量显著上升[13]。华山松(P. armandiiFranch.)的β-蒎烯含量较高,受到华山松大小蠹(Dendroctonus armandi)入侵后,β-蒎烯的含量明显上升[14],表明β-蒎烯可能参与华山松抵御大小蠹的胁迫过程。当大冷杉(Abies grandisCraib)遭遇树皮甲虫侵食时,可诱导萜类化合物特别是β-蒎烯积累量增加[15]。此外,在油松(P. tabulaeformisCarr.)、白皮松(P. bungeanaZucc. et Endi)、雪松(Cedrus deodara(Roxburgh) G. Don)、金边龙柏(Sabina chinensis(L.) Ant. cv. Aurea)、红皮云杉(P. koraiensisNakai)的挥发性物质中,β-蒎烯为主要成分,具有明显的抑菌作用[16]。
马尾松为重要的脂用树种,富含大量松脂。其中单萜化合物为松脂的主要成分,可以作为植保素对松材线虫的入侵起到直接防御作用。作为马尾松松脂的重要组成部分,α-蒎烯与β-蒎烯含量变化可直接影响松材线虫的种群数量,受损伤的松树体内α-蒎烯与β-蒎烯含量均高于健康株系[17-19]。也有相关研究表明,α-蒎烯浓度与松材线虫死亡率呈现正相关趋势[20];而β-蒎烯的抑菌作用高于α-蒎烯,β-蒎烯可通过影响受伤树体的真菌蓝变使松材线虫种群密度减小[21]。贾洪敏等认为,马尾松松脂中单萜类物质β-蒎烯、香叶烯、柠檬烯等可能与寄主抗性存在相关性[22]。在松材线虫入侵后,高抗马尾松中的β-蒎烯含量显著高于易感马尾松[23]。此外,α-蒎烯与β-蒎烯的比例可影响松材线虫及其伴生菌的繁殖能力。Niu等[24]发现,α-蒎烯和β-蒎烯的浓度比例可以影响松材线虫的繁殖力,且较低浓度的单萜化合物可能抑制松材线虫繁殖力。
单萜合酶可以通过催化底物牻牛儿基焦磷酸(GPP)合成单萜类物质,可直接或间接决定萜类化合物的含量以及多样性。在受到食草动物取食后的陆地棉(Gossypium hirsutumLinn.)中,β/α蒎烯合酶GhTPS2表达量显著上调,可参与植物的抗病过程[25]。病虫害取食或机械损伤阿拉斯加云杉(P. sitchensis(Bong.) Carrière)可诱导创伤型树脂道发育,促进单萜合酶基因PsTPS2表达量上调,PsTPS2可催化α蒎烯和β-蒎烯合成[11]。单萜合酶基因在针叶树种的防御过程中极为重要[26],而在马尾松中萜类相关基因的研究较少,目前仅有马尾松α-蒎烯合酶基因被克隆。本课题组前期高抗与易感马尾松二代转录组测序结果显示,β-蒎烯合酶基因为高抗马尾松差异表达基因[27],然而,由于缺乏基因的全长序列,限制了对β-蒎烯合酶基因的进一步研究。
本研究基于前期研究基础,结合马尾松三代全长转录组测序结果,首次克隆获得PmPinScDNA全长序列,分析该基因的理化性质、系统发育以及接种松材线虫后在高抗和易感马尾松中的表达特征,并探究其产物对松材线虫的抑制作用,为解析马尾松抗病机制奠定理论基础。
1 材料与方法
1.1 试验材料
试验材料来自安徽省林业科学研究院马尾松无性系试验林。根据前期该院对试验林内无性系测定的松材线虫病抗性指数,选择高抗无性系‘休宁-5′(抗性指数4级)、易感无性系‘黄山-1’(抗性指数1级)各6株,各无性系均为4年生植株,生长状况良好。松材线虫试验林设在安徽省林业科学研究院苗圃,位于安徽省合肥市(31°51′ N,117°10′ E),属于亚热带湿润季风气候,年平均气温15.7℃,年平均日照时数2 100 h,年平均降水量1 000 mm,全年无霜期228 d,四季分明,自然条件优越。供试松材线虫为高致病性株系‘广株3B’ 和‘全4’混合株系,于灰葡萄孢菌(Botrytis cinerea)菌落上纯培养,保存于4°C冰箱中备用。
1.2 试验方法
1.2.1 松材线虫培养 将灰葡萄孢接种在马铃薯葡萄糖琼脂(PDA)培养基中,于28℃霉菌培养箱恒温培养5 d。待白色菌落生长至培养皿上盖处,将纯化好的高致病性松材线虫接种到灰葡萄孢菌落内,于28℃培养箱恒温培养约9 d,使菌落被松材线虫完全取食。进一步用贝尔曼漏斗法分离松材线虫,12 h后收集于10 mL离心管中,300 r·min-1离心5 min,去除上清液。将各离心管中的松材线虫汇集并混匀,最终制备成每微升含50条松材线虫的悬浊液[17]。
1.2.2 松材线虫接种 于2017年7月,天气较晴好,气温维持在30℃以上,选择3株高抗和易感植株接种松材线虫,每株选择不同方向的5个枝条,每个枝条至少包含3个当年生嫩枝,在枝条的底端采用剥皮接种法:在选出的枝条底端一侧割开长约5 cm的切口,剥皮时注意不能剥得太深,轻轻割入木质部即可,也不要使树皮脱落,且用小锯在切口上刮齿痕,以模拟天牛的咬食痕,同时防止松材线虫溶液流出切面。将线虫悬浮液均匀注入切口处,接种量为含有10 000头线虫的200 μL松材线虫混浊液,对另外3株高抗和易感植株注入等量的蒸馏水作为对照。为保证线虫成活,将切开的树皮小心覆在伤口处。
1.2.3 样品采集 所取样品包括高抗马尾松和易感马尾松2种基因型,接种松材线虫和接种蒸馏水2种处理,接种后1、15、30 d和2 a 4个取样时间点,3个生物学重复。取样部位为高抗与易感马尾松接种点上部5 cm处侧枝和接种2 a后可检测出松材线虫且生长状况良好的高抗马尾松根、茎、叶。取样后迅速用锡箔纸包好,做好标记后立即放入液氮中,实验室保存于-80℃冰箱用于后续试验。
1.3 PmPinS基因的克隆
取马尾松高抗和易感无性系茎部组织立即放入液氮中速冻,研磨后利用RN38 EASY spin plus植物RNA快速提取试剂盒提取RNA。经SuperScript™ III First-Strand Synthesis System反转录试剂盒进行cDNA第一链的合成。根据全长转录组中的PmPinS序列设计引物PmPinS-F(5′-AT GGATTTAATATCTGTCTTACCG-3′)和PmPinS-R(5′-TTATAAAGGCACAGGTTCAAG-3′),分别以高抗和易感马尾松cDNA为模板利用MCLAB高保真酶(Tsingke)扩增PmPinS的全长编码区序列。PCR反应体系(50 μL)为:25 μL I-5™ 2×High-Fidelity Master Mix,2 μLPmPinS-F (10 μmol·L-1),2 μLPmPinS-R (10 μmol·L-1),1 μL cDNA模板,20 μL ddH2O,反应程序为98℃预变性2 min;98℃变性10 s,55℃退火15 s,72℃延伸30 s,共35个循环;最后,72℃延伸5 min。PCR产物经琼脂糖凝胶电泳后回收,与pClone007 Blunt Vector(Tsingke)连接,转化大肠杆菌(Escherichia coli)DH5α菌株,获得阳性克隆后测序。
1.4 PmPinS基因的生物信息学分析
利用ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)分析目的基因cDNA序列的开放阅读框,并在blastx(https://blast.ncbi.nlm.nih.gov/Blast.cgi)上对预测到的ORF序列和氨基酸序列进行保守结构域分析和序列鉴定。用ClustalX对高抗和易感马尾松PmPinS的核苷酸和氨基酸序列进行多重序列比对[28]。利用ExPASyProtParam(http://expasy.org/tools/pi_tool.html)预测蛋白的理化性质;SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测蛋白质二级结构,ITASSER v4.3对蛋白质三级结构进行预测[29];用ChloroP(http://www.cbs.dtu.dk/services/ChloroP/)预测叶绿体转运肽。
利用ClustalX软件对PmPinS及其它物种的萜类合酶蛋白序列进行多序列比对。用MEGA 5软件[30]以最大似然法中的JTT模型进行系统发育树的构建,bootstrap值设为1 000。
1.5 PmPinS对松材线虫侵染的响应分析
分别提取高抗和易感马尾松在松材线虫侵染后1、15、30 d的茎部组织RNA,合成cDNA第一链。利用Primer 3 (http://bioinfo.ut.ee/primer3-0.4.0)设计PmPinS实时定量PCR引物PmPinSRT-F(5′-ACCGTTGCATCTGATGATGA-3′)和PmPinS-RT-R(5′-ACGTTCACGGTAAGCGAGTT-3′)。以马尾松Actin(transcription elongation factor 1)基因为内参[31],利用SYBR Premix Ex Taq(Takara)和QuantStudio 7荧光定量PCR检测系统进行实时定量PCR分析。每个样品进行3次生物学重复,3次技术重复。利用2-ΔΔCT方法计算PmPinS基因的相对表达量。用单因素方差分析计算不同组织中基因表达量的显著性差异,P < 0.05用*标记,P < 0.01用**标记。
1.6 单萜类化合物对松材线虫的影响
从高抗马尾松树体内分离出有活性的松材线虫,接种于长满灰葡萄球菌的PDA培养基中培养,通过Bellman分离法[32]将分离出的松材线虫分装于2 mL离心管中,配制成1 mL含有200条松材线虫的悬浊液。将α-蒎烯标准品(纯度为97%)和β-蒎烯标准品(纯度为98%)及其混合溶液以一定的浓度梯度分别施加于松材线虫(表1),25℃条件下培养24 h[33]。以施加TritonX-100作为对照,3次技术重复。选取以上萜类物质处理后0.5、6、24 h为时间节点,利用ZEISS Imager A2光学显微镜(蔡司公司)观察其活性并计算数量。
2 结果与分析
2.1 PmPinS基因的克隆及理化性质分析
以马尾松茎部cDNA为模板,扩增得到PmPinS基因序列(图1)。PmPinS的全长编码区为1 878 bp,ORF Finder分析显示其完整开放阅读框为1 878 bp,编码625个氨基酸(Genbank登录号:MT019965),PmPinS蛋白质分子式为C3201H4977N865O957S33,分子量为71.95 kD,等电点(pI)为5.74。对PmPinS氨基酸序列进行分析发现,其含有单萜合酶典型的N末端保守结构域和C末端保守结构域。N末端保守结构域中包括质体转运肽和RR(X)8W保守基序,其中,RR(X)8W主要负责催化异构化-环化反应[34]。C末端保守结构域包括DDXXD和NSE/DTE保守基序,DDXXD参与二价金属离子和水分子的结合,维持活性位点的稳定[35]。对蛋白质二级、三级结构分析后发现,PmPinS中共有400个氨基酸(64.00%)参与形成α-螺旋,20个氨基酸(3.20%)参与形成延伸链,19个氨基酸(3.04%)参与形成β-转角,186个氨基酸(29.76)参与形成无规则卷曲,表明PmPinS蛋白的二级结构以α-螺旋和无规卷曲为主(图2)。
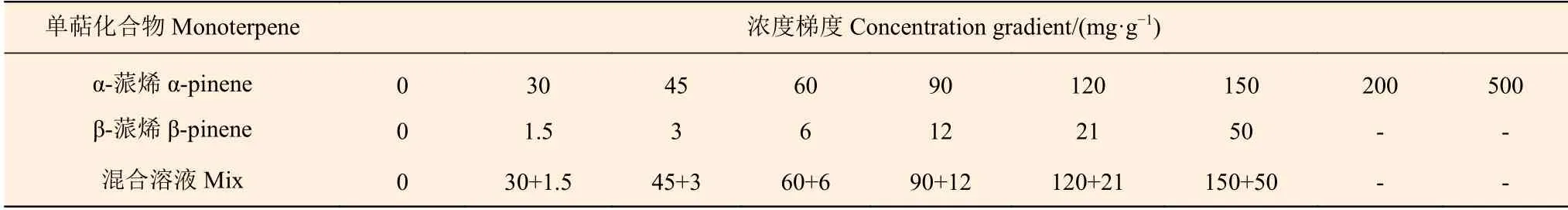
表 1 体外施加松材线虫萜类化合物浓度梯度 Table 1 Volatiles treated on the B. xylophilu in vitro

图 1 马尾松PmPinS基因扩增Fig. 1 PCR amplification of PmPinS

图 2 PmPinS氨基酸序列分析Fig. 2 The sequence analysis of PmPinS
2.2 PmPinS多序列比对及系统发育分析
利用ClustalX将马尾松PmPinS与扭叶松(P.contortaDouglas ex Loudon)、北美云杉(P.pungensEngelm)、欧洲云杉(P. abies(Linn.) H.Karsten)的同源序列进行多序列比对发现,其与PsPinS、PaPinS、PcPinS具有相似的保守结构域,均包含RR(X)8W、DDXXD和NSE/DTE保守基序(图3),与PcPinS序列相似性达93.16%。马尾松PmPinS与已报道的马尾松α-蒎烯合成酶(AGW25369)蛋白序列相似性为73.85%。推测PmPinS蛋白可能与β-蒎烯合酶功能相似,参与植物合成β-蒎烯的生物合成途径。
为进一步对PmPinS进行系统进化分析,选取北美云杉、挪威云杉(P. excelsa(Lam.) Link)、银杏(Ginkgo bilobaLinn.)等裸子植物的TPS蛋白序列与PmPinS共同构建系统发育树(图4)。进化分析结果表明:PmPinS位于马尾松TPS-d1亚家族,负责裸子植物单萜生物合成,与北美云杉β-蒎烯合酶处于同一分支。据此可以推断,PmPinS为单萜合酶,可能参与β-蒎烯的生物合成。
2.3 PmPinS对松材线虫侵染的响应

图 3 PmPinS氨基酸序列比对分析Fig. 3 The sequence alignment of PmPinS

图 4 PmPinS系统进化分析Fig. 4 Phylogentic analysis of PmPinS

图 5 松材线虫接种后高抗和易感马尾松PmPinS表达模式Fig. 5 Relative expression levels of PmPinS in resistant and susceptible P. massoniana inoculated B. xylophilus
为解析高抗和易感马尾松蒎烯合酶对松材线虫侵染的响应,对松材线虫侵染1、15、30 d的高抗和易感马尾松中的PmPinS表达模式进行实时定量分析(图5)。从表达趋势上分析,相对于接种蒸馏水的阴性对照,高抗和易感马尾松的PmPinS表现出相反的表达模式。高抗马尾松中,PmPinS在松材线虫接种后呈现上升趋势,接种后30 d时基因表达量为对照的3倍左右。截然相反的是,在易感马尾松中,PmPinS只在接种松材线虫1 d后检测到表达量,且只为对照的0.4倍。从表达量上分析,在阴性对照中高抗和易感马尾松PmPinS基因表达量相近,接种松材线虫后,高抗马尾松中的PmPinS显著高于易感马尾松PmPinS。
鉴于PmPinS在高抗马尾松中的显著高表达,作者延长接种后采样的时间节点。从接种松材线虫2 a体内携带松材线虫且正常生长发育的高抗马尾松的根、茎、叶中提取RNA,反转录之后进行qRT-PCR,以接种蒸馏水的高抗马尾松作为对照,探究PmPinS在高抗马尾松不同组织中的表达模式。结果表明:与对照组相比,PmPinS在接种后的高抗马尾松茎中的表达量特异性显著上调(图6)。由此可以初步得出:PmPinS在接种后的高抗马尾松中的表达量显著高于易感马尾松,且在高抗马尾松茎部组织特异性高表达,从而可进一步验证PmPinS在马尾松对松材线虫的防御过程中起正向调控的作用。松材线虫主要通过松墨天牛取食马尾松茎入侵树体,马尾松茎部组织是合成富含萜类化合物的松脂的主要场所,而松脂是马尾松重要的次生代谢物,同时也是重要防御物质。因此,PmPinS编码的蛋白为β-蒎烯合酶,其表达量在高抗马尾松茎中显著上调表明该基因可能参与萜类化合物的合成,从而使松脂中萜类含量增加,进而有助于高抗马尾松对松材线虫的防御过程。
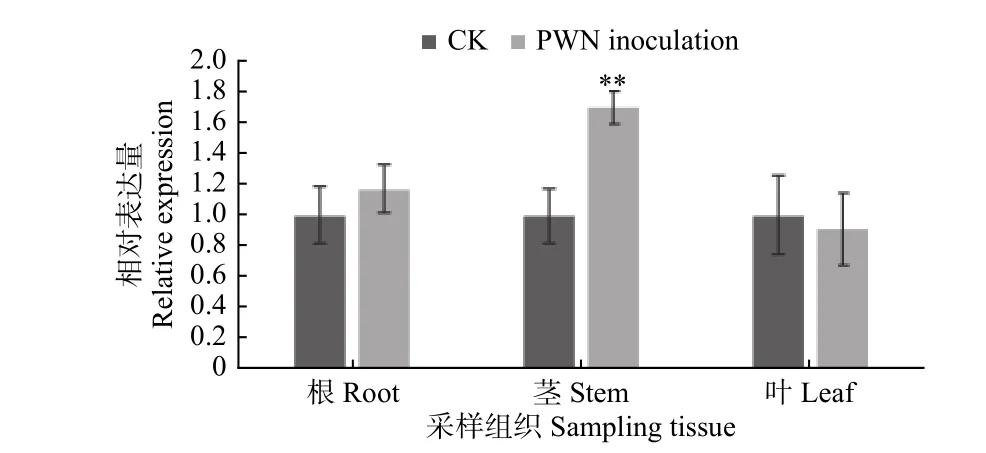
图 6 接种2 a后高抗马尾松不同组织PmPinS相对表达量分析Fig. 6 Analysis of relative expression of PmPinS in resistant P. massoniana after inoculated with PWN over 2 years

图 7 单萜类化合物对松材线虫的抑制作用Fig. 7 The inhibition of monoterpenes on PWN
2.4 萜类化合物对松材线虫的抑制作用
经多序列比对和系统发育分析鉴定,PmPinS为β-蒎烯合酶,可能参与松脂中α-蒎烯或β-蒎烯等单萜类化合物的合成。为检测松脂中主要萜类化合物对松材线虫的抑制作用,以马尾松松脂化学组分的主要单萜类化合物组成和含量为参考[36],其中,马尾松松脂中α-蒎烯的平均含量约为170~200 mg·g-1,β-蒎烯平均含量约为5.0~13 mg·g-1。因此,本研究设置不同浓度梯度的稀释液外源施加于体外培养的松材线虫(表1),以探究单萜类化合物对松材线虫的抑制作用。结果表明:与对照组相比,在α-蒎烯和β-蒎烯的单一溶液中,随着化合物浓度和处理时间的增加,松材线虫的平均存活率显著降低(图7)。α-蒎烯处理:浓度为500 mg·g-1处理0.5 h和浓度为150 mg·g-1处理24 h,松材线虫存活率几乎为零;β-蒎烯处理:实验组任意浓度处理0.5 h和6 h时,松材线虫平均存活率可被抑制50.00%,处理24 h时其抑制率可达90.00%(图7)。萜类化合物混合溶液对松材线虫的抑制作用显著高于单一溶液。低浓度的混合溶液处理6 h后,松材线虫存活率几乎为零(图7)。因此,初步得出结论:作为马尾松松脂的主要成分,α-蒎烯和β蒎烯可抑制松材线虫存活率。
3 讨论
萜类化合物是生态系统中重要的次生代谢产物[37],可介导植物与植物之间、植物与微生物之间以及植物与动物之间的相互作用,协调生态系统的可持续发展[38]。此外,萜类化合物还可以作为植物防御剂来增强生态系统功能,协调相邻植物、动物和微生物的生长、发育和繁殖[39]以及植物种群的形成和进化[40]。
据报道,植物萜类化合物能够抑制细菌、真菌和病毒的感染[41],且植物萜类各组分在抗菌方面具有协同作用[42]。油松、红皮云杉中萜类化合物对细菌、真菌和放线菌生长影响的微生物实验表明,松脂、松果提取物为50 mg·mL-1时可抑制放线菌生长,雪松提取物浓度为200 mg·mL-1时可抑制细菌和放线菌的生长,表明针叶树种萜类化合物对微生物具有抑制作用。油松、白皮松、金边龙柏中含有较高浓度的β-蒎烯,被认为是空气微生物传播的关键抑制剂,红皮云杉和雪松中含有较少的β-蒎烯,对微生物的抑制作用较小[16]。因此,β-蒎烯在抑菌过程中发挥重要作用。然而,也有研究表明,萜类化合物也可能作为植食性昆虫的引诱剂,且可以影响其觅食、产卵、寻找寄主等行为[43]。单萜化合物是马尾松松脂的重要化学组分,可以作为植保素对植食性昆虫的入侵起到直接防御作用[44]。α-蒎烯与β-蒎烯含量变化可直接导致松材线虫种群数量的增加,使其更容易进入寄主体内,且受损伤的松树体内α-蒎烯与β-蒎烯含量均高于健康株系[45-46]。也有相关研究表明,α-蒎烯浓度与松材线虫死亡率呈现正相关趋势[47];而β-蒎烯的抑菌作用高于α-蒎烯,β-蒎烯可通过影响受伤树体的真菌蓝变使松材线虫种群密度减小[48]。因此,β-蒎烯在针叶树种抵御病原体入侵过程中发挥重要作用。
萜类合酶是萜类化合物合成过程中的关键酶,植物的萜类合酶可划分为7个家族,即TPS-a-g。基于氨基酸序列的系统发育分析,TPS-d家族为裸子植物萜类合酶所特有,其中,单萜合酶(mono-TPS)、倍半萜合酶(sesqui-TPS)、二萜合酶(di-TPS)各聚为一个亚家族,分别为TPS-d1、TPS-d2、TPS-d3[49]。本研究克隆得到的β-蒎烯合酶基因,通过多序列以及系统进化树分析,鉴定为TPS-d1亚家族成员,符合单萜合酶的典型结构特征。在针叶树种中,单萜合酶最适反应条件为碱性, 且其酶活性催化需要金属离子辅助[44]。裸子植物中的单萜合酶包含α和β结构域结构以及I类活性位点,在金属离子的辅助下, 从而将GPP转换成环状或非环状单萜[17,50]。裸子植物中不同的TPS基因序列的保守性高约为70%[51],本研究获得的β-蒎烯合酶基因,与马尾松α-蒎烯合酶基因同源性为73.85%,与扭叶松β-蒎烯合酶基因同源性高达93.16%。
目前,已有20多种单萜合酶基因在针叶树中报道[52],而萜类合酶基因在参与各种生物与非生物胁迫方面的研究仍然较少。在被子植物中,也只有较少的研究表明食草性昆虫可诱导与防御相关的TPS基因表达[53]。玉米(Zea maysL.)中倍半萜烯合酶基因的表达受甜菜夜蛾幼虫(Spodoptera exiguaHuebner.)的摄食所诱导[54]。拟南芥中的白菜蝶(Pieris rapaeLinne.)幼虫的取食导致AtTPS10基因的转录水平升高[55],在玉米和花生的2个植物系统中,诱导的TPS基因表达均导致胡萜类化合物大量累积,间接参与防御过程[56-57]。在受虫害侵食的大陆棉中,GhTPS1与GhTPS2表达量上调[25]。在针叶树种中,有关TPS基因在针叶树中表达以应对昆虫袭击的报道甚少。Hall等鉴定了扭叶松和樟子松(P. sylvestrisLinn.)中的α-蒎烯合酶以及β-蒎烯合酶基因及其功能[54]。大冷杉、挪威云杉和北美云杉受到机械损伤、MeJA处理或生物胁迫时,单萜合酶基因明显上调[58]。在受到象鼻虫(Pissodes strobePeck.)入侵的北美云杉中,单萜合酶基因的表达水平显著上调[11]。海岸松(P.pinasterAiton)及意大利松(P. pineaL.)受到松材线虫侵染时,(-)-蒎烯合酶基因显著上调[35]。阿拉斯加云杉受到昆虫取食后,其(-)-蒎烯合酶基因PsTPS2表达量显著上调。通过对PsTPS2进行功能研究发现,PsTPS2可催化合成α-蒎烯与β-蒎烯,二者含量比例为35∶10,与在大冷杉中(-)-蒎烯合酶基因酶活产物(主要产物为α-蒎烯与β-蒎烯)相似,但比例(40∶60)略有差异[18]。α-蒎烯与β-蒎烯为阿拉斯加云杉松脂主要成分,在受到象鼻虫取食2 a后,木质部中的α-蒎烯含量增加了3倍,β-蒎烯含量增加了2.3~6.3倍[11]。经MeJA处理的挪威云杉和钻伤的白云杉(P. glauca(Moench)Voss)中,α-蒎烯与β-蒎烯也可在茎中大量积累,与茎中的单萜合酶基因表达量上调相呼应[59]。同时表明,单一酶可同时形成2种或多种产物。鉴于针叶树种单萜TPS合酶基因家族各成员之间的高度序列相关性,作者推断马尾松PmPinS或为多产物酶,可能催化α-蒎烯、β-蒎烯等萜类化合物。α-蒎烯和β-蒎烯为马尾松松脂中主要的单萜化合物,其含量变化可能受到松材线虫侵染所诱导。
本研究发现,以马尾松松脂中α-蒎烯与β-蒎烯的浓度为参考,外源施加不同浓度的α-蒎烯、β-蒎烯及其混合溶液于松材线虫,可明显降低松材线虫存活率,且混合溶液的抑制作用显著高于单一溶液。Wang等[60]研究发现,利用熏蒸法对松材线虫进行α-蒎烯处理,结果表明,随着α-蒎烯浓度增加松材线虫的死亡率增加。也有研究表明,对松材线虫施加蒎烯等多种单萜化合物可降低松材线虫活性[61]。β-蒎烯相对于α-蒎烯而言对蓝变真菌表现出较强的抑制作用。蓝变真菌为松材线虫的主要食物来源,因此,β-蒎烯可间接抑制松材线虫繁殖[61]。本研究结果与上述研究结果相似。然而,对于蒎烯类化合物对松材线虫的影响也有不同观点。Niu等[24]前期研究表明,α-蒎烯和β-蒎烯的浓度比例可以影响松材线虫及其伴生蓝变真菌的繁殖力。较低浓度的单萜化合物可能抑制松材线虫繁殖力,而高浓度的单萜化合物可能提高松材线虫的繁殖力。松材线虫的繁殖力在α-蒎烯和β-蒎烯的浓度比例为1∶0.8时较高,在α-蒎烯和β-蒎烯的浓度比为1∶0.1时较低。由此推断,萜类化合物对松材线虫的影响可能因各组分所占比例而有所差异。单萜合酶在不同植物、不同器官和组织部位中具有不同的功能[62-65],许多基因具有组织特异性以及抵御逆境特异性的表达模式,有助于提高植物对于食草性动物或病原体防御能力[66]。本研究中,马尾松β-蒎烯合酶PmPinS在接种后的高抗和易感马尾松中表达量差异显著,高抗马尾松中该基因的表达量明显高于易感马尾松,且随着接种时间增加而显著上调,且在接种2 a后长势良好但携带松材线虫的高抗马尾松茎部组织特异性高表达。由此说明,PmPinS基因可能参与了马尾松对松材线虫的防御过程,且具有正向调控作用。
4 结论
本研究首次从马尾松中克隆获得PmPinS基因,且对PmPinS基因的理化性质、蛋白结构、系统进化关系、响应松材线虫侵染的表达模式以及α/β-蒎烯对松材线虫的抑制作用进行了分析。PmPinS基因为单萜合酶家族的成员,可能参与β-蒎烯等单萜化合物的生物合成。接种松材线虫后,PmPinS基因在高抗马尾松中的表达量随接种时间上调并显著高于易感马尾松,且在高抗马尾松茎部组织特异性显著高表达,初步表明该基因可能参与马尾松对松材线虫的防御过程。对松材线虫外源施加PmPinS基因酶活产物α-蒎烯和β-蒎烯可显著抑制松材线虫存活率,证实PmPinS基因参与马尾松对松材线虫的防御过程,且对松材线虫的活性具有抑制作用。该结果将有助于马尾松抗松材线虫机制的解析,并为马尾松抗性品种的早期选择和松材线虫的有效防治奠定理论基础。
