氧化钼量子点无标记快速ATP检测
2020-11-27黄海清肖赛金杨光赵耀赵家辉
黄海清, 肖赛金*, 杨光赵耀, 赵家辉
(1. 东华理工大学 核资源与环境省部共建国家重点实验室培育基地, 江西 南昌 330013;2. 东华理工大学,化学生物与材料科学学院, 江西 南昌 330013)
三磷酸腺苷(adenosine triphosphate, ATP) 是各种活细胞内普遍存在的一种高能化合物,是各种生物活动的直接能量来源,在光合、酶催化、生物合成、DNA复制、细胞呼吸等各种生物过程中,ATP还是一种重要的信号分子[1,2],ATP水平的异常变化可用于指示疾病及病变的程度。此外,ATP含量与活细胞数目有着线性关系,可间接表达样品中细菌数量。因此,ATP快速检测可在临床诊断、药物筛选、食品卫生、环境监测等领域发挥重要作用[3-5]。
目前,已报道的ATP检测方法主要包括电泳分析法[6,7]、色谱分析法[8]、光学分析法[9]和生物传感器法[10,11]等。其中,光学分析法中的荧光分析在检测生物分子方面显示出独特的优势,有灵敏度高、选择性好等特点,是目前公认的较为理想的检测方法之一。常见的荧光探针有贵金属纳米团簇、有机染料、量子点(QDs)。相比较而言,QDs具有荧光产率高、激发光谱宽、荧光光谱窄的特点,因此QDs的应用受到越来越多的关注,尤其是在化学及生物分析领域。如Tedsana等[12]将半胱胺修饰CdS 量子点(Cys-CdS QDs)的荧光强度与ATP呈正比关系用于ATP的高选择性检测。Shi等[13]采用Cys-CdTe QDs为荧光团,Zn2+为猝灭剂,添加ATP,荧光性能恢复,实现了“off-on”模式的ATP检测。但重金属型量子点因毒性较大,在生物医学尤其是活体检测中难以展开应用[14]。因此,研究者开始尝试探寻低毒或无毒性的量子点。如胡先运等[15]以氧化石墨烯(GO)为猝灭剂,ATP适配体标记InP/ZnS 量子点(ABA-QDs),通过GO与ABA-QDs之间的长程共振能量转移(LrRET),对ATP进行检测。Xiong等[16]用MPA-Mn∶ZnS QDs为荧光探针,采用ATP 适配体为猝灭剂,实现生物体液中ATP的检测。但是,这些量子点荧光探针的合成过程要求严格,工艺偏复杂,且制备成本偏高。
氧化物钼是一种过渡金属半导体,其自然资源丰富、价廉、低毒,且有独特的电子、光学和力学性能[17,18];在气体传感、催化剂、光致变色等领域备受关注[19-21]。本课题组采用常温一步法制备出低毒性的荧光氧化钼量子点(MoOxQDs),目前已将基于MoOxQDs的荧光探针用于对卡托普利、2,4,6-三硝基苯、乙酰胆碱酯酶的快速检测[22,23]。本文以MoOxQDs为荧光探针,Cu2+为荧光猝灭剂,建立一种简单、快速、高灵敏的ATP检测方法。
1 实验部分
1.1 试剂与仪器
寡三磷酸腺苷(ATP)、三磷酸胞嘧啶(CTP)、牛血清白蛋白(BSA),上海生工生物工程有限公司;二硫化钼粉末(MoS2),美国Sigma-Aldrach公司;氢氧化钠(NaOH)、30%双氧水(30% H2O2)、浓盐酸(HCl)、氯化铜(CuCl2)、乙二胺四乙酸二胺(EDTA)、硫酸铁[Fe2(SO4)3]、氯化钙(CaCl2)、氯化镍(NiCl2)、氯化钴(CoCl2)、硫酸锰(MnSO4),均购于西陇化工股份有限公司;磷酸钠、磷酸氢二钠、磷酸二氢钠、焦磷酸钠,国药集团化学试剂有限公司;Tris缓冲液(C4H11O3),美国Solarbio公司。实验中所用试剂均为分析纯,使用前未经纯化,所有溶液均采用二次蒸馏水配制。
JEM-2010透射电子显微镜 (日立公司,日本),USB-4000荧光分光光谱仪(海洋光谱,美国),F-7000荧光分光光度计(日立公司,日本)。
1.2 实验方法
1.2.1氧化钼荧光量子点的制备
氧化钼荧光量子点(MoOxQDs)的制备方法参考文献[22]。200 mg MoS2粉末和16 mL 30% H2O2、6 mL H2O在40 ℃水浴反应4 h,加入NaOH调至pH中性,然后8000 r/min离心10 min,所得上清液即为氧化钼荧光量子点。
1.2.2Cu2+对MoOxQDs荧光猝灭的影响
在离心管中加入20 L 1 mg/mL MoOxQDs溶液、40 L 50 mmol//L Tris-HCl缓冲溶液、不同体积的1 mmol/L CuCl2溶液,最后用去离子水定容至400 L,充分振荡后静置,10 min后在405 nm下测定溶液荧光光谱。
在离心管中加入20 L 1 mg/mL MoOxQDs溶液、40 L 50 mmol/L Tris-HCl,20 L 1 mmol/L CuCl2溶液,以及不同体积的1 mmol/L EDTA溶液,最后用去离子水定容至400 L,充分振荡后静置,10 min后在405 nm下测定溶液荧光光谱。
1.2.3ATP测定方法
在离心管中加入20 L 1 mg/mL MoOxQDs溶液、40 L 50 mmol/L Tris-HCl缓冲溶液、20 L 1 mmol/L CuCl2溶液,以及不同浓度ATP溶液,最后用去离子水定容至400 L,充分振荡后静置,10 min后在405 nm下测定溶液荧光光谱,用520 nm处最强发射峰的荧光强度(FL)定量分析ATP含量。
2 结果与讨论
2.1 MoOx QDs的表征
通过TEM对MoOxQDs进行扫描测试可知,合成的MoOxQDs外貌为类球形,颗粒分散性能较好,粒径分布范围较窄,平均粒径约为1.7 nm(见图1)。
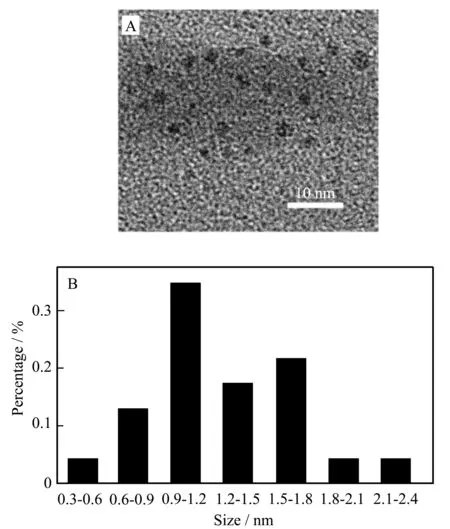
图1 MoOx QDs 的TEM图 (A)和粒径分布图 (B)
在307~447 nm不同激发光照射下,MoOxQDs均具有很强的荧光发光性能(图2),且在367 nm激发波下,于495 nm处产生最强的荧光信号;不同激发光下,发射峰位置随着激发波长变长而发生红移,说明MoOxQDs的荧光性能具有连续性和可调性。本文合成量子点的基本荧光性能与文献[22]报道基本吻合。
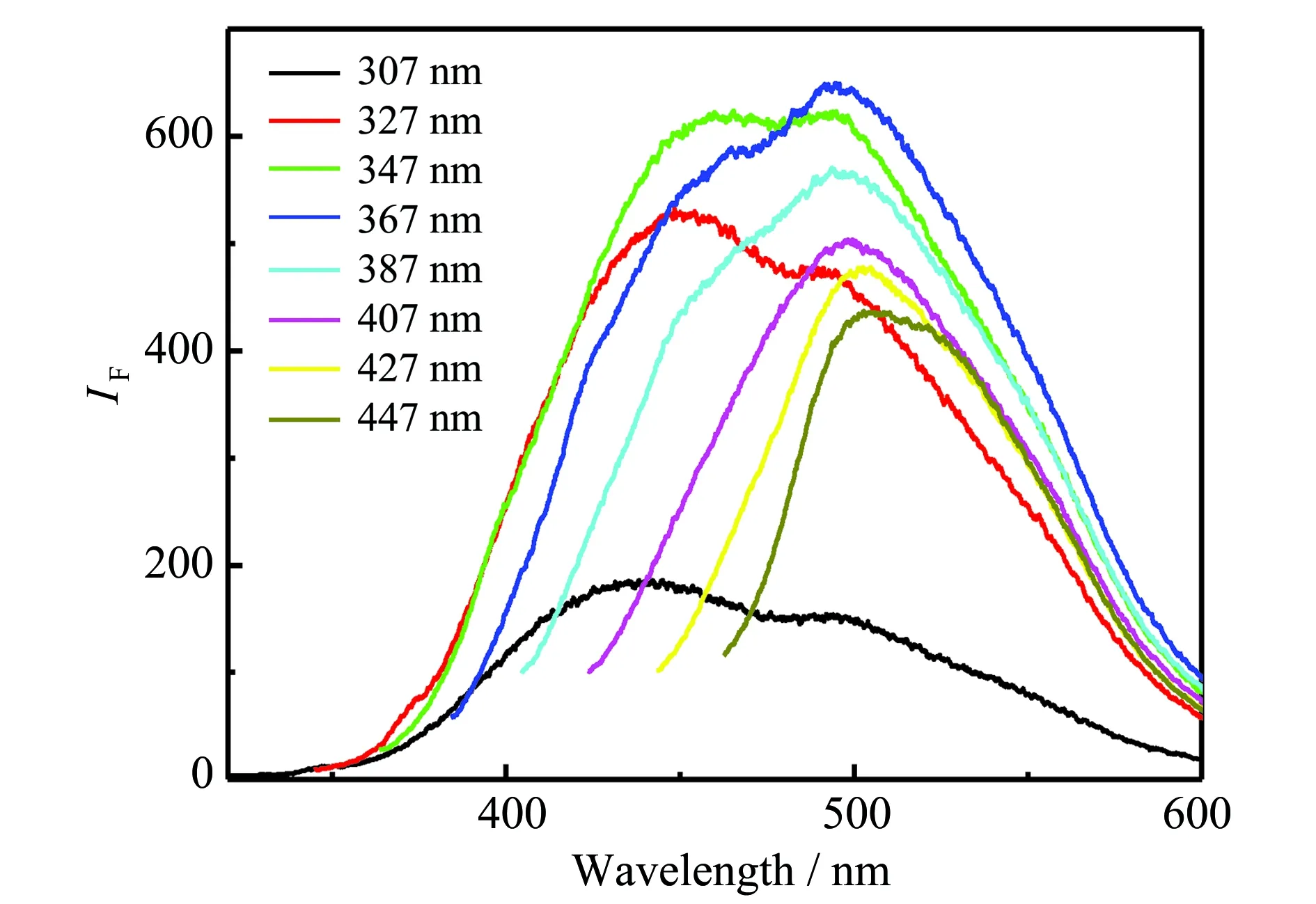
图2 不同激发光下MoOx QDs荧光发射光谱
2.2 Cu2+对MoOx QDs荧光猝灭的影响
为考察Cu2+对MoOxQDs荧光猝灭的动力学特征,研究了Cu2+和EDTA共同加入量对荧光强度的影响。图3显示,Cu2+浓度变化不影响荧光发射峰的形状,它们的最大发射波长均在520 nm,这表明Cu2+与MoOxQDs作用不会改变其晶体结构。当[Cu2+]为5~50 mol/L时,体系的荧光峰强度会随着Cu2+加入量增加而迅速下降(图3内插图),35~50 mol/L时,荧光猝灭率可达70%。本试验选择50 mol/L Cu2+溶液作为猝灭剂。如图4,在MoOxQDs-Cu2+体系中继续添加EDTA时,体系的荧光峰强度会随EDTA浓度增大而逐渐增强,即产生荧光恢复。当[EDTA]∶[ Cu2+]=1时,体系荧光强度可恢复到初始的95%以上。说明Cu2+对MoOxQDs的荧光猝灭性是可逆的。
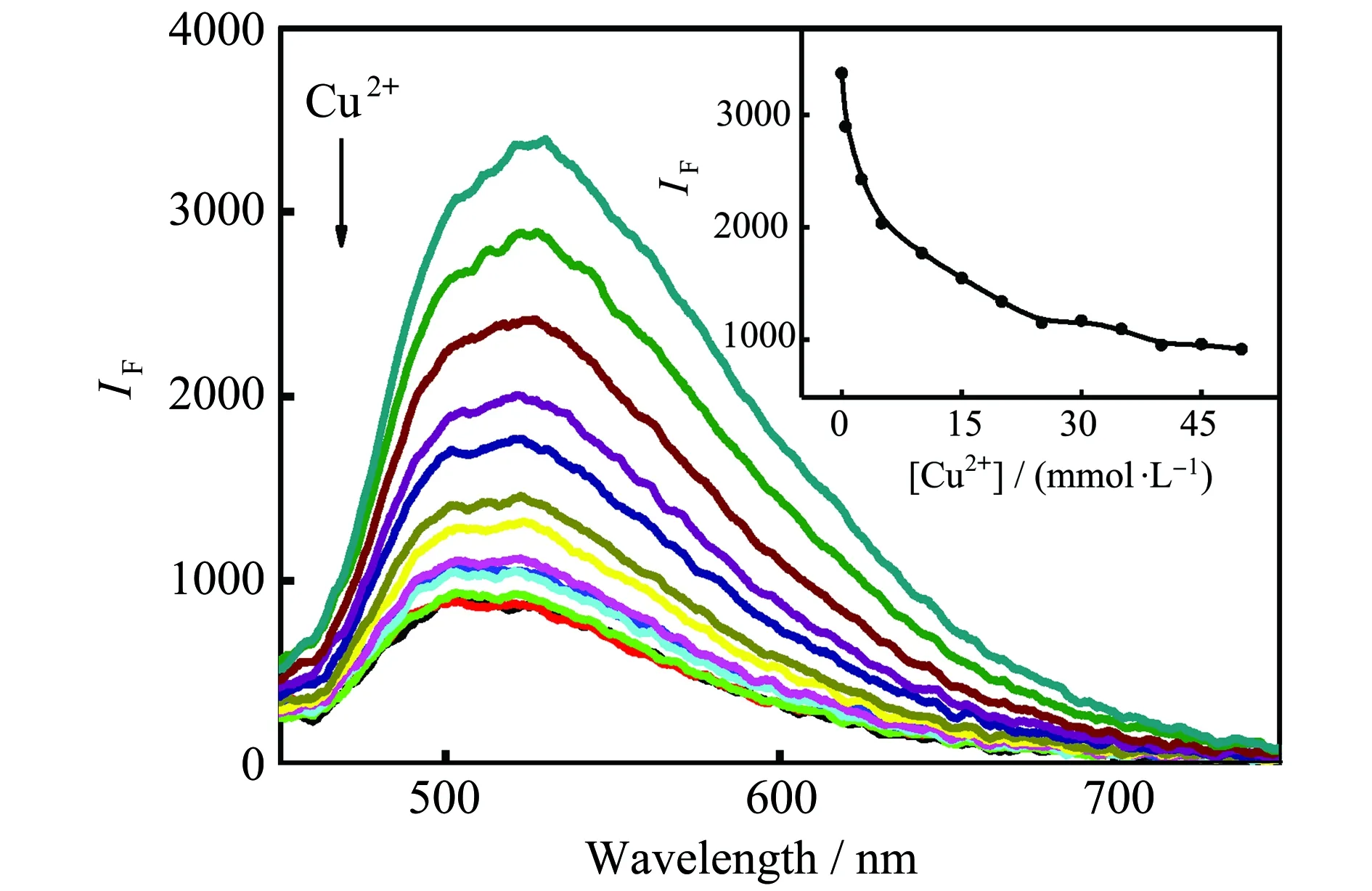
图3 Cu2+浓度对MoOx QDs荧光发射光谱的影响插图为520 nm处Cu2+浓度与荧光发射强度关系曲线(实验条件:0.05 mg/mL MoOx QDs,pH 7.5,Cu2+浓度从上到下为0、0.5、2.5、5、10、15、20、25、30、35、40、45、50 mol/L)
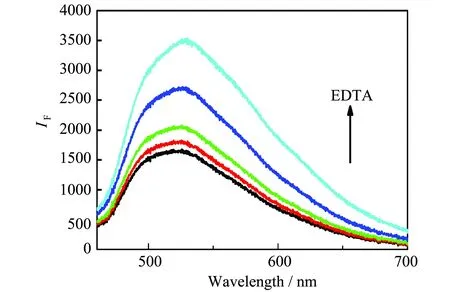
图4 EDTA对MoOxQDs -Cu2+荧光发射光谱的影响(实验条件:0.05 mg/mL MoOx QDs,[Cu2+]=50 mol/L,pH 7.5,EDTA的浓度从下到上分别为0、12.5、25、37.5、50 mol/L)
Cu2+对MoOxQDs的荧光猝灭作用机理大致为:Cu2+通过弱键与MoOxQDs之间发生结合作用形成了非荧光的基态化合物,产生静态荧光猝灭,即“off”状态。与Cu2+能产生强亲和作用的化合物,将Cu2+从MoOxQDs上分离并释放出MoOxQDs,体系荧光性能得到恢复,即“on”状态。ATP是一种典型的磷酸化合物,其磷酸基团可通过P-O-与Cu2+产生强烈作用。向MoOxQDs-Cu2+体系加入ATP时,Cu2+会从MoOxQDs表面分离下来,重新释放量子点,从而使猝灭的荧光性能得到恢复,如图5所示。基于上述分析,本文构建“off-on”型MoOxQDs-Cu2+检测平台用于ATP检测。
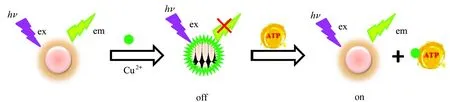
图5 检测ATP原理示意图
2.3 ATP的检测
一般情况下,检测环境的pH值对检测效果影响很大,为了增强MoOxQDs-Cu2+检测平台的稳定性和选择性,优化检测方法,实验考察了溶液pH值对MoOxQDs荧光猝灭及荧光恢复的影响。如图6所示,在弱酸性条件下,荧光强度较低,且酸性越强荧光强度越弱。当pH 7.5时,荧光强度最弱。在pH 8.0~9.5碱性性条件下,荧光强度随碱性的显著增强。这可能是在碱性条件下-OH与Cu2+作用的几率增大,从而抑制了Cu2+对MoOxQDs的结合,导致荧光猝灭不完全,甚至无荧光猝灭产生。ATP对MoOxQDs的荧光恢复性在pH 6.0~9.5时,变化幅度不大。当Cu2+与MoOxQDs的作用完全被抑制时,MoOxQDs的荧光强度可恢复到初始状态。为使检测的“off-on”过程明显,本试验pH值优化为7.5。

图6 pH对MoOx QDs-Cu2+和MoOx QDs-Cu2+/ATP对520 nm处荧光发射性能的影响(实验条件:0.05 mg/mL MoOx QDs,[Cu2+]=50 mol/L,或ATP:200 mol/L)
如图7所示,在优化后的实验条件下,荧光强度随着ATP浓度的增大而不断增强;且ATP浓度为25~250 mol/L时,荧光强度(F)与ATP浓度(c,μmol/L)呈现良好的线性关系(图7插图),拟合线性方程为F=785.40+9.05c,相关系数R=0.993,该线性使用范围比文献[12]中的20~80 mol/L宽。

图7 ATP对MoOx QDs-Cu2+ 荧光发射光谱的影响插图为520 nm处ATP浓度与荧光发射强度关系曲线(实验条件:0.05 mg/mL MoOx QDs,[Cu2+]=50 mol/L,pH 7.5,ATP浓度自下而上依次为0、25、50、75、 100、125、150、175、200、250 mol/L)
为进一步验证MoOxQDs-Cu2+检测平台对ATP荧光检测方法的灵敏性,本文考察了BSA、Ni2+、Mn2+、Fe3+、Co2+、Ca2+等可能共存物对量子点荧光的影响,见图8。当干扰物为非磷酸盐化合物时,对应的荧光恢复程度不及ATP的1/10;当干扰物为含磷酸盐的CTP时,其荧光恢复程度仅为ATP的1/2。所以,该检测方法在无磷酸盐干扰时检测灵敏性高,由于该荧光检测的机理主要为离子间键的相互作用,该作用没有方向性,但在含磷酸盐干扰环境下可进行半定量分析。

图8 MoOx QDs荧光探针对ATP的选择性(实验条件:0.05 mg/mL MoOx QDs,[Cu2+]=50 mol/L,pH 7.5,ATP:250 mol/L,Ni2+、Mn2+、Fe3+、Co2+、浓度均为500 mol/L)
3 结论
本文以MoOxQDs 为荧光探针,Cu2+为猝灭剂,构建新型“off-on”荧光传感器用于ATP快速检测,该检测响应时间快,荧光性能强且稳定。在1 mg/mL MoOxQDs,50 mol/L CuCl2,Tris-HCl缓冲pH 7.5、ATP浓度为25~250 mol/L优化条件时,体系荧光强度与ATP浓度呈线性关系,相关系数为0.993;除含磷酸盐化合物外,该检测方法的抗干扰性高。因此,本文的ATP检测方法具有制备技术简单、性能稳定、检测时间短、灵敏度高,且线性使用范围宽等特点,可为环境及食品等领域的品质评价提供一种新的快捷检测方法。
