含氟化物和氯己定牙膏的抗菌性能的体外研究
2020-11-27陈玉莲秦子玥
陈玉莲,秦子玥,陈 武
牙菌斑生物膜是牙周病的始动因子,也是龋病发生的主要因素,菌斑控制是防治牙周病及龋病的关键[1]。使用牙刷、牙膏是目前最常见的用来控制菌斑的方式。牙膏中常见的抑菌成分有:氟化物、氯己定、三氯生、中药提取物、溶菌酶等[2]。
氟化物,如NaF,对细菌的生长抑制作用更强,这可能是由于氟和一些阳离子对细菌生长有共同的抑制作用[3]。氟化物通过抑制牙齿硬组织的脱矿作用和增强牙齿的再矿化来预防龋坏[4],氟能抑制细菌胞体大分子脂磷壁酸的合成,干扰细菌对牙面的粘附。且氟能抑制细菌对葡萄糖的摄取,影响多糖的合成,抑制细菌产酸,干扰碳水化合物的代谢[5]。但氟化物因其高浓度时的急性、慢性毒作用,所以在牙膏中使用有其局限性。
氯己定是一种阳离子活性剂,对革兰阳性菌、革兰阴性菌、真菌等均有广谱抗菌作用[6-8],通过提高细胞膜渗透性以及凝固细胞质大分子的方式杀菌[9]。但是氯己定因其易被牙膏中的常见的清洁剂成分十二烷基硫酸钠(又名月桂醇硫酸钠)灭活,故很少作为牙膏中的添加剂[10]。而且长期使用浓度为0.1%~0.2%的氯己定漱口液会产生牙齿、修复体、舌体的染色[11]。
1 材料与方法
1.1 主要试剂和仪器
羟基磷灰石圆片(hydroxyapatites discs, HAs)(直径6 mm,厚度2 mm,型号:HA-Z21)购自昆山华侨科技新材料有限公司;活死菌染料(LIVE/DEADTMBacLightTMBacterial Viability Kit)(Invitrogen,美国);人工唾液(索莱宝,中国);结晶紫染料(碧云天,中国);维生素K、氯化血红素(阿拉丁,中国);牛肉膏、蛋白胨、脑心浸出液(Brain Heart Infusion,BHI)(OXOID,英国);琼脂粉剂(Biofroxx,德国);激光共聚焦显微镜(confocal laser scanning microscope,CLSM)(ZEISS LSM710,德国CarlZeiss)。
1.2 试验菌株和培养条件
牙龈卟啉单胞菌(Porphyromonasgingivalis,P.gingivalis)菌株BNCC 337441、变异链球菌(Streptococcusmutans,S.mutans)菌株BNCC 336931、大肠埃希氏菌(Escherichiacoli,E.coli)菌株BNCC 336902、金黄色葡萄球菌(Staphylococcusaureus,S.aureus)菌株BNCC 186335购自北京北纳创联。血链球菌(Streptococcussanguis,S.sanguis)菌株ATCC 49295购自美国ATCC菌种库。
BHI液体培养基:双纯水250 mL、BHI粉7.5 g,121 ℃高温高压灭菌20 min。
BHI血琼脂固体培养基(BHI-S):双纯水250 mL、BHI粉7.5 g、琼脂粉2.5 g,121 ℃高温高压灭菌20 min,冷却至60 ℃左右,加入脱纤维无菌羊血15 mL。
BHIHK固体培养基:在上述配方冷却至60 ℃左右后,添加0.5%氯化血红素-维生素K溶液2.5 mL。
LB固体培养基(LB-S):双纯水1 L、牛肉膏5 g、蛋白胨 10 g、氯化钠 5 g、琼脂20 g、调节pH 至7.2~7.4,121 ℃高温高压灭菌20 min。
S.sanguis、S.mutans均培养于BHI-S培养基中;E.coli、S.aureus培养于LB-S培养基中;P.gingivalis培养于BHIHK培养基中。S.sanguis、S.mutans、P.gingivalis培养于厌氧/微需氧培养箱中(37 ℃,90% N2, 5% CO2, 5% H2);E.coli、S.aureus培养于恒温培养箱中(37 ℃,5% CO2)。
基于ROM查找表方式的FPGA控制,通过状态机处理方式对任意模式的参数进行读取然后写入到相应芯片内部,实现切换不同通信系统的目的。
1.3 试验牙膏
牙膏A:主要活性成分:氯己定二葡糖酸盐、氟化铝(氟含量:0.136%);牙膏G:主要活性成分:氟化钠(0.14%氟);牙膏Z:主要活性成分:单氟磷酸钠(0.14%,以总氟计)。
1.4 方法
1.4.1 抑菌环实验 取出上述5种细菌冻存管,复苏,传2~3代后于培养皿内划单菌落,经鉴定纯培养后备用。每种菌浓度稀释约为1×106CFU/mL,取100 μL菌液,滴于相应细菌固体培养基内,5种细菌分别接种至3个相应细菌的培养皿,共计15皿。用L型细胞涂抹棒铺平,取无菌并干燥的直径为6 mm的滤纸片贴放于上述培养皿内。其中3片分别添加50 mg的试验膏体(A、G、Z),1片不做处理。将培养皿按接种细菌的培养条件放于相应培养箱中,培养24 h。用游标卡尺测量抑菌环的直径(包括贴片)3次取平均值并记录。
1.4.2 三菌种生物膜的体外构建 体外培养S.mutans、S.sanguis、P.gingivalis,用BHI液体培养基稀释S.mutans、S.sanguis菌液浓度至1×107CFU/mL,稀释P.gingivalis菌液浓度至2×107CFU/mL。在48孔板中放入无菌的HAs,并加入400 μL的人工唾液浸没。每孔各加入100 μL 3种菌的菌液,避光孵育培养48 h后,于HAs表面形成三菌种生物膜。将已成膜的HAs分为3组,分别为牙膏A组、牙膏Z组、PBS对照组(n=4片/组),用于下述实验。
1.4.3 HAs表面生物膜的处理 取5 g膏体,10 mL PBS,玻棒搅拌2 min制成膏液。小心吸除48孔板内的液体。向HAs表面分别加入400 μL的相应膏液或PBS,于摇床(100 r/min)处理2 min。PBS漂洗3次。每天早/晚8点各处理1次,连续5天。每次处理完,用无菌镊将HAs取出放于新的孔里,每孔加入300 μL BHI液体培养基、400 μL人工唾液,避光孵育于厌氧培养箱中。
1.4.4 结晶紫染色 用结晶紫染色的方法来表示HAs表面的生物膜量,从而比较不同牙膏对生物膜的清除作用。将5 d处理后的3组HAs用PBS漂洗2次,甲醇固定5 min。弃液,PBS漂洗2次后,将48孔板放于37 ℃烘箱内烘干。每孔加入400 μL结晶紫染料,染色15 min。弃液,PBS漂洗2次,加入95%乙醇400 μL,将48孔板放于摇床(100 r/min)脱色30 min。每孔内取100 μL加入96孔板中,于分光光度计上595 nm处测量每孔吸光度OD值。其OD值即代表HAs表面生物膜的量。
1.5 活死菌混合荧光染料染色
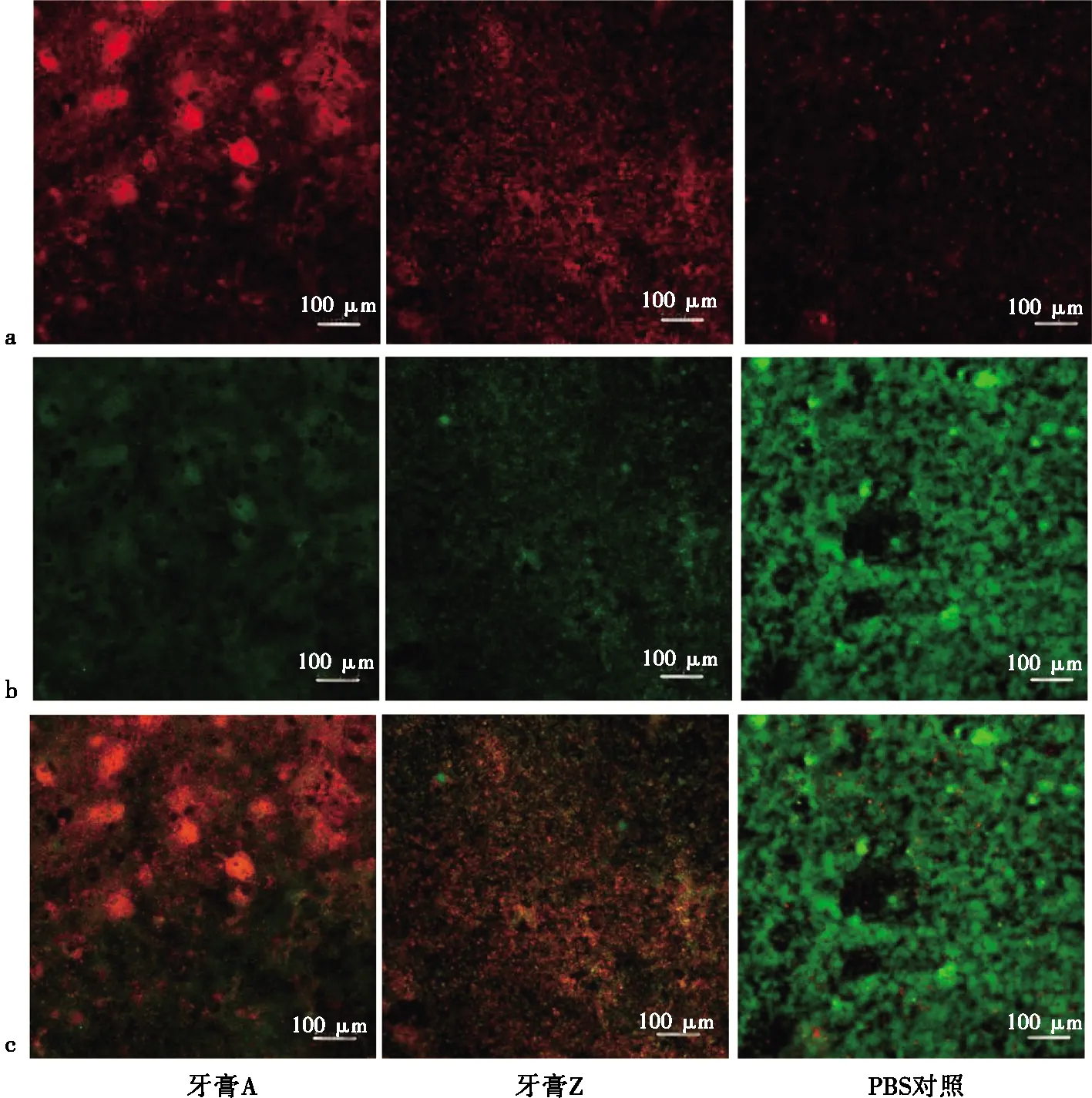
为进一步深入了解牙膏对生物膜的作用,我们用活死菌染料标记生物膜内的活菌和死菌,并在CLSM下观察生物膜三维结构。将5 d处理后的3组HAs用PBS漂洗2次,每孔各加入400 μL活死菌染料,避光孵育15 min。弃液,PBS漂洗2次,用无菌滤纸条吸干。用无菌镊子取出HAs,将有生物膜的一面朝下放于载玻片上,置于CLSM下观察。观察条件如下:激发波长分别为488、561 nm,物镜×10,目镜×10。每个生物膜标本由内(生物膜和HAs相贴的一面)向外(生物膜游离的一面)逐层沿Z轴扫描。通过专业软件三维重建,测量HAs表面生物膜厚度、红绿色荧光强度,计算生物膜和活性,公式如下:生物膜活性=绿色荧光强度÷(红色荧光强度+绿色荧光强度)×100%。
1.6 统计学方法
采用 SPSS Statistics 18软件进行统计分析。不同牙膏对同一细菌作用产生的抑菌环大小间差异、不同组间的差异均用单因素方差分析(One-Way ANOVA)进行比较。以P<0.05为差异有统计学意义。以上实验均至少重复3次。
2 结 果
2.1 抑菌环实验
一般抑菌直径在16 mm以上为高度敏感, 10~15 mm 为中度敏感,7~9 mm为低度敏感,无抑菌环者判断为阴性。
3种牙膏对5种菌均有一定的抑菌作用,其中对S.aureus、E.coli、S.sanguis均高度敏感;而对S.mutans、P.gingivalis中低度敏感。对S.aureus、E.coli的抑制作用,三种牙膏无差异;对S.mutans的抑制作用,A、G牙膏均明显优于Z牙膏;对S.sanguis的抑制作用,牙膏G明显优于牙膏A和Z,牙膏Z的抑菌效果优于牙膏A;对P.gingivalis的抑菌作用,牙膏G明显优于牙膏Z(图1)。

a:S.aureus;b:E.coli;c:S.mutans;d:S.sanguis;e:P.gingivalis;f:抑菌环数据其中A:牙膏A;G:牙膏G;Z:牙膏Z;K:空白对照组(因抑菌环数值为0,未在图f中显示);*:P<0.05,**:P<0.01,***:P<0.001图1 不同牙膏对细菌的抑菌作用Fig.1 Antibacterial effects of different toothpastes
2.2 结晶紫染色
经A、Z两种牙膏处理后的HAs表面生物膜的量均有减少,其中A组和对照组之间有显著统计学差异,而Z组较对照组之间虽有减少但无统计学意义(图2)。

**:0.001 通过对菌斑生物膜进行活死菌染色,PI探针标记死菌,STYO-9探针标记活菌,在CLSM下扫描HAs表面的菌斑生物膜,分析获得的活菌图、死菌图、活死菌混合图(图3)。结果表明,经过牙膏表面处理的HAs表面生物膜较对照组,绿色荧光强度(活菌)明显减弱,而红色荧光强度(死菌)明显增强;牙膏处理组生物膜表面结构较对照组疏松多孔。 a:红色荧光为死菌重建图;b:绿色荧光为活菌重建图;c:活死菌混合重建二维图图3 激光共聚焦下HAs表面生物膜活死菌重建图Fig.3 Typical live/dead staining confocal images 生物膜厚度为CLSM经Z轴扫描时,从HAs表面(靠近生物膜的一侧)到生物膜游离面(靠近载玻片的一侧)之间的距离。经A牙膏处理过的生物膜厚度较PBS对照组减少。Z牙膏处理组较对照组生物膜厚度虽有减少,但无统计学意义(图4a)。对于生物膜活性,A组和Z组均较对照组有明显统计学差异,A组和Z组之间的差异并无统计学差异(图4b)。三维重建后的生物膜立体结构更加清楚,能更明显地看出牙膏处理组较PBS对照组的菌斑生物膜结构疏松,死菌占总体比例多(图5)。 a:不同组处理后HAs表面生物膜厚度;b:不同组处理后HAs表面生物膜活性; *:0.01 图5 生物膜三维重建图Fig.5 3D images of reconstructive biofilms S.aureus是一种革兰阳性菌,是人类最常见的致病菌之一,可导致多种类型的感染,如局部伤口或术后感染[13]。E.coli是一种革兰阴性菌,是人和动物体内的常见菌群。但有条件致病性,或可造成腹泻、腹痛及更严重的疾病,危害人体健康[14]。S.aureus和E.coli较为常见,分别为革兰阳性菌和革兰阴性菌的代表菌属。这两种菌因容易培养和鉴别,且通常没有固有抗药性,常被用于抗菌实验。S.mutans在口腔中产生乳酸、变链素,S.sanguis对于S.mutans产生的变链素敏感[15],S.sanguis可以代谢产生过氧化氢,对厌氧或兼性厌氧菌具有拮抗作用[16]。因此这两种菌之间的平衡对龋病的发生发展至关重要[17-18]。P.gingivalis是一种革兰阴性菌,被证明是牙周炎的主要致病菌[19],且目前的研究表明,其与全身多种疾病的发生发展有关[20]。 唾液中的前体蛋白选择性地吸附在牙齿表面形成获得性薄膜,这层薄膜形成之后,细菌立即粘附在牙面上形成牙菌斑。最初粘附到牙面的是球菌,在获得性膜形成后,细菌主要通过Ca2+的静电作用粘附在膜的表面,其后细菌通过表面特异性的粘附素,与相应的受体结合。首先粘附到牙面的主要是S.sanguis。S.sanguis在牙齿定植并提供S.mutans所需的生长因子——对氨基苯甲酸。先锋菌在牙面吸附后,不同细菌直接粘附在一起,形成了牙菌斑生物膜中“栅栏”“谷穗”样聚集,丝状菌彼此平行并与牙面呈垂直排列,形成栅栏,球菌杆菌分散其间。 本研究体外培养含S.mutans,S.sanguis和P.gingivalis的三菌种生物膜。S.mutans和S.sanguis相互作用,并且在龋病的发生发展中起到重要作用,而P.gingivalis是牙周炎症发展的主要致病菌[21-22]。这种体外研究的模型从一定程度上最接近口腔常见的致病生物膜的基本结构。多个研究表明,这种静态多菌种模型具有高度的可重复性,故在抗菌相关研究中常用[23-25]。 唾液是一种天然冲洗液,能冲刷、稀释和清除停留在口腔、牙面上的细菌,使细菌成菌落,抑制细菌粘附,易于细菌清除,是口腔微生态重要的生态因子,在维持口腔生态平衡方面起主要作用。同时,唾液又是口腔微生物的培养基,牙菌斑生物膜细菌的营养来源之一。本研究采用人工唾液包被的HAs,从一定程度上还原口腔菌斑生物膜的形成环境。 CLSM以激光为光源,采用共聚焦技术和点扫描技术,使其分辨力较传统光学显微镜大为提高,其具有的活细胞动态监测、断层扫描及三维图像重建等功能,联合其他生物学技术,可定性、定量、定位地检测组织细胞内的多种生化成分,因此常被用来观察生物膜结构。从三维重建的菌斑生物膜(图5)可以看出,经牙膏处理过的生物膜结构较疏松,在膜间可见孔隙状结构,整体死菌较多。而PBS对照组的生物膜以活菌为主。这表明无论是仅含氟化物活性成分的牙膏还是含氟化物和氯己定双活性成分的牙膏,对于生物膜的活性都有一定的抑制作用。 而加入氯己定的含氟牙膏较普通含氟牙膏在对生物膜的量和厚度上有明显的抑制作用,这与普通含氟牙膏有很大的差异。但因为牙膏是复合成分,这种抑制作用是来源于氯己定,还是氯己定与氟化物的联合作用,尚难以说清。故本研究只能说明这两类牙膏之间的抗菌差异,对其中起到具体抗菌作用的成分,以及具体的抗菌机制还有待下一步的研究。 在本体外研究中,仅含氟化物的牙膏和含氟化钠、氯己定的牙膏对5种细菌均有抑菌作用。而对由S.mutans,S.sanguis和P.gingivalis形成的三菌种菌斑生物膜的抗菌作用,在生物膜活性上,两类牙膏均表现出很好的灭菌效果,较PBS对照组有显著差异。在生物膜的厚度、生物膜量上,含氟化钠和氯己定的牙膏表现出明显的抑制效果,而仅含相同浓度氟化物的牙膏较PBS对照组没有明显作用。2.3 CLSM下的菌斑生物膜


3 讨 论
4 结 论
