表面活性剂AOT在聚乙二醇200和水混合溶液中聚集行为的研究
2020-11-27鲍红翠
李 莎 鲍红翠 张 骞 刘 敏 刘 杰
(聊城大学 化学化工学院、山东省化学储能与新型电池技术重点实验室,山东 聊城 252059)
表面活性剂的临界胶束浓度 (cmc) 作为表面活性的一种量度,在它前后溶液的物理化学性质会发生显著变化.表面活性剂分子由极性亲水基和非极性憎水基组成,随着材料科学、生命科学研究的不断发展,表面活性剂在水溶液中丰富的自聚集行为使其在化妆品、食品、生物技术等的研究中充当了重要角色[1,2].与水溶液体系相比,非水溶剂及其混合溶剂中表面活性剂的聚集行为研究不多,且起步较晚.1969年Ray等人率先研究了非水极性溶剂中单一表面活性剂分子胶团形成的性质及规律[3],开始了表面活性剂体系的一个新的研究方向,即表面活性剂在非水溶剂或混合水溶剂中的聚集行为研究.
聚乙二醇200作为一种无毒且热稳定性好的绿色溶剂,同时也是一种弱极性的水溶性聚合物,易溶解在水、二氯甲烷、醇、甲苯和丙酮中,形成混合溶剂,最常见的是其与水组成的混合体系.与纯水相比,PEG的低聚物可以产生疏溶剂作用,其与水作为混合溶剂时,极性的降低可以影响胶束表面电荷密度以及聚集数的大小,从而改变表面活性剂体系的临界胶束浓度[4,5].同时,不同分子量的PEG由于聚合程度和链长的不同在物理化学性质方面均有差异[6].PEG 200作为优选的添加剂或溶剂可以与不同的表面活性剂相互作用,我们之前研究了PEG 200作为溶剂,阴/阳离子混合表面活性剂体系的混溶性在特定混合比例下得到明显改善,解决了沉淀的问题[7].在此之前Berg[8]和Hollamby[9]等人利用小角中子散射、电导率和动态光散射等方法研究了溶剂组成和性质对AOT胶束化行为的影响.另外,部分文献研究了AOT在水油混合体系中的自组装行为[10,11],但是将一种聚合物和水作为混合溶剂的研究很少.本文通过多种方法测定AOT在不同质量分数PEG 200水溶液中的聚集行为和热力学性质,一方面丰富了表面活性剂聚集行为的界面和热力学数据,另一方面使得按需调控体系的cmc,以期在胶束作为反应介质,对胶束催化和药物运输等领域的研究具有一定的基础意义.
1 实验部分
1.1 试剂
磺酸钠琥珀酸二辛酯 (AOT)、聚乙二醇200 (PEG 200)、芘均购自天津Alfa Aesar公司;甲醇购自天津化学试剂公司;配制溶液所用水为三次蒸馏水;图1为所用试剂结构.
1.2 实验方法
1.2.1 表面张力测定. 使用BZY-1全自动表面张力仪(上海平衡仪器仪表厂),用吊片法测定了AOT在不同含量PEG 200水溶液中的表面张力,实验温度控制在298.15 (± 0.01) K,所有样品测试之前放置20 min,所有实验重复测定三次,测量误差控制在± 0.1 mN/m.
1.2.2 稳态荧光测定. 使用F-4600荧光分光光度计,芘作为荧光探针,发射光谱扫描选择激发波长为335 nm,激发狭缝 (EX) 和发射狭缝 (EM) 均为2.5 nm,记录350-450 nm范围内的光谱数据,实验温度控制在298.15 (± 0.01) K.将一定浓度芘的甲醇溶液注入样品瓶中,用高纯氮气吹干,使加入样品后芘的浓度为2.5×10-6mol/L,测试前使用超声浴槽震荡1 h恒温放置12 h,使芘完全溶解后进行荧光测定.
1.2.3 电导率测定. 使用DDS-11C型电导率仪,实验温度控制在298.15 (± 0.01) K,先测定去离子水的电导率,然后测定一定质量分数的PEG 200水溶液的电导率;将一定浓度的AOT溶液使用微量注射器逐滴加入盛有PEG 200水溶液的恒温池中,不断搅拌并测其电导率,最终的电导率曲线扣除了相应的PEG 200水溶液的电导率,测量的准确性控制在± 2 %以内.
1.2.4 等温滴定微量热测定. 使用TAM公司的2277型纳瓦式等温滴定微量热仪,实验温度控制为298.15 (± 0.01) K,滴定瓶为1 mL的安瓿瓶,使用金搅拌器搅拌,速率为50 rpm.将滴定和参比安瓿瓶中分别加入0.5 mL和0.75 mL同一质量分数下的PEG 200水溶液,并用此溶液为溶剂配置浓度为4 cmc的AOT溶液 (cmc上述方法已得到),将样品装入500 μL Hamilton注射器中,通过612型泵控制,以每滴12 μL逐滴滴入安瓿瓶中,滴定间隔为35 min[12],然后走基线10 min,使量热信号有足够时间回到基线,待基线平稳后启动实验,搅拌热自动扣除.
2 结果与讨论
2.1 表面张力法研究混合体系聚集行为
表面张力法是研究临界胶束浓度 (cmc) 的常用方法之一.在临界胶束浓度之前,表面活性剂的加入使得溶液表面张力降低,临界胶束浓度时出现转折点,此后表面张力随浓度增加不再下降,溶液表面达到动态吸附平衡.PEG 200因其具有良好的水溶性和分散性,加入后也会引起溶液表面性质的诸多变化.Rosen提出将cmc处的表面张力定义为表面活性剂降低水的表面张力的效能,它是指一个表面活性剂能使水的表面张力下降到的最小值,通常用临界胶束浓度时的表面张力γcmc来表征.
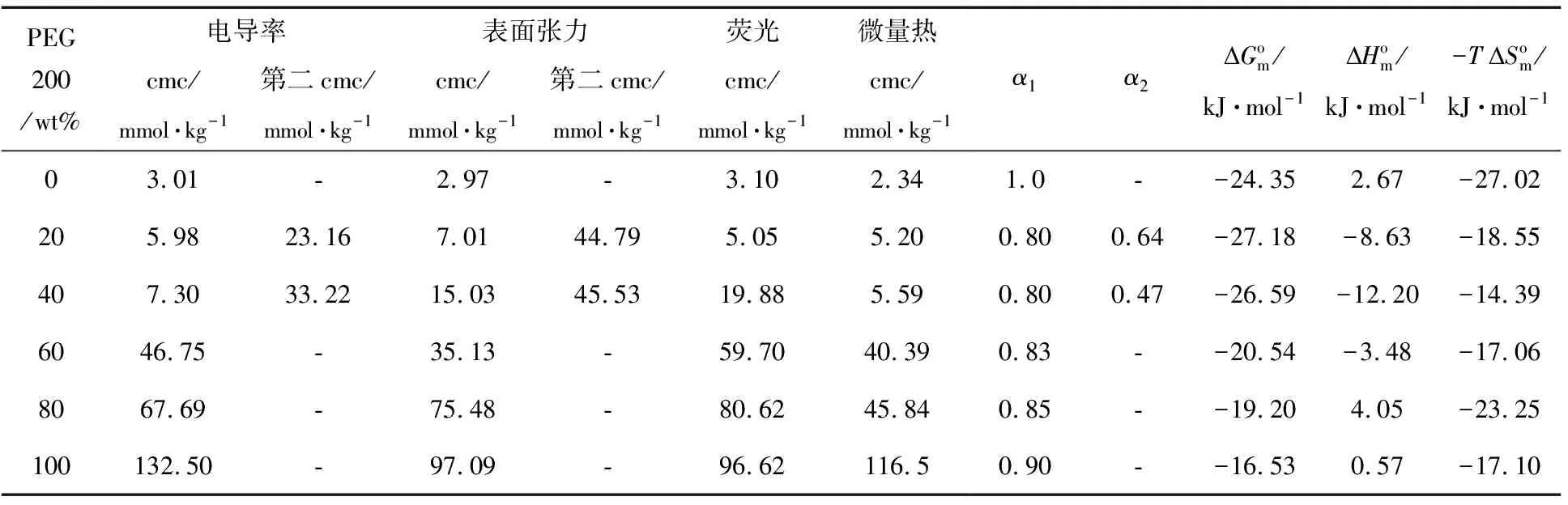
图2是AOT在不同浓度PEG 200水溶液中的表面张力图,其中插图是体系γcmc值随PEG 200质量分数的变化曲线.具体数据列于表1中,由数据可知:AOT在纯水中的cmc值与文献值相吻合[7].与纯水相比,混合溶剂中PEG 200含量小于60 wt%时,γcmc值较低;大于60 wt%时,γcmc值较高.同时PEG 200的弱极性削弱了AOT单体碳氢链间的相互作用,使AOT单体更难聚集成胶束,cmc值与纯水作为溶剂相比提高了几十倍,这也体现出PEG 200良好的助溶作用.由图2可知,AOT在质量分数为20 wt%、40 wt%的PEG 200水溶液中出现了双拐点现象,与文献报道的聚合物在表面活性剂水溶液中的表面张力曲线类似[13].推测两个转折点分别对应不同的聚集状态,两个拐点处对应浓度分别是聚合物与表面活性剂相结合的起始和终止浓度,且第一个转折点对应预胶束的形成[14].另外,我们之前测定了AOT在20 wt% PEG 200/水混合溶剂中的聚集行为[17],由文献中所测低温透射电镜图,推测在308 K左右,为胶束和棒状胶束的混合体系.
2.2 荧光法研究混合体系聚集行为
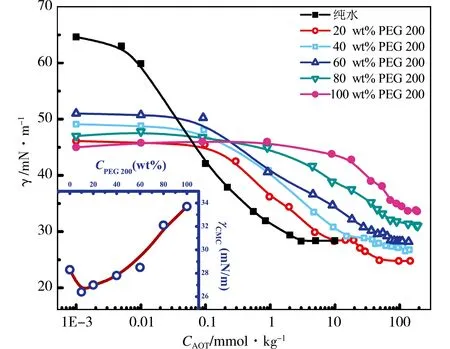
图2 298.15 K、101.325 kPa下,AOT在不同质量分数的PEG 200/水溶液中的表面张力曲线(插图是体系γcmc值随PEG 200质量分数的变化曲线)
我们进一步通过荧光法验证以上结论.芘具有独特的荧光特性,其单体的稳态荧光光谱有5个特征峰,芘可以增溶在胶团栅栏层或者胶束内部,在不同极性的微环境中各荧光发射峰的相对强弱不同[15].其中分别位于373 nm及384 nm的第一个峰和第三个峰强度的比值I1/I3对环境变化最为敏感,该值随芘分子所处环境极性降低而减小.图3(a)为AOT-PEG 200体系的荧光曲线,对曲线做一次微分,微分曲线上最低点所对应AOT浓度即为临界胶束浓度.图(b)为AOT在不同质量分数的PEG 200/水溶液中的荧光曲线,具体数据列于表1中.由于AOT头基具有较强的亲水性以及头基附近羧基的存在使得芘分子向胶束内部转移,同时,使其所处微环境的极性变小,I1/I3值变小,导致体系疏溶剂作用减弱,从而延缓了胶束的形成.但是当溶剂中PEG 200质量分数在60 wt%以上时,I1/I3值相对较高且胶束形成前后变化不大,说明芘分子在混合溶剂中所处微环境的极性较高,侧面反映了表面活性剂在PEG 200含量较高的体系中聚集数相对较小的事实.此外,PEG 200与水相比有较弱的极性,但PEG 200含量较高时I1/I3值相对较高,这可能与芘在PEG 200与水混合溶剂中的溶解度相对较大有关,使得用荧光法测定聚集数比较困难.为此,我们还需要采用动态光散射等方法进一步研究胶束的松散结构[7].
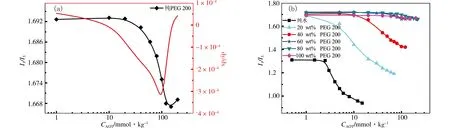
图3 298.15 K、101.325 kPa下,AOT在纯PEG 200中 (a) 和在不同质量分数的PEG 200/水溶液中 (b) 的荧光曲线
2.3 电导法研究混合体系聚集行为
对于离子型表面活性剂,在溶液中可电离成活性离子和反离子,当表面活性剂浓度超过某一临界值时,烷烃链受疏水相互作用的影响,能自发聚集成胶束,因此电导率曲线上会出现明显的转折,转折点处对应AOT的浓度即为临界胶束浓度,这是测定cmc值的常用方法[16].图5中左图为AOT-H2O体系的电导率曲线,曲线上没有出现转折点[7],推测是因为体系没有发生胶束化或反离子完全解离.图4为298.15 K下,AOT在20 wt%PEG 200水溶液中的电导率曲线,浓度较大时电导率曲线上有一个转折点[17];浓度较小时曲线上有两个转折点,对图4中(a)、(b)两条曲线分别做一次微分,由微分曲线与电导率曲线的交点可求得cmc值.推测两个转折点分别对应不同的聚集状态,第一个转折点对应球状胶束的形成,第二个转折点可能对应在有机溶剂中球状到棒状胶束的转化[18,19].为了更好的观察PEG 200含量对体系电导率的影响,我们做了AOT在不同含量的PEG 200水溶液中的电导率曲线,如图5中右图所示,具体数据列于表1中.发现混合溶剂中PEG 200质量分数为40 wt%时,体系电导率曲线上也出现了双拐点,原因与20 wt%PEG 200体系相似.随着PEG 200含量的增加,电导率逐渐减小,推测是由于PEG 200与水相比有更弱的离子化效应和导电能力.临界胶束浓度值随PEG 200含量增加而增大,可通过混合溶剂极性降低和“结构破坏效应”来解释.由于相分离模型过于简单,且文献中使用较少.因此使用质量作用模型计算胶束化过程的热力学参数,公式
(1)
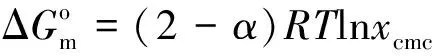
(2)
(3)
α为胶束的反离子解离度;S1、S2、S3分别为电导率曲线上第一个转折点前后、第二个转折点后所做直线的斜率;xcmc为临界胶束浓度时表面活性剂所占的摩尔分数;分别为标准吉布斯自由能、熵变、焓变,具体数值列于表1中.

图4 298.15 K下,AOT在20 wt%PEG 200/水溶液中的电导率曲线
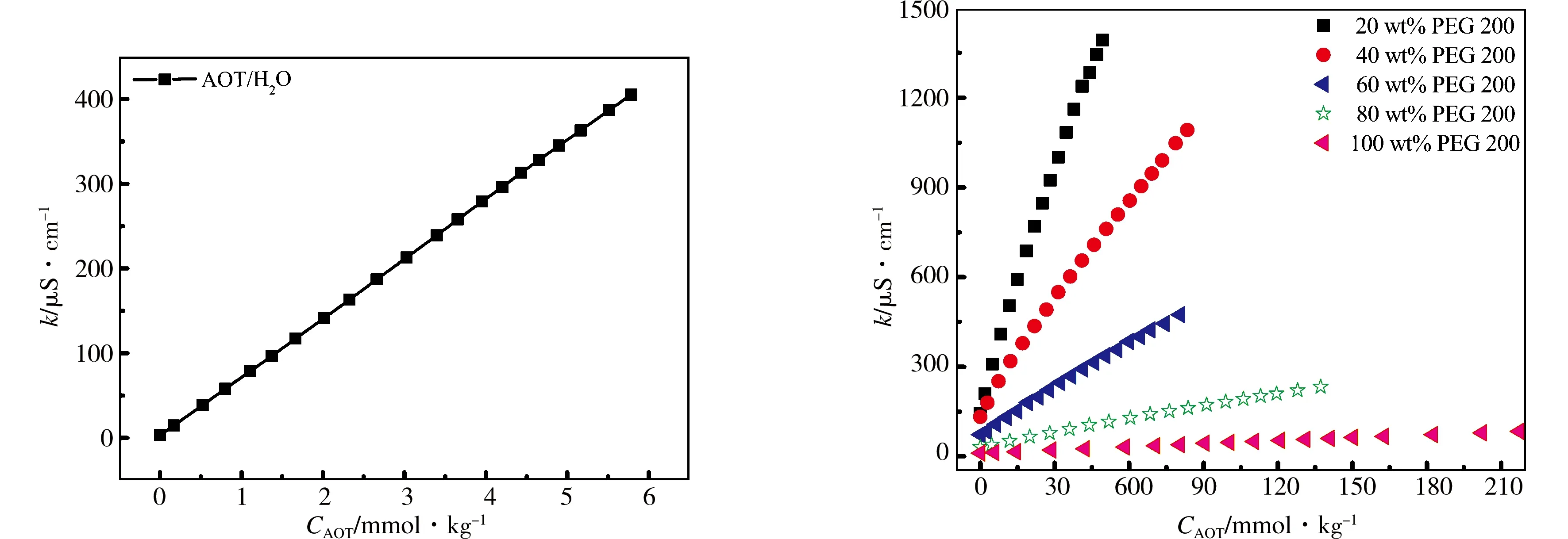
图5 298.15 K下,AOT在纯水中 (左) 和在不同质量分数的PEG 200/水溶液中 (右) 的电导率曲线
由数据可知:随着混合溶剂中PEG 200质量分数的增加,α值呈现“U”型变化.α值主要受两个因素影响:(1) PEG 200参与胶束溶剂化层.由于PEG 200与表面活性剂间可形成氢键,可以减少AOT头基间静电排斥作用,增强了胶束对反离子的吸引力,使得α值减小.(2) 混合溶剂性质的改变.由于混合溶剂极性降低,胶束表面聚集数和电荷密度降低,使得α值增大.在纯水中,由于胶束结构较松散以及AOT与水之间的氢键作用,使得胶束不吸引反离子.向体系中加入少量的PEG 200,即PEG 200质量分数低于60 wt%时,前者因素占主导,使得α值降低;PEG 200质量分数≥60 wt%时,α值略有增大,主要受后者因素的影响.
2.4 微量热法研究混合体系聚集行为
等温滴定微量热法 (ITC) 是研究胶束化过程中热力学变化的一种较直接、灵敏的方法.当体系中未加入PEG 200时,滴定热谱图呈“S”型,如图6(a)所示,可知胶束在水中的解离是放热的.两平台数值之差即为对焓变曲线做一次微分,微分曲线上最高点对应浓度为cmc值[20,21],具体数据列于表1中.图6(b)为AOT在不同质量分数的PEG 200/水溶液中的表观焓随浓度的变化曲线,当混合溶剂中PEG 200质量分数高于80 wt%时,滴定曲线与AOT-水体系有相似的形状,这是由于溶液中自由水部分消失[6],但不影响胶束的形成,此时胶束的完全解离并不意味着PEG 200的完全水合.据推测,AOT疏水链周围聚合物分子的有序排列与“冰山结构”类似,结构的破坏不仅可以解释AOT胶束解离的放热效应,还能解释其它体系胶束形成的驱动力.
一般来说,cmc是胶束形成难易程度的度量,其值越大,越不利于胶束的形成.由表1中数据可以看出:(1) 随着混合溶剂中PEG 200质量分数的增加,cmc值增大,主要是由于混合溶剂极性降低,胶束表面聚集数和电荷密度降低,不利于胶束的形成;同时PEG 200含量较高时对表面活性剂单体有良好的溶解性,降低了表面活性剂对反离子的吸引,导致胶束结构松散.(2) 从胶束形成的热力学参数来看,发现与AOT-水体系相比,当混合溶剂中PEG 200质量分数≥60 wt%时,胶束的反离子解离度增大,体系值变的更正.当混合溶剂中PEG 200质量分数<60 wt%时,由于体系中胶束的反离子解离度降低,使得体系中值变的更负,但是cmc值和的变化趋势存在一定的矛盾,原因可能是质量作用模型不太适合我们研究的这类体系,针对这个问题我们将进一步进行研究.(3) 对于AOT-水体系和AOT-PEG 200-水 (含量≥ 80 wt%) 体系,胶束形成过程为吸热过程,主要为熵驱动 (值为正,-T值为负),其它体系是熵焓共驱 (值为负,-T值为负).

图6 298.15 K下,AOT在纯水中 (a) 和在相应含量的PEG 200/水溶液中 (b) 的表观焓变值(ΔHobs)随表面活性剂浓度的变化曲线
PEG200/wt%电导率表面张力荧光微量热cmc/第二cmc/cmc/第二cmc/cmc/cmc/mmol·kg-1mmol·kg-1mmol·kg-1mmol·kg-1mmol·kg-1mmol·kg-1α1α2㹦Gom/kJ·mol-1㹦Hom/kJ·mol-1-T㹦Som/kJ·mol-103.01-2.97-3.102.341.0--24.352.67-27.02205.9823.167.0144.795.055.200.800.64-27.18-8.63-18.55407.3033.2215.0345.5319.885.590.800.47-26.59-12.20-14.396046.75-35.13-59.7040.390.83--20.54-3.48-17.068067.69-75.48-80.6245.840.85--19.204.05-23.25100132.50-97.09-96.62116.50.90--16.530.57-17.10
3 结论
本文研究了表面活性剂AOT在不同质量分数的PEG 200/水混合溶液中的聚集行为,采用表面张力 (ST)、稳态荧光法、电导率以及微量热 (ITC) 等方法测定了cmc值和一系列热力学函数的值.结果表明:PEG 200与水作为混合溶剂时,可以形成传统的表面活性剂聚集体.发现随着混合溶剂中PEG 200质量分数的增加,体系cmc值逐渐增大,胶束聚集结构变得松散,不利于胶束的形成.另外,几种实验方法测得第一临界胶束浓度的数据相吻合,但表面张力法和电导率法测出了体系第二临界胶束浓度.根据质量作用模型,从热力学角度来看,适度添加PEG 200可以调节焓-熵补偿效应;向水中大量添加PEG 200时,胶束形成的驱动力逐渐由熵焓共驱转为熵驱动.通过本文的研究,扩展了传统表面活性剂在非水溶剂中的聚集行为,拟拓展该类体系在合成化学、药物化学及日用化学等方向的应用,希望可以为这类应用提供一定的理论支持.
