rhES结合3D-CRT治疗对食管癌患者症状改善、血清sMICA及组织相关蛋白表达的影响*
2020-11-26杨学为苏欣宇
余 磊,杨学为,苏欣宇
(1.泰州市人民医院肿瘤科,江苏泰州 225300;2.泰州市人民医院妇科,江苏泰州 225300;3.淮安市第二人民医院放疗科,江苏淮安 223002)
食管癌是全球十大高发的恶性肿瘤之一。我国是食管癌高发地区,因食管癌死亡人数占全球死亡人数的50%以上[1]。传统的放射治疗受肿瘤周围正常组织的限制,病灶放射剂量不足,局部控制率低,患者的耐受性差,治疗后食管癌患者的近5年生存率不足20%[2]。三维适形放射(3D-CRT)利用CT数据重建肿瘤结构,对病灶处精准放射,并通过调节不同靶区的放射剂量,减少对周围正常组织的损伤,可有效地控制局部复发率,但对已经发生远处转移的病灶治疗效果不明显。重组人血管内皮抑制素(rhES)是我国自主研发、拥有独立知识产权的抗肿瘤药物,能抑制肿瘤血管内皮细胞的增殖,阻断营养物质的传输,诱导细胞的凋亡,从而抑制肿瘤细胞的生长与迁移。近年来,有研究表明rhES联合化疗治疗食管癌效果较好[3]。细胞间质上皮转换因子(c-met)作为原癌基因可促进新生血管生成,促进肿瘤生长、迁移、进展,有Meta分析表明c-met过表达可作为预测食管癌发生的独立危险因素[4]。Stathmin是位于细胞质的微管解聚蛋白,参与微管、纺锤体形成和组装,与细胞分裂增殖、运动功能等密切相关,组织相容性复合体Ⅰ类链相关蛋白A(sMICA)可与Ⅰ类链相关蛋白A(MICA)结合从而减弱其抗肿瘤作用,造成肿瘤免疫逃逸,既往研究表明Stathmin、MICA水平与食管癌TNM分期相关[5]。为进一步探究rhES联合3D-CRT治疗食管癌患者对Stathmin、c-met、sMICA表达,以及对患者症状改善、生存曲线的影响,本研究选取112例患者进行前瞻性研究,旨在为临床诊断治疗食管癌和开发新药提供参考。
1 资料与方法
1.1一般资料 选择2013年7月至2014年8月泰州市人民医院收治的食管癌患者112例为研究对象,纳入标准:(1)综合食管影像、临床症状及病理学检查确诊为食管癌患者;(2)未发生远处转移者;(3)卡氏功能状态评分标准(KPS)评分不低于60分者;(4)预计生存时间不低于6个月者;(5)所有患者均知晓本研究所涉及治疗可能存在的风险,并签署知情同意书。排除标准:(1)合并其他肿瘤者;(2)有放疗禁忌证者;(3)中途退出研究的患者,随访过程中失访者。采用随机数字表法将所有研究对象分为对照组和研究组,每组56例。对照组中男29例,女27例;年龄30~74岁,平均(44.31±2.67)岁;体质量指数(BMI)为(21.21±2.81)kg/m2;鳞癌46例,腺癌10例;Ⅱ期8例,Ⅲ期34例,Ⅳ期14例。研究组中男27例,女29例;年龄30~72岁,平均(43.54±5.12)岁;BMI为(21.65±2.41)kg/m2;鳞癌48例,腺癌8例;Ⅱ期9例,Ⅲ期32例,Ⅳ期15例。两组患者的年龄、性别比例、BMI、病理类型、临床分期等临床资料比较,差异无统计学意义(P>0.05)。本研究取得泰州市人民医院医学伦理委员会的批准后进行。
1.2方法 对照组采取单独3D-CRT治疗方案。操作步骤:(1)CT扫描,采用螺旋CT(厂家为荷兰Philips 公司,型号为Brilliance 64排128层螺旋CT)对病变部位进行扫描,控制每层扫描厚度约5 mm,将扫描数据传输至治疗计划系统;(2)勾画靶区,由至少2名临床经验丰富的医生综合CT扫描数据、食管镜像资料勾画肿瘤靶区(GTV)、临床靶区(CTV)及计划靶区(PTV)。其中,GTV为肿瘤的原发病灶与转移病灶的总和,GTV上下外扩0~2.0 cm,前后左右外扩0~0.5 cm得到CTV,CTV再向四周扩大0~0.5 cm即为PTV;(3)放射治疗,依照PTV计算放射剂量,控制放射剂量为每次2.0 Gy,1 d 1次,每周5次,照射周期为6周。周边器官剂量控制为双肺V20≤30%,脊髓剂量最高45 Gy,心脏V40≤40%。
研究组采取rhES联合3D-CRT治疗方案。在3D-CRT治疗开始当天静脉滴注rhES(规格:15 mg×3 mL,国药准字S20050088,山东先声麦得津生物制药有限公司),具体步骤:将15 mg rhES加入500 mL生理盐水中,调节静脉滴注速度,控制每次滴注时间约为4 h,1 d 1次,连续给药2周,停药1周,之后再继续重复给药,3周/疗程,治疗2个疗程。
1.3观察指标
1.3.1临床疗效 病灶消失,且病灶维持4周不复发,定义为完全缓解(CR);病灶缩小≥50%,且病灶维持4周不变大,定义为部分缓解(PR);病灶缩小<50%,病灶增大>5%,维持4周,定义为稳定(SD);病灶增大<25%或有新病灶出现,定义为进展(PD)。病情缓解率=(CR例数+PR例数)/总病例数×100%。
1.3.2生存质量 治疗前后利用KPS评分标准从角色、躯体、情绪、社会、认知功能及总体症状6个方面评估患者的生存质量。评分采用百分制,0分代表死亡,100分代表正常,分值越高,生存质量越高。
1.3.3Stathmin、c-met、sMICA、血管内皮生长因子(VEGF)表达 收集两组患者治疗前后癌组织标本,放置于4%的多聚甲醛溶液中,包埋于石蜡,采用免疫组织化学法分别检测组织中的Stathmin、c-met、VEGF表达。同时,检测健康人群正常组织中Stathmin、c-met、VEGF蛋白表达水平,分别以健康人群平均水平为临界值,判断两组患者组织中Stathmin、c-met、VEGF蛋白表达阳性率,即检测水平大于临界值即为阳性。治疗前后,抽取患者空腹状态下的外周静脉血5 mL,2 500 r/min离心10~15 min,取上清液,以酶联免疫吸附试验(ELISA)法检测血清中sMICA水平。
1.3.4随访 采用电话、网络、门诊复诊等方式对所有患者每月进行随访,共随访60个月。用CT扫描病变部位及其周围相邻器官,观察病灶的转移和复发情况,计算治疗后1、3、5年病灶转移率和局部复发率,记录每月死亡患者数,计算1、3、5年总体生存率,绘制生存曲线。
1.3.5不良反应发生率 观察治疗期间患者恶心呕吐、放射性食管炎、白细胞下降、骨髓抑制等不良反应的发生情况,计算两组不良反应发生率。

2 结 果
2.1两组患者临床疗效比较 经过治疗,研究组的病情缓解率高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组患者临床疗效比较[n(%)]
2.2治疗后两组患者生存率比较 治疗后,研究组1、3年生存率(89.29%、75.00%)与对照组(80.36%、58.93%)比较,差异无统计学意义(χ2=3.269、1.734,P>0.05),研究组5年生存率(55.36%)明显高于对照组(35.71%),差异有统计学意义(χ2=5.467,P=0.019)。见图1。

图1 两组患者生存率比较
2.3治疗前后生存质量评分比较 治疗前,两组五大功能评分及总体症状评分比较,差异均无统计学意义(P>0.05)。治疗后,两组五大功能评分均明显升高,总体症状评分均明显降低,差异有统计学意义(P<0.05),且研究组五大功能评分均明显高于对照组,总体症状评分明显低于对照组,差异有统计学意义(P<0.05)。见表2~4。

表2 两组治疗前后社会功能、躯体功能比较分)

表3 两组治疗前后角色功能、情绪功能比较分)

表4 两组治疗前后认知功能、总体症状比较分)
2.4治疗前后两组Stathmin、c-met、sMICA、VEGF表达情况比较 治疗前,研究组和对照组患者组织中Stathmin、c-met、VEGF蛋白及血清中sMICA表达水平比较,差异无统计学意义(P>0.05)。检测健康人正常组织中Stathmin、c-met、VEGF蛋白表达平均水平分别为2.40、3.55、1.20 μg/L,分别以此为临界值,判断两组患者Stathmin、c-met、VEGF蛋白表达阳性率,即检测水平大于临界值即为阳性。治疗后研究组中的Stathmin、c-met、VEGF表达水平及阳性率明显低于对照组,差异有统计学意义(P<0.05)。治疗后研究组血清sMICA明显低于对照组,差异有统计学意义(P<0.05)。见表5、6。
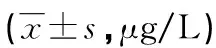
表5 两组患者治疗前后Stathmin、c-met、sMICA、VEGF表达水平比较
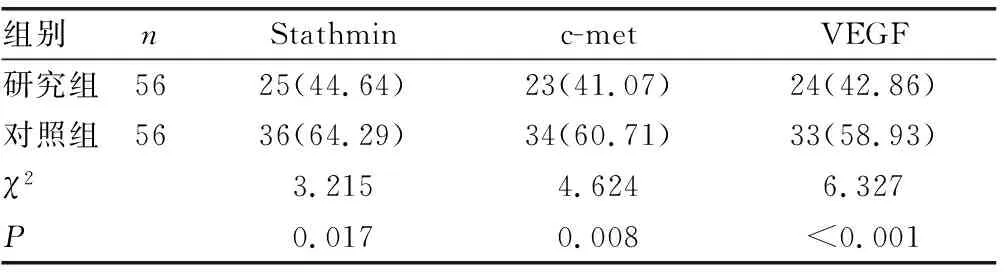
表6 两组治疗后组织中相关蛋白表达阳性情况比较[n(%)]
2.5两组病灶远处转移及局部复发情况比较 治疗后,研究组和对照组的1、3年的病灶远处转移率、局部复发率比较,差异无统计学意义(P>0.05);研究组的5年病灶远处转移率、局部复发率均低于对照组,差异有统计学意义(P<0.05)。见表7。

表7 两组远处病灶转移及局部复发情况比较[n(%)]
2.6两组不良反应发生率比较 治疗期间,两组患者的不良反应发生率比较,差异无统计学意义(P>0.05)。见表8。
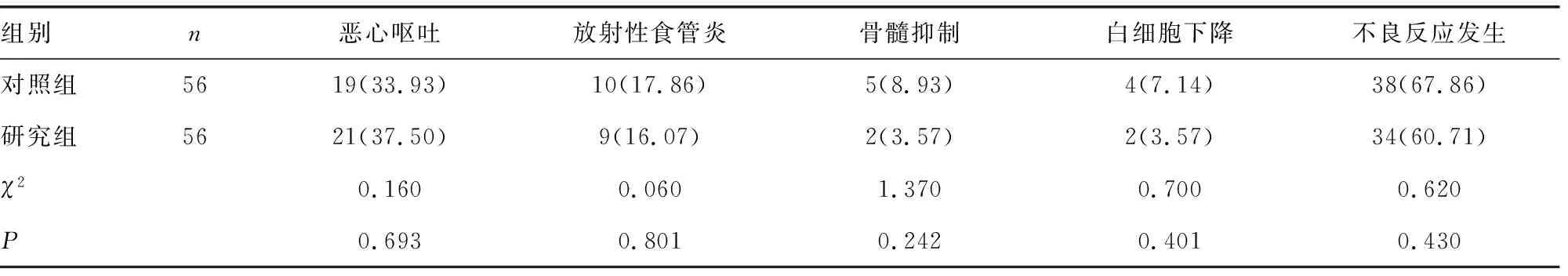
表8 两组治疗期间不良反应发生情况比较[n(%)]
2.7两组中典型食管癌患者检查结果图片 采用食管影像、临床症状及病理学检查等手段对食管癌患者最终进行确诊,确诊的典型病例图片见图1。
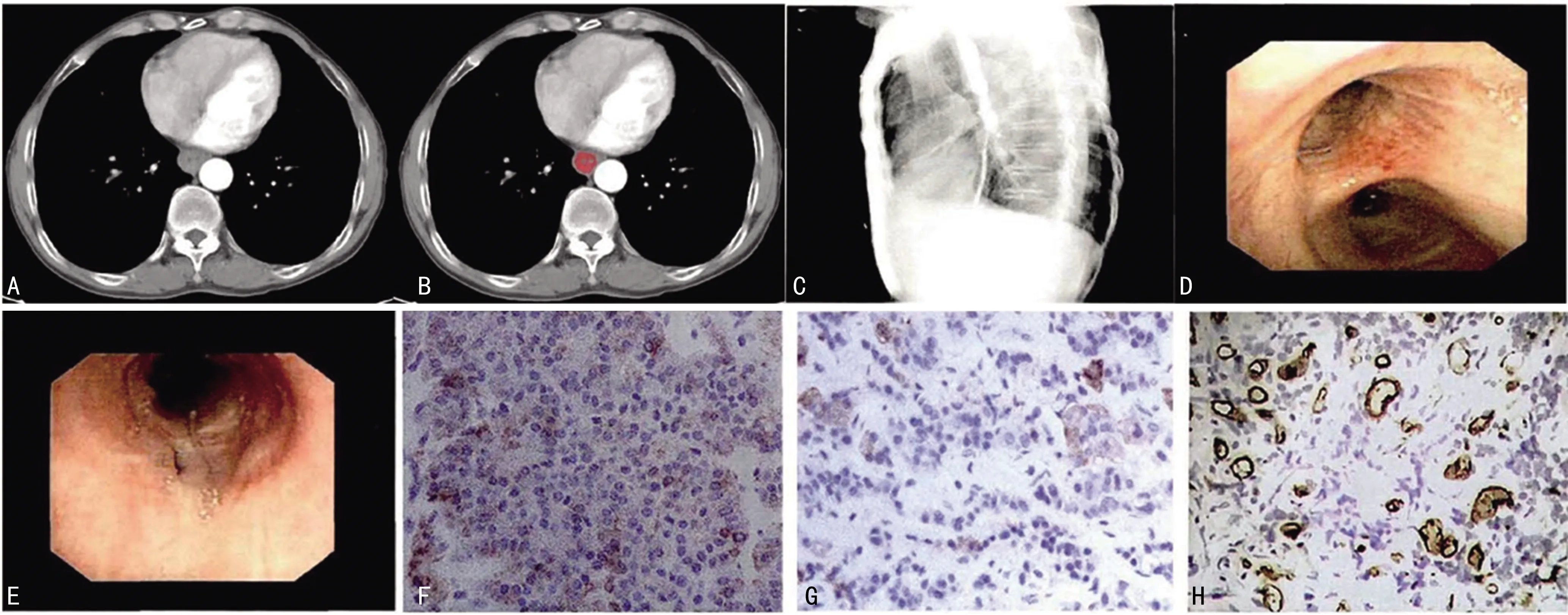
注:A为食管癌患者下段CT增强图像;B为食管癌患者病灶分割;C为消化道造影;D为胃镜检查结果;E为气管镜检查结果(→所指为瘘口);F为Stathmin 在组织中的表达(×200);G为c-met 在组织中的表达(×200);H为VEGF在组织中的表达(×200)。图1 典型食管癌患者检查图片结果
3 讨 论
食管癌是一种全球高发的恶性肿瘤。近年来,食管癌的发病率及病死率呈逐年递增的趋势。手术及放化疗等传统的食管癌治疗方法因局部控制率差、肿瘤易复发、患者痛苦等缺陷,限制了其临床广泛应用。3D-CRT通过三维模拟肿瘤结构,加大靶区的放射剂量,减少周围正常组织的放射剂量,提高肿瘤的局部控制率,减轻周围器官的损伤。但受影像技术、照射区域及患者耐受性等因素的影响,3D-CRT对远处转移的病灶治疗效果不佳。1971年,FOLKMAN首次提出肿瘤的增殖、转移与新生血管的形成存在密切的联系,由此,开启了全球对抗新生血管形成药物治疗肿瘤的研究。目前,全球已开发出数百种抗血管生成药物,例如,贝伐珠单体、雷莫芦单抗、尼达尼布等。rhES是我国自主研发的一种光谱抗血管形成药物,对多种肿瘤均有疗效。rhES能抑制血管内皮细胞的增殖,阻隔内皮细胞内信号传输,切断肿瘤细胞营养物质供给,下调促新血管生成因子基因,改变肿瘤内微环境,诱导肿瘤细胞凋亡,最终抑制肿瘤细胞的生长、转移与增殖。
李晓宁[6]的研究发现,3D-CRT联合化疗治疗食管癌的有效率高于单用3D-CRT治疗。表明单用放疗可能不能完全杀死肿瘤细胞,放疗结束后肿瘤细胞重新修复增殖,为进一步提高放疗的效果,本研究通过联合rhES与3D-CRT治疗食管癌,结果显示研究组的病情缓解率明显高于对照组,差异有统计学意义(P<0.05)。治疗后,两组患者的KPS五大功能评分均升高,总体症状评分均降低,差异有统计学意义(P<0.05),且研究组五大功能评分高于对照组、总体症状评分低于对照组,差异有统计学意义(P<0.05)。研究组5年生存率明显高于对照组,5年病灶远处转移率和局部复发率低于对照组,差异有统计学意义(P<0.05)。可见,rhES联合3D-CRT能有效抑制肿瘤细胞的生长、转移,改善患者的生存质量。郝延璋等[7]用rhES联合新辅助放化疗和手术治疗局部晚期直肠癌患者,2年局部复发率为7.5%,明显低于未用新辅助放化疗和手术治疗的对照组(25.0%),且亚组分析结果表明联合治疗在VEGF高表达的患者中疗效更明显。有Meta分析发现,rhES联合化疗治疗晚期胃癌比单用化疗效果好[8],在另一项Meta分析中发现,在中晚期原发性肝癌治疗中,rhES联合TACE治疗的近期疗效优于单用TACE[9]。一项用Walker-256癌性腹水注射法建立荷瘤Wistar大鼠模型的动物实验发现,联用32P胶体与rhES治疗比单用32P胶体或rhES抑制肿瘤生长效果更好[10]。以上研究中,rhES与其他疗法联合治疗各种类型肿瘤均可取得较好疗效,产生该现象的原因可能在于,一方面,rhES能抑制新血管的形成,调控内皮细胞蛋白的表达,抑制肿瘤细胞扩散;另一方面,rhES能重塑肿瘤微环境,诱导肿瘤细胞正常化,缓解肿瘤细胞缺氧状况,提高肿瘤细胞的放射敏感性,可与3D-CRT协同作用于病灶。
VEGF能促进血管内皮细胞的增殖,增加血管的通透性,加快肿瘤细胞的营养供给,加速肿瘤细胞的生长、增殖与转移,高水平的血管生成与食管癌预后不良和高侵袭性表型有关,可能与趋化因子受体7通过激活NF-κB信号通路上调VEGF-A、VEGF-C等表达有关。另有一项动物实验用Stattic联合放疗治疗食管癌ECA109细胞建立的裸鼠移植瘤模型,Western blot结果显示,其VEGF蛋白水平比单用放疗治疗明显降低,提示Stattic作用机制可能与抑制VEFG蛋白表达有关[11]。sMICA是一种癌细胞凋亡过程中细胞表面MICA脱落形成的蛋白质分子,与肿瘤细胞的进展、恶化紧密关联。sMICA能降低NKG2D的表达,抑制机体免疫细胞NK细胞及T细胞对肿瘤细胞的杀伤作用,促使肿瘤免疫逃逸[12]。一项Meta分析发现,MICA/B的表达与消化系统肿瘤生存率显著相关,但与呼吸系统和女性生殖系统恶性肿瘤的相关性不明确,MICA/B和sMICA/B可作为评估癌症患者治疗效果的指标[13]。微管属于细胞骨架的重要组成部分,参与细胞内信号传递、细胞分裂、细胞运动、物质运输等,微管处于动态变化状态以维持细胞正常功能活动,Stathmin作为一种微管解聚蛋白,能作用于细胞的有丝分裂过程,改变细胞周期,调控微管系统的动态平衡,促进癌细胞的发展、侵袭及转移。有研究表明,Stathmin高表达是食管鳞状细胞癌患者生存率低的独立危险因素,并与采用多西紫杉醇进行新辅助化疗的不良反应有一定相关性,其表达下调可增强食管鳞状细胞癌对紫杉醇和放射治疗的敏感性,可能与Stathmin抑制多西紫杉醇稳定微丝微管的作用有关[14-16]。c-met是一种酪氨酸激酶受体,其表达水平受原癌基因c-met的调控。c-met主要作用于上皮细胞,c-met信号通路能诱导细胞扩散,促进血管生成,加速细胞的侵袭及转移,与多种恶性肿瘤的生长、转移及耐药性有关[17]。有研究表明,干扰素刺激基因15(ISG15)在食管鳞状细胞癌中表达水平上调,并发现ISG15可影响c-met基因的表达,可能是通过c-met/Fyn/β-catenin基因途径促进肿瘤生长[18]。
绝大多数肿瘤患者VEGF、sMICA、Stathmin、c-met均呈现异常高表达水平,这些因子均可能成为恶性肿瘤细胞治疗中的关键靶点。本研究发现,治疗前,研究组和对照组的Stathmin、c-met、VEGF表达水平比较,差异无统计学意义(P>0.05)。治疗后研究组组织中的Stathmin、c-met、VEGF表达水平及阳性率明显低于对照组,差异有统计学意义(P<0.05)。可见,rhES联合3D-CRT能有效降低食管癌患者VEGF、sMICA、Stathmin、c-met的表达,抑制肿瘤细胞的发展。此外,治疗期间两组患者的不良反应发生率差异无统计学意义(P>0.05),安全性好。梁晶等[19]的研究表明,肺癌患者的sMICA和VEGF、基质金属蛋白酶-7mRNA(MMP-7mRNA)共同参与构成肺癌病灶转移微环境,经手术或化疗治疗后患者血清MMP-7mRNA、sMICA和VEGF水平均有所降低,与本研究结果一致,可能原因为VEGF、sMICA合成增多可供给肿瘤生长所需的新生血管和深部所需营养物质,并影响MMPs水平加快内皮迁移和基底膜溶解,本研究中VEGF、sMICA水平降低可能提示食管癌细胞迁移能力和生长速度得到有效控制。LI等[20]研究中通过构建Cox比例风险模型发现,生长因子颗粒素蛋白前体(PGRN)水平高的食管癌患者5年病死率是低水平PGRN患者的2倍,可能通过激活VEGF-C并在淋巴管生成中发挥一定作用,高水平的PGRN与淋巴结转移、淋巴微血管密度增高、淋巴管间隙侵犯有关,PGRN诱导血管、淋巴管生成,上调VEGF水平,促进食管癌的发生、发展。rhES作为抗血管内皮因子与放疗联合,可能通过降低PGRN和VEGF水平,减少肿瘤组织血管和淋巴管的生成,进而抑制肿瘤生长。Stathmin可能参与stat介导的中心体聚集,在乳腺癌相关的研究中表明,Stathmin敲除后可抑制上皮细胞增殖,导致上皮细胞有丝分裂时纺锤体定向紊乱,阻止子细胞正确定向、极性丧失和增殖失控,导致正常乳腺结构严重紊乱和肿瘤发生过程延迟,可作为药物治疗的靶点[21],met基因扩增或c-met高表达与放疗后总体生存率、CR率较低,局部控制率较差,无病生存期短相关[22],本研究中rhES和3D-CRT治疗后血清c-met和Stathmin水平的降低提示在联合治疗的作用下紊乱的肿瘤区域微环境恢复正常或趋于正常。
4 结 论
rhES联合3D-CRT治疗食管癌患者能有效地降低食管癌患者血清中VEGF、sMICA、Stathmin、c-met的表达,抑制肿瘤细胞的生长、转移,改善患者的生存质量,且并发症少,安全性高,有望在临床上推广。
