冻结肩病理改变及过氧化物酶体增殖剂激活受体-γ激动剂治疗作用的研究*
2020-11-25陈锦富朱天飞常崇斐耿倚云熊建义王大平王满宜朱伟民
陈锦富 朱天飞 常崇斐 耿倚云 熊建义 王大平** 王满宜 朱伟民**
(1.深圳大学第一附属医院(深圳市第二人民医院)运动医学科,广东深圳 518035;2.广东省运动医学工程研究中心,广东深圳 518035)
冻结肩是肩关节的一种进行性疾病,以疼痛和活动范围受限为特征。其中最显著的临床特征是肩关节在各个方向的主动和被动运动受限[1-3]。引起这些临床症状的主要原因是肩关节囊的纤维化改变及炎症反应,但目前对其病理改变的研究较少,也没有一种统一有效的治疗方案。为了解冻结肩的临床症状,有必要对其病理改变进行进一步研究。
转化生长因子-β(transforming growth factor-β,TGF-β)是一种多功能细胞因子,已被证明导致纤维化,可以促进细胞外基质的形成[4-7]。成纤维细胞合成的细胞外基质蛋白特异性表面膜受体[8-10]的高表达可引起肩关节挛缩、粘连,是冻结肩的主要发病机制。有研究发现在原发性及继发性冻结肩患者的肩关节囊中TGF-β 及其受体的表达增加,表明TGF-β也可引起关节囊纤维化,并且可能在冻结肩的起源和发展中有重要作用[11]。基于这些研究发现,我们向SD 大鼠的肩关节腔注射TGF-β1 过表达的腺病毒成功构建大鼠冻结肩模型,并可用于冻结肩的动物实验研究。除此之外,冻结肩往往存在炎症反应,已有研究报道,炎症介质在冻结肩的炎症和胶原分解代谢过程中发挥重要作用[12-14]。近年来的研究表明,关节囊炎性细胞因子的过度表达在冻结肩的发病过程中起着重要作用[15-17]。研究表明,PPAR-γ 激动剂可抑制TGF-β1所引起的细胞外基质表达上调(包括Ⅰ型胶原形成),从而发挥其抗纤维化作用。还有研究表明,PPAR-γ 激动剂对预防包括皮肤、肾脏和角膜在内的各种器官纤维化有效[18-20]。本研究将会使用罗格列酮作为治疗大鼠冻结肩模型药物,这是一种高度活跃的PPAR-γ激动剂,常被用作治疗糖尿病的胰岛素增敏剂。近年来发现罗格列酮在炎症反应、免疫调节和纤维化抑制中发挥重要作用[20,21]。因为目前没有罗格列酮的实验试剂,所以,本研究采用另一种PPAR-γ激动剂——CDDO-IM 进行细胞实验。本研究目的是探究PPAR-γ 激动剂的抗纤维化和抗炎作用,以及罗格列酮在大鼠冻结肩模型中的治疗效果,为临床治疗冻结肩提供新思路。
1 材料与方法
1.1 实验材料
实验细胞:人皮肤成纤维细胞(human skin fibroblasts,HSF)
实验动物:SD(Sprague Dawley)大鼠18 只,20 月龄,体重约450 g,由广东省医学实验动物中心提供。实验内容、方法及小动物福利等均已获得深圳市第二人民医院医学伦理委员会审核批准。
实验试剂:DMEM 培养基、胎牛血清(fetal bovine serum,FBS)均购自美国Invitrogen公司,TGF-β1过表达的腺病毒(滴度为1×1011PFU/ml)购自上海汉恒生物有限公司。
1.2 实验方法
1.2.1 水溶性甲臢化合物(MTS)法检测细胞增殖:消化细胞后吹打散细胞,计数,调整细胞浓度为1×105个/ml,分到96孔板,每孔100 μl,即每孔细胞为1×104个。待细胞贴壁后,收集各个时间点的细胞(0 h、24 h、48 h、72 h)加入cellTiter96AQ单溶液细胞增殖检测试剂(Promega,Cat.No.G3582),比例为1/10。即100 μl 培养液加入10 μl 检测液。在孵育4 h 后,酶标仪读板,MTS检测读取OD490数据。
1.2.2 细胞迁移实验(划痕检测):先用记号笔在6孔板背后,用直尺比着,均匀得划横线,大约每隔0.5~1.0 cm一道,横穿过孔。每孔至少穿过3条线。于超净工作台内无菌操作下在6 孔板中的每孔加入浓度为10 μg/ml 的纤维连接蛋白(fibronectin,FN)50 μl,置于4℃冰箱过夜,次日加含10%FBS 的RPMI-1640 培养液于紫外线下灭菌2 h备用。将处于对数生长期的浓度约为1×106/ml细胞,制成悬液均匀接种于6孔培养板中,置于37℃5%CO2培养箱中常规培养。倒置显微镜下观察细胞长成单层后予以换液,用丝裂霉素处理1 h,抑制细胞的分裂。用10 μl无菌微量移液枪头在细胞板上划痕,用枪头比着直尺,尽量垂直于背后的横线划痕,保持枪头垂直。PBS液冲洗2~3次以去除被刮下的细胞,加入无血清培养基。对照组用无血清RPMI-1640 培养基培养,实验组分别用含药的无血清RPMI-1640培养基进行干预。置入37℃5%CO2培养箱中继续培养,分别于划痕后0、6、12、24 h取样,拍照。在倒置显微镜下观察划痕愈合情况。Image Pro-Plus 6.0 软件测量各组细胞相同时间点任意8 个部位划痕宽度,计算细胞迁移率=(0 h-其他时间点)/0 h,以反映各组HSF运动迁移能力,数据统计。
1.2.3 大鼠冻结肩模型的制备:动物实验分为正常组、TGF-β1诱导模型组(肩关节腔注射Ad-TGF-β1)、罗格列酮治疗组(肩关节腔注射Ad-TGF-β1 后使用罗格列酮灌胃治疗),每组6 只。取20 月龄的SD 大鼠12 只制备冻结肩模型。大鼠先腹腔注射水合氯醛(400 mg/kg)进行麻醉,肩关节剃毛,标记进针点,消毒。无菌条件下,用1 ml注射器抽取TGF-β1过表达的腺病毒(滴度为1×1011PFU/ml)30 μl,稀释至100 μl,在进针点上向肩关节腔注射。注射病毒后继续饲养2周,其中一半大鼠用罗格列酮(2 mg/kg/d)灌胃饲养2周,作为罗格列酮治疗组。
1.2.4 组织学观察:动物模型制备完成后处死动物,取肩关节囊组织,4%多聚甲醛固定,流水冲洗过夜,去除多余的固定液,再进行脱水、浸蜡,常规方法包埋后,切片厚度7 μm并转移到45°C水浴锅中。用载玻片捞起切片,37°C 过夜烤干。组织切片标本制作完成后进行HE染色及免疫组织化学检测,观察大鼠肩关节囊组织的变化。
1.3 统计学方法
所有实验至少重复3 次。采用SPSS 17.0 软件对实验数据进行统计分析,数据以均数±标准差表示。不同组间对比用one-way ANOVA。以P<0.05为差异有统计学意义。
2 结果
2.1 PPAR-γ激动剂抑制TGF-β1 诱导的HSF增殖
利用cellTiter96AQ 单溶液细胞增殖检测试剂(Promega,Cat.No.G3582)检测HSF 组、TGF-β1 组(加入TGF-β1共培养)、CDDO-IM 组(加入CDDO-IM 共培养),TGF-β1+CDDO-IM 组(加入10 ng/ml TGF-β1和20 nmol/L CDDO-IM 共培养)不同时间点的细胞(0 h、24 h、48 h、72 h)增殖情况。培养至72 h,TGF-β 1组的增殖率为83.6%,TGF-β1+CDDO-IM组增殖率为19.3%,差异有统计学意义(P<0.01),可见TGF-β促进HSF的增殖;CDDO-IM(PPAR-γ激动剂)能够抑制TGF-β1的促增殖作用(图1)。
2.2 PPAR-γ激动剂抑制TGF-β1 诱导的HSF迁移
利用划痕实验检测各组不同时间点的细胞(0 h、6 h、12 h、24 h)增殖情况,计算各组细胞迁移率并进行比较。在24 h,TGF-β1组的迁移率为84.9%,TGFβ1+CDDO-IM组迁移率为44.1%,差异有统计学意义(P<0.05)。结果显示TGF-β1 促进HSF 的迁移;CDDO-IM抑制TGF-β1对HSF迁移的促进作用(图2)。
2.3 PPAR-γ 激动剂抑制TGF-β1 诱导的HSF 异常纤维化
利用实时荧光定量qRT-PCR 及蛋白质印迹Western blot 检测细胞外基质波形蛋白、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、Ⅰ型胶原蛋白、Ⅲ型胶原蛋白的表达情况。qRT-PCR 结果显示TGF-β1 促进HSFⅠ型胶原蛋白、Ⅲ型胶原蛋白的RNA 表达;CDDO-IM 抑制TGF-β诱导的HSFⅠ型胶原蛋白、Ⅲ型胶原蛋白的RNA水平高表达。TGF-β1能够明显促进α-SMA、波形蛋白的RNA 表达;CDDO-IM 抑制TGF-β1 诱导的HSF 中α-SMA、波形蛋白的RNA水平高表达(图3)。

图1 细胞活性检测
Western blot 结果显示,TGF-β1能够明显促进Ⅰ型胶原蛋白、Ⅲ型胶原蛋白、波形蛋白、α-SMA 的蛋白表达;CDDO-IM 抑制TGF-β1 诱导的HSF 中Ⅰ型胶原蛋白、Ⅲ型胶原蛋白、波形蛋白、α-SMA 蛋白水平高表达(图4)。
2.4 PPAR-γ 激动剂缓解TGF-β1 诱导的大鼠冻结肩的肩关节僵硬
在麻醉状态下,应用大鼠肩关节的扭矩测试装置(图5)被动活动大鼠肩关节进行外旋和内旋,外旋相同角度时,TGF-β1诱导模型组比正常组需要更大的力矩,而罗格列酮治疗组需要的力矩最小,最大外旋角度约45°;而内旋20°之后也有同样趋势,最大内旋角度约45°;说明PPAR-γ 激动剂缓解TGF-β1 诱导的大鼠冻结肩的肩关节僵硬(图6)。
2.5 PPAR-γ激动剂抑制大鼠冻结肩的炎症反应
在麻醉状态下,用1 ml注射器收集各组大鼠肩关节液体至少0.3 ml 进行ELISA 试验检测环氧化酶-1(cyclooxygenase-1,COX-1)、白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)的表达情况。在TGF-β1 诱导模型组中,COX-1、IL-1β、TNF-α 的平均浓度分别为93.38 U/L、56.21 pg/ml、92.46 pg/ml;在罗格列酮治疗组中,COX-1、IL-1β、TNF-α的平均浓度分别为47.95 U/L、14.75 pg/ml、41.15 pg/ml,差异有统计学意义。结果显示TGF-β1 过表达能引起大鼠肩关节液中炎症因子升高,而罗格列酮治疗能够减少炎症因子产生(图7)。

图2 细胞迁移检测
2.6 PPAR-γ 激动剂抑制大鼠冻结肩的成纤维细胞异常纤维化
应用HE染色、免疫组织化学法对大鼠肩关节囊组织α-SMA、波形蛋白、Ⅰ型胶原蛋白、Ⅲ型胶原蛋白进行观察。在正常组中,纤维细胞未见增生,纤维结构排列较整齐,未见α-SMA、波形蛋白表达;TGF-β1诱导模型组可见纤维细胞大量增生,新生血管形成,炎症细胞增加,纤维结构紊乱,α-SMA、波形蛋白、Ⅰ型胶原蛋白、Ⅲ型胶原蛋白较正常组表达增加;罗格列酮治疗组中纤维结构较TGF-β1诱导模型组排列整齐,炎症反应减弱,α-SMA、波形蛋白、Ⅰ型胶原蛋白、Ⅲ型胶原蛋白表达减少。TGF-β1过表达诱导大鼠肩关节囊炎症形成,基质蛋白增加,纤维组织排列紊乱,成纤维细胞增生;而罗格列酮治疗将抑制冻结肩的炎症形成,减少基质蛋白生成,重塑纤维组织结构(图8)。
3 讨论
肩关节囊的炎症和纤维化是冻结肩疼痛和活动受限的主要原因,这已被普遍接受。尽管有大量相关的研究,但导致冻结肩发展的病因和病理机制仍知之甚少,对最佳治疗方法也没有一致意见,因此了解肩关节冻结过程中关节囊的病理变化对治疗有重要意义。目前认为冻结肩的病理变化是肩关节囊组织纤维化改变、挛缩、增厚,并且存在非感染性炎症反应。肩关节囊组织挛缩是冻结肩的主要病理改变,其基质主要由致密的Ⅲ型胶原纤维组成,富含成纤维细胞和肌成纤维细胞,手术解除肩关节囊挛缩可减轻疼痛,改善肩关节运动[22-24]。同时,我们认为冻结肩的发生与纤维化和炎症密切相关。冻结肩的形成包括一个由纤维化引起的组织硬化的过程,而纤维化是由炎症引起的。

图3 qRT-PCR检测Ⅰ型胶原蛋白、Ⅲ型胶原蛋白、波形蛋白、α-SMA基因表达情况,TGF-β1组和TGF-β1+CDDO-IM组比较,△P<0.05

图4 Western blot检测Ⅰ型胶原蛋白、Ⅲ型胶原蛋白、波形蛋白、α-SMA蛋白表达情况
近年来的研究表明,细胞因子和炎症因子在肩周炎的发病机制中起着重要作用。细胞因子调节结缔组织的成纤维细胞生长和功能,也可以调节成纤维细胞合成胶原蛋白。冻结肩的细胞外基质中Ⅰ型和Ⅲ型胶原蛋白异常增加,主要由成纤维细胞和肌成纤维细胞合成,这表明这种情况可能受到细胞因子的异常调节。TGF-β是强有力的促纤维化和促炎症反应的细胞因子,在各种组织的纤维化中发挥着关键作用。在本实验中,利用TGF-β诱导HSF增殖,除此之外,通过qRT-PCR 及Western blot 实验证明TGF-β可以引起细胞外基质中Ⅰ型和Ⅲ型胶原蛋白过度表达。同时,成纤维化的标志蛋白α-SMA,波形蛋白的RNA及蛋白水平比正常组升高,这表明TGFβ能够促进HSF增殖的同时引起细胞纤维化。因此,利用TGF-β1过表达腺病毒注射在大鼠的肩关节中,成功诱导大鼠冻结肩模型。然后通过检测大鼠肩关节活动度发现,TGF-β1诱导模型组的肩关节活动明显受限。同时,收集大鼠肩关节液进行ELISA 实验,检测结果证明TGF-β1 过表达能引起大鼠肩关节液中炎症因子升高。通过免疫组织化学实验进一步证明在TGF-β1诱导模型组中纤维细胞大量增生,纤维结构紊乱,同时新生血管形成,炎症细胞增加,细胞外基质中α-SMA、波形蛋白、Ⅰ型胶原蛋白、Ⅲ型胶原蛋白较正常组表达增加。
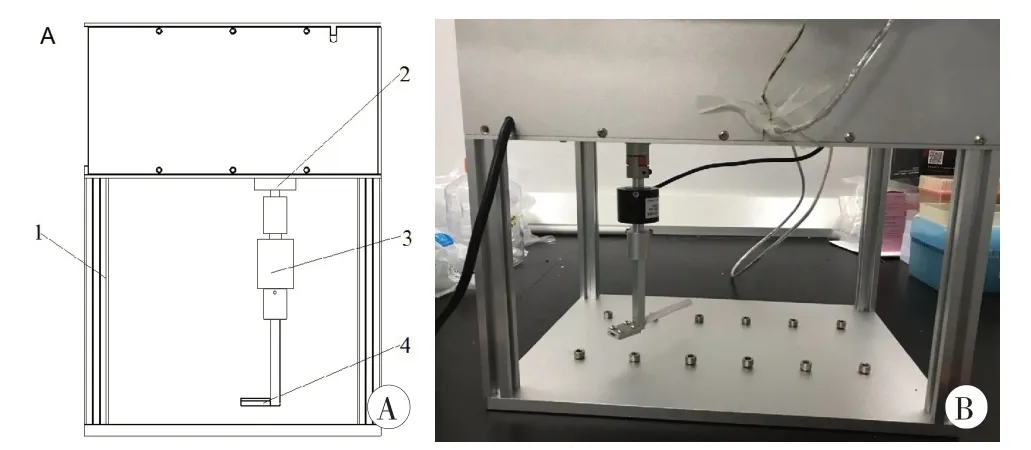
图5 大鼠肩关节的扭矩测试装置
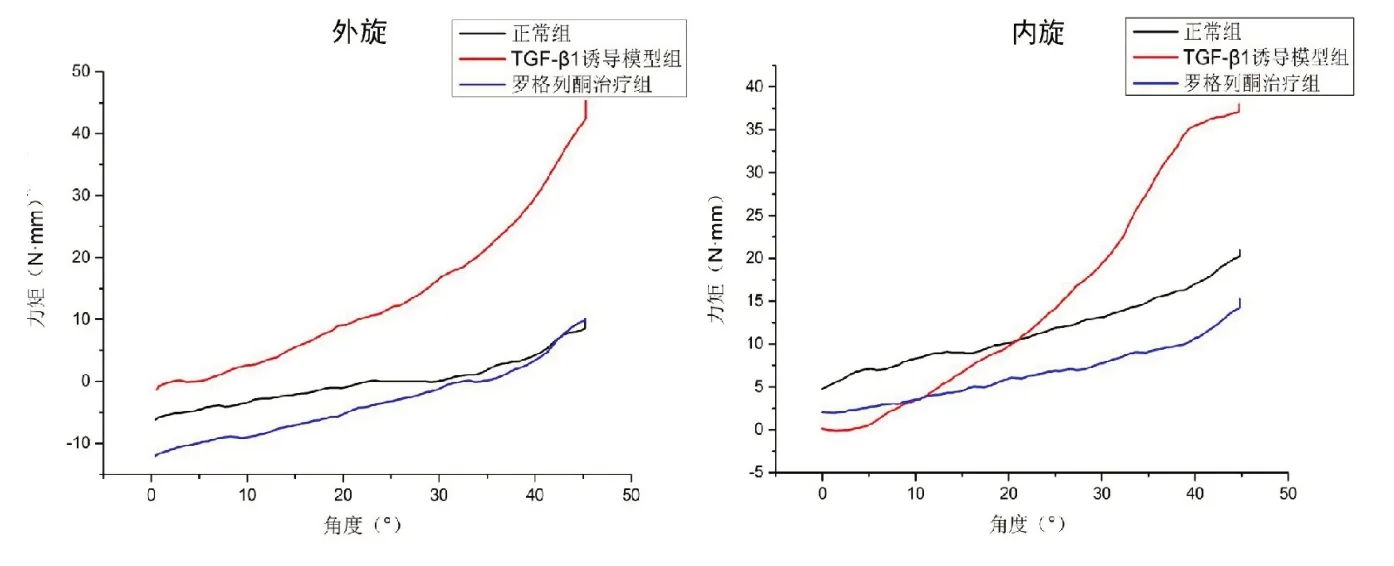
图6 被动活动大鼠肩关节进行外旋(A)和内旋(B)检测肩关节活动度
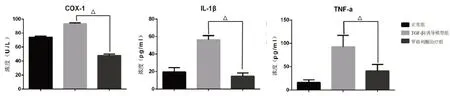
图7 ELISA检测COX-1、IL-1β、TNF-α的表达情况

图8 大鼠肩关节囊HE染色及免疫组织化学检测(×200,标尺:100 μm)
近年来的研究表明,PPAR-γ活化是一种重要的细胞抗纤维化、抗炎机制,在结缔组织细胞外基质的生理和病理重建过程中的负调控发挥重要作用[25,26]。因此,证实PPAR-γ激动剂能否治疗慢性纤维化疾病成为研究热点[27-29]。目前,有相关研究表明PPAR-γ激动剂是抗角膜纤维化的有效药物[30]。然而,PPARγ 激动剂对由TGF-β 过表达引起的冻结肩纤维化是否有治疗尚未有相关研究报道。本研究表明,PPAR-γ激动剂可抑制HSF和大鼠肩关节囊纤维化,对以纤维化为主要特征的冻结肩有积极的治疗作用。本研究结果表明,冻结肩的关节腔中存在炎症反应,并伴有纤维化。PPAR-γ激动剂显著抑制纤维细胞增生、炎症因子释放及纤维化相关蛋白的表达,说明PPAR-γ 激动剂抑制了炎症和纤维化过程。在动物实验中,2 周的药物治疗也增加了关节活动度,与TGF-β1诱导模型组比较,差异有统计学意义。这说明PPAR-γ 激动剂可延缓或逆转肩关节冻结引起的关节活动受限。因此,PPAR-γ激动剂可能是治疗冻结肩的一个有希望的基因靶点,但其作用机制尚需进一步研究。与目前使用的治疗方法相比,PPAR-γ激动剂治疗的非细胞毒性和抗增殖作用(细胞增殖实验及划痕实验显示)也是一个额外的优势。除此之外,与捆绑固定、冷冻刺激等传统的建模方法,我们的建模方法更方便易行。但是,本研究的实验动物样本量较少,活动度测量时的固定方法仍需改善。从长远来看,将假设PPAR-γ激动剂是治疗冻结肩的靶点,这需要更多的研究证明其治疗机制,如Smad 通路,这是冻结肩的另一个调节通路。我们还将改进基因传递方法,使其更安全、更有效。总的来说,通过细胞实验证实了TGF-β1能够引起人纤维细胞异常纤维化,并且利用大鼠冻结肩模型进一步探究冻结肩的病理改变主要是纤维细胞异常增生,炎症细胞浸润,纤维结构紊乱,而PPAR-γ 激动剂可以缓解大鼠冻结肩关节僵硬,减弱炎症反应,抑制异常纤维化。
