多肉植物红心莲茎腐病尖孢镰刀菌LAMP快速检测技术的建立
2020-11-25姚锦爱陈汉鑫侯翔宇余德亿
姚锦爱,黄 鹏,陈汉鑫,侯翔宇,余德亿
(1.福建省作物有害生物监测与治理重点实验室/福建省农业科学院植物保护研究所,福建 福州 350013;2.漳州市农业科学研究所,福建 漳州 363005)
0 引言
【研究意义】多肉植物红心莲(EcheveriaPerle von Nürnberg)又名紫珍珠,其根、茎、叶肥厚多汁,可储藏大量水分,是景天科(Crassulaceae)石莲花属(Echeveria)的重要商业化品种[1]。近年来,在福建漳州多肉植物种植基地发现红心莲植株出现叶片黄化、红紫、脱落等病症,经调查发现其茎部有褐色病斑,维管束和髓部变色;严重时,茎基部腐烂缩缢,植株倒伏死亡,对多肉植物产业造成威胁。经对发病部位切片镜检发现该病是由尖孢镰刀菌(Fusarium oxysporum)引起的红心莲茎腐病。尖孢镰刀菌是重要的植物土传病原真菌,潜伏期长,侵染初期在植株外观上通常不显症,待表现症状后再采取防控措施,为时已晚[2-3]。为有效防控尖孢镰刀菌引起的红心莲茎腐病为害,生产上迫切需要建立一种快速、准确检测红心莲等景天科多肉植物尖孢镰刀菌的方法。
【前人研究进展】环介导等温扩增技术(Loopmediated isothermal amplification, LAMP)是一种简便、快速、精确、经济的检测方法,其检测时间与常规PCR 法相比大大缩短(通常1 h 内)且特异性更高[4-6],此外LAMP 法还可通过添加SYBR Green I、calcein、溴酚蓝等DNA 染料,实现检测结果的直观可视化[7]。目前该检测技术已成功应用于炭疽菌属Colletotrichumspp.、镰刀菌属Fusariumspp.、疫霉菌属Phytophthoraspp.等植物病原真菌的快速检测[8-10]。其中镰刀菌属LAMP 检测涉及的寄主植物包括大豆、黄瓜、水稻、鹰嘴豆、玉米、小麦等[10-15]。【本研究切入点】但未见LAMP 应用于多肉植物镰刀菌属病原菌检测的相关报道。【拟解决的关键问题】为了获得特异性和灵敏度更高的适用于红心莲尖孢镰刀菌LAMP 检测的特异性引物,选取在镰刀菌种的水平上信息丰富保守基因EF-1a(Elongation factor 1α)为靶点,对红心莲尖孢镰刀菌EF-1a基因和其他镰刀菌序列进行差异性分析,选取6 个特定区域,设计了4 条特异性的LAMP 引物,建立一种LAMP可视化检测方法,以期在多肉植物红心莲茎腐病发生初期实现病原菌的快速准确检测,为该病害的早期防控提供依据。
1 材料与方法
1.1 材料及DNA 提取
供试菌株见表1,包括17 株镰刀菌属病原菌(其中10 株为尖孢镰刀菌)和10 株其他菌属病原菌(其中3 株寄主为多肉植物)。病原菌在装有100 mL马铃薯-葡萄糖肉汤(每升蒸馏水中含200 g 马铃薯,20 g 葡萄糖)的250 mL 三角烧瓶中培养,在26 °C恒温摇床150 r·min-1培养5~6 d;真空过滤收集各菌株菌丝,后冻干48 h,用DNA 提取试剂盒(天根生物技术有限公司)提取各菌株基因组DNA,DNA 浓度使用NanoDrop 2000C 分光光度计测定(Thermo Fischer Scientific, USA),DNA 作为LAMP 检测的模板用无菌双蒸馏水按要求稀释。
1.2 引物设计及合成
比对红心莲尖孢镰刀菌和GenBank 中的其他7 株镰刀菌属病原菌的EF-1a基因序列,利用在线LAMP 引物设计软件Primer software Explorer V4(http://primerexplorer.jp/elamp4.0.0/index.html; Eiken Chemical Co., Japan)设计一套红心莲尖孢镰刀菌特异性LAMP引物组,包括1 对外侧引物F3/B3 和1 对内侧引物FIP/BIP 组 成(图1);利 用 软 件primer 5 设 计1 对PCR 引物。LAMP 及PCR 引物序列见表2,由上海生工生物技术有限公司合成。
1.3 LAMP 反应体系优化
参考李华伟等[7]的方法建立红心莲茎腐病菌LAMP(25 μL)反应体系。LAMP 反应温度及时间优化:将底物、引物、红心莲尖孢镰刀菌样本DNA 依次加入PCR 管混匀,无菌双蒸水补至25 μL,分成2 组;1 组用于最佳温度梯度试验,反应设60、61、62、63、64、65、66 ℃等7 个温度梯度,反应时间为60 min;另1 组取前1 组中最佳反应温度,后设30、45、60、75、90 min 等5 个时间梯度;2 组试验反应最后分别于80 ℃加热10.0 min,最后在冰上终止反应;设3 次重复。LAMP 扩增结果的判定:反应前在PCR 管盖内侧加入2 μL 的1 000×SYBR Green Ⅰ,反应后瞬时离心将1 000×SYBR GreenⅠ离心至管底与LAMP 反应产物混匀,观察LAMP反应产物颜色判定扩增结果。LAMP 检测结果可靠性验证:以红心莲尖孢镰刀菌DNA 为阳性对照、无菌双蒸水为阴性对照,采用建立的红心莲尖孢镰刀菌LAMP(25 μL)反应体系及琼脂糖凝胶电泳法进行验证。
1.4 LAMP 特异性检测及灵敏度验证
特异性验证:对27 株供试菌株进行LAMP 检测,通过观察LAMP 产物颜色判定扩增结果;后从反应菌株中挑选1 株从红心莲上分离的F.oxysporum,3 株从多肉植物上分离的Colletotrichum destructivum、Corynespora cassiicola和Alternaria alternata,3 株 从其他寄主植物上分离的镰刀菌属菌株F.moniliforme、F.solani和F.sporotrichioides,共7 株菌株进行琼脂糖凝胶电泳,以无菌双蒸水为阴性对照,通过判定电泳梯形条带的有无验证LAMP 检测的特异性。试验设3 次重复。

表1 用于LAMP 试验的菌株Table 1 Fungal isolates tested by LAMP assay

图1 红心莲尖孢镰刀菌LAMP 引物设计Fig.1 Design of LAMP primers for F.oxysporum in Echeveria
灵敏度验证:将红心莲尖孢镰刀菌样本DNA按10 倍 浓 度 梯度依次稀释为10 ng·μL-1~1 fg·μL-18 个不同浓度,同时进行LAMP 检测和PCR 检测,比对2 种检测方法的灵敏度差异;试验设3 次重复。

表2 红心莲尖孢镰刀菌LAMP 及PCR 检测引物Table 2 LAMP and PCR primers of F.oxysporum in Echeveria
1.5 田间发病样品的LAMP 检测
利用建立的LAMP 检测方法对采自福建(10 份样本)及云南(5 份样本)自然感染的红心莲茎腐病发病样本进行检测,同时通过PCR 方法和组织分离法进行检测验证。LAMP 和PCR 检测样本DNA 参照Lan 等[12]的方法提取;组织分离法参照Yao 等[3]的方法进行,略加改动。
2 结果与分析
2.1 LAMP 检测方法建立
LAMP 反应温度及时间优化结果显示,在7 个温度梯度中,当反应温度62 ℃时,有梯形条带出现,但条带弱,随着反应温度提高,条带变亮,当反应温度达65 、66 ℃时,条带扩增效果较好且无明显差异(图2-a),确定最佳反应温度为65 ℃。在5 个时间梯度中,反应时间45 min 时,出现梯形条带,但条带弱,随着反应时间延长,条带变亮,在60、75、90 min 时扩增效果好,但效果差异不明显(图2-b),为提高LAMP 检测效率,确定最佳反应时间为60 min。依此建立红心莲尖孢镰刀菌LAMP(25 μL)最优反应体系:底物为20 mmol·L-1Tris-HCl、10 mmol·L-1(NH4)2SO4、 6.0 mmol·L-1MgSO4、50 mmol·L-1KCl、0.8 mmol·L-1甜菜碱、1.4 mmol·L-1dNTPs 和8 UBstDNA 聚 合 酶,引 物 为0.2 μmol·L-1外 侧 引 物F3/B3 和1.6 μmol·L-1内 侧 引 物FIP/BIP,1 μL 样本DNA(50 ng),无菌双蒸水补足25 μL;LAMP 反应温度及时间分别为65 ℃和60 min;后置于80 ℃加热10.0 min,最后在冰上终止反应。反应前在PCR 管盖内侧加入2 μL 的1 000×SYBR Green Ⅰ,反应后瞬时离心,观察产物颜色,阳性呈绿色,阴性呈黄绿色。
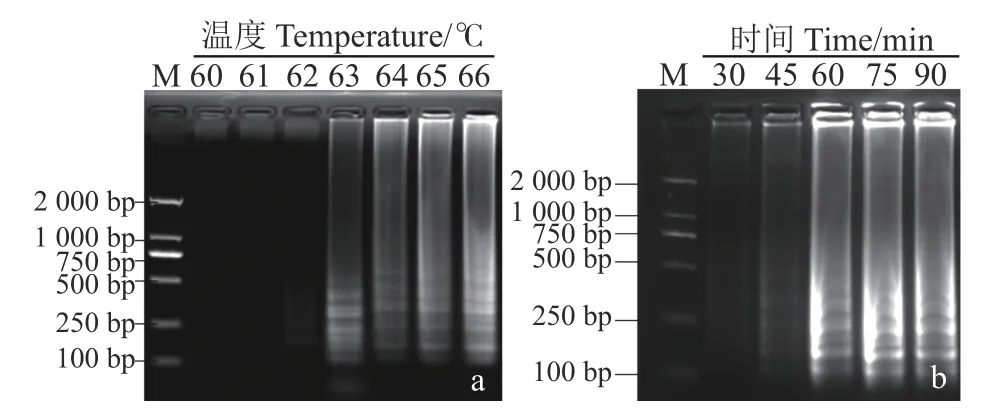
图2 LAMP 反应最佳温度及时间筛选Fig.2 Optimal reaction temperature and time for LAMP assay
LAMP 检测结果可靠性验证表明,阳性对照呈绿色,对应的琼脂糖凝胶电泳扩增出梯形条带;阴性对照呈现黄绿色,琼脂糖凝胶电泳无梯形条带(图3)。表明建立的LAMP 检测方法可行,能可靠检测到红心莲尖孢镰刀菌F.oxysporum。

图3 LAMP 检测红心莲尖孢镰刀菌Fusarium oxysporumFig.3 Detection of F.oxysporum on Echeveria by LAMP assay
2.2 LAMP 特异性检测及灵敏度验证
特异性检测结果显示,27 株供试菌株(表1)中仅有尖孢镰刀菌菌株的LAMP 反应管呈阳性反应,其他菌株LAMP 反应管均呈阴性反应;进行琼脂糖凝胶电泳的7 株菌株,仅红心莲尖孢镰刀菌产生电脉梯形条带,其他6 株菌株和阴性对照均没有产生条带(图4)。说明本研究建立的LAMP检测方法具特异性,仅能检出红心莲尖孢镰刀菌F.oxysporum。
灵敏度验证结果显示,当红心莲尖孢镰刀菌F.oxysporum样 本DNA 质 量 浓 度 为10 fg·μL-1时,LAMP 产物呈绿色(图5),发生阳性反应,对应的琼脂糖凝胶电泳扩增出梯形条带(图5);而PCR检测在DNA 质量浓度为100 fg·μL-1时条带开始变弱,DNA 质量浓度为10 fg·μL-1时已观察不到条带(图5)。说明本研究建立的LAMP 检测方法具更高的灵敏性,其灵敏度是PCR 检测的10 倍。
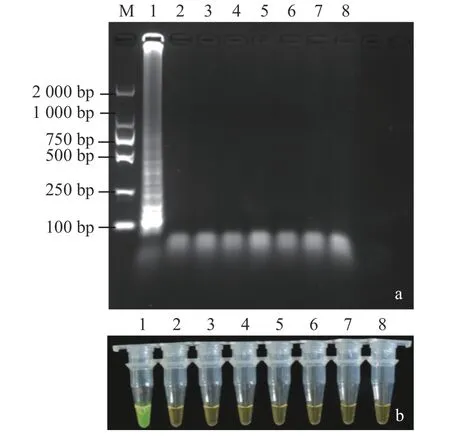
图4 LAMP 检测特异性验证Fig.4 Specificity of LAMP assay

图5 LAMP 灵敏度检测验证Fig.5 Sensitivity of LAMP and PCR
2.3 田间发病样品的LAMP 检测
选取15 份自然感染茎腐病菌红心莲茎腐病茎部组织样本,其中8 份茎部有明显褐色病斑;5 份症状不明显,茎部有零星褐色小点;2 份无发病症状。经LAMP 检测、PCR 检测和组织分离法分别检测结果表明,田间红心莲茎腐病原菌-尖孢镰刀菌的检出率均为100%,3 种方法的检测符合率100%,说明本研究建立的LAMP 检测法可用于由尖孢镰刀菌引起红心莲茎腐病的田间快速检测。
3 讨论与结论
LAMP 检测技术是新兴的基因扩增技术,被广泛用于植物病原菌的快速检测,与PCR 检测相比,其可在更短时间内简便地扩增到靶标病原菌[16]。本研究根据红心莲尖孢镰刀菌的靶标基因序列EF-1α的6~8 区 域 设 计 特 异 性LAMP 引 物 组,通 过LAMP 体系优化,建立了红心莲尖孢镰刀菌LAMP快速检测方法,其对红心莲茎腐病发病样本的检测结果与PCR 及组织分离法检测的结果一致,可用于由尖孢镰刀菌引起红心莲茎腐病的田间快速检测。
特异性是LAMP 检测技术的一个重要指标,国内外学者在尖孢镰刀菌及相关种的LAMP 检测中利用不同靶标基因序列设计特异性引物[12,17-18],并根据这些特异性引物建立相应的LAMP 检测体系。EF-1a基因序列信息丰富,有研究表明EF-1a基因在镰刀菌种间具有一定的保守性,与rDNA-ITS、RAPD、β-tubulin 等基因相比更具特异性[19],此外Ghosh 等[14]报道了以EF-1a基因为靶标设计LAMP 引物检测F.oxysporumf.sp.Ciceris,说明EF-1a基因序列适用于尖孢镰刀菌LAMP 引物的设计。本研究选择红心莲尖孢镰刀菌EF-1α作为靶标基因序列设计LAMP 特异性引物有效扩增到了所有的尖孢镰刀菌分离株,未能扩增所有其他菌株,包括一些密切相关的多肉植物上分离的Colletotrichum destructivum、Corynespora cassiicola、Alternaria alternata, 以 及F.sporotrichioides、F.moniliforme、F.sambucinum、F.solani、F.nivale、F.acuminatum和F.avenaceum等镰刀菌属真菌,表现出很高的特异性。
灵敏度是LAMP 检测技术的另一个重要指标,众多研究表明LAMP 检测灵敏度一般高于相应的PCR检测[4,18,20]。本研究建立的LAMP 方法DNA 检测最小质量浓度为10 fg·μL-1,而PCR 检测为100 fg·μL-1,LAMP 法检测灵敏度提高了10 倍;其灵敏度均高于以其他基因为靶点建立的LAMP 方法[17-18]。Ghosh 等[14]报道了以EF-1a基因为靶点设计LAMP 引物检测F.oxysporumf.sp.ciceris,其灵敏度与本研究设计的特异性引物一致。但随着灵敏度的提高,易导致开盖形成气溶胶污染,造成假阳性;本研究以SYBR GreenⅠ作显色剂,反应前直接滴于PCR 管盖内侧,降低了假阳性出现。
本研究建立的红心莲尖孢镰刀菌LAMP 快速检测技术体系,不仅特异性强、灵敏度高,而且检测结果可视、假阳性低,在田间能快速检测出由尖孢镰刀菌引起的红心莲茎腐病,具有很好的应用推广前景。今后,可对各种尖孢镰刀菌专化型的靶标基因序列进行探究,建立更加特异、灵敏的尖孢镰刀菌专化型LAMP 快速检测技术体系。
