水葫芦促进农田灌溉水中悬浮态镉沉降性能研究
2020-11-24郑明扬陈邵柠宋慧娟
郑明扬,陈邵柠,宋慧娟,彭 亮
(湖南农业大学资源环境学院,湖南 长沙 410128)
2014 年,中华人民共和国环境保护部和国土资源部联合公布的全国土壤污染调查结果显示,我国受到重金属污染的土壤达16%以上,其中耕地占19%,约有2 600 万hm2农田被镉污染[1]。耕地污染严重阻碍了农业的发展,威胁着农产品的安全。特别是,镉污染导致的大面积米镉超标引起了人们对我国土壤污染现状的强烈关注。
一般认为废水灌溉是目前农田镉污染的主要来 源[2]。灌溉水中通常含有大量的固体悬浮物(SS)。SS 本身组成比较复杂,对重金属元素具有较强的吸附能力[3]。现阶段的研究普遍认为,灌溉水中82%的镉被吸附在悬浮物上[4]。由于其胶体性质,镉与SS结合后很难沉淀。因此,去除灌溉水中SS 就能有效去除重金属镉。
目前已有不少报道提出了从水中去除悬浮物的方法,包括过滤[5]、化学沉淀[6]和生物絮凝[7]。课题组在前期研究中提出利用磷肥实现快速去除农田灌溉水中痕量镉的方法[8]。笔者基于灌溉水的特点以及镉的形态,利用水葫芦和磷肥协同的方法,快速絮凝去除悬浮态镉,期望以此建立灌溉水中镉的快速去除技术。
1 材料与方法
1.1 试验材料
选择浏阳河湖南农业大学段(28°18′42.30′N,113°10′32.81′E)采集河水(H-Water);并在校园内采集了生长有大量水葫芦的池塘水(G-Water)。首先过滤掉浏阳河水与池塘水中的浮游植物等杂质,然后置于5℃条件下冷藏。将浏阳河水沉积物和池塘底泥在阴凉处风干,然后用100 目0.15 mm 孔径标准筛过筛。将1.098 g Cd(NO3)2·4H2O 溶解于含有1% HNO3的1.0 L 蒸馏水中得到400 mg/L 的Cd 原液。在1.0 L 河水和池塘水中分别加入5.0 g 风干的河水沉积物或池塘底泥,以及0.1 mL 的Cd 原液,随后在进行30 min 的超声处理得到灌溉水水样,得到Cd 浓度为40 μg/L。最后,将2 种灌溉水保存于聚乙烯瓶置于5℃的黑暗条件下保存72 h,备用。每次用之前,将灌溉水超声30 min,然后取用。
1.2 试验设计
通过在100 mL 比色管中添加不同量的磷肥和100 mL 备用的灌溉水进行分批絮凝沉淀试验。选择2支装有100 mL G-Water 的比色管,分别加入磷酸氢二钾(K2HPO4),配制出磷(P)浓度为0.075 g/L(G-0.75P)和0.15 g/L(G-1.5P)的2 种溶液。另取2 支比色管直接加入100 mL 备用的G-Water 与H-Water,控制所有比色管中的Cd 浓度为40 μg/L,分别命名为CKG 和CKH。将这些溶液进行超声处理30 min,然后静置72 h。每支比色管分别在静置0、1、2、6、12、24、48 和72 h 后进行取样测量。所有的取样测量过程以及后续试验在以上4 种试液中同步进行。
测样时,从比色管的顶部取5 mL 样品,用紫外-可见光谱仪(UV-1780,日本岛津)测定波长在660 nm 处的吸光度,确定浓度随时间的变化。在剩下的溶液中加入3 mL 浓HCl 和1 mL 浓HNO3使溶液完全消化,随后在100℃条件下水浴加热3~5 h。最后通过石墨炉原子吸收光谱仪(GFA-6880,日本岛津)测定出Cd 浓度。
1.3 Zeta 电位与悬浮固体粒径的测量
使用Zeta 电位仪(JS94H,上海中晨)测定不同样品中SS 的Zeta 电位。
采用激光粒度仪(LS-POP-9,珠海欧美克)进行悬浮颗粒的粒径分布测定。使用平均粒径(D 50)来表示絮体尺寸[9]。
1.4 蛋白质和EPS 的测定
蛋白质测定:取每种水样各1 mL,加入3 mL 考马斯亮蓝G-250 溶液,放置2 min,然后从顶部取一个样品,用紫外-可见光谱仪测量在595 nm 处的吸光度。
EPS 测定:取H-Water 和G-Water 这2 种水样各0.5 mL,分别加入0.4 mL 蒸馏水,再加入0.8 mL 9%苯酚和4 mL 浓硫酸,用紫外-可见分光光度计测定样品在485 nm 处的吸光度。
2 结果与分析
2.1 水样的基本性质
从表1 可以看出,池塘水和浏阳河水水样中的总碳(TC)含量分别为47.70 和25.40 mg/L,其中2 个水样的总无机碳(TIC)含量分别为26.38和13.46 mg/L,总有机碳(TOC)含量分别为21.32 和11.94 mg/L,含水葫芦根系分泌物的池塘水中总碳含量是没有生长水葫芦的河水的近2 倍,这表明水葫芦根系会分泌大量有机质。而池塘水中TIC 含量也远高于河水,这是由于溶解无机碳主要以CO2、H2CO3、HCO3-和CO32+离子等形式存在,它们来源于溶解有机物的微生物降解和沉积物的再悬浮作用等,同时也受到来自水体环境中溶解氧与铁浓度因素的重要影响[10]。池塘水和河水的总磷(TP)含量分别为0.48 和0.18 mg/L,池塘水中磷含量较高。池塘水和河水的电导率分别为416和213 μs/cm,池塘水中的电导率更高,这与TIC 和TP 的结果一致,表明池塘水中含有更高的离子浓度。池塘水和河水样品中Cd 的含量分别为0.098 和0.160 μg/L,含量均较低。池塘水和河水的pH 值分别为7.5和7.8,均呈现弱碱性。在水葫芦的影响下,池塘水中的Cd 浓度更低。
2.2 水葫芦-磷肥联合去除悬浮态镉性能
由记录镉浓度随时间变化的数据(图1)可以发现,1 h 后CKH、CKG、G-0.75P 和G-1.5P 这4 组中的镉浓度分别降低至30.71、22.23、14.34 和11.93 μg/L。 CKH、CKG、G-0.75P 和G-1.5P 使初始镉浓度(40 μg/L)降低至5 μg/L 以下分别需72、6、2 和2 h。其中,池塘水中镉的去除速度是河水中的12 倍。而磷肥的加入也显著提高了镉的去除速率,G-0.75P 和G-1.5P 组的试液中镉的去除速率相同,分别是池塘水的3 倍、河水的36 倍。通过测量表明,镉的浓度与SS 浓度显著相关,两者之间具有很强相关性。由于悬浮镉和非悬浮镉的共沉淀,导致镉浓度在12 h 内急剧下降。CKG 中镉去除速率远高于CKH,表明水葫芦产生的根系分泌物能促进灌溉水中镉的去除。这是由于根系分泌物中含有大量有机物质,起到絮凝作用,而添加磷肥可进一步提高絮凝效果。由课题组前期研究可知,磷肥可以起到增加SS 中高价铁含量[8]。根系分泌的大分子有机质和磷肥可协同促进SS 沉淀,因为磷肥通过降低SS 的表面电位来压缩SS 的水合半径,有机大分子可以将SS 絮凝在一起形成团聚体。

表1 水样的基本参数
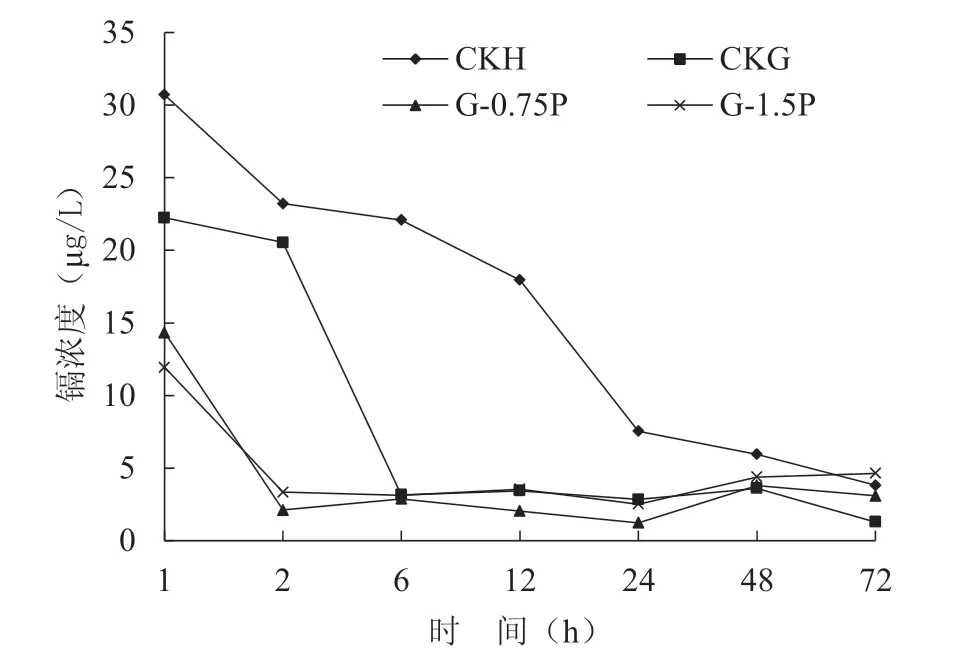
图1 河水、池塘水和加入不同浓度磷酸氢二钾的试液中镉含量随时间的变化
2.3 悬浮固体粒径测量
不同水体中SS 的光学显微镜图像显示如图2。与H-Water 和G-Water 对比,G-0.75P 和G-1.5P 试液中SS 粒径明显增大。值得注意的是,河水中的SS 大小明显小于其他几组。图3 为2 种灌溉水中SS 在初始状态下(10 min)的粒径分布图,详细的结果见表2。通常情况下,D(50)代表SS 的平均粒径。河水的平均粒径为8.25 μm、池塘水为10.09 μm;河水的D (3,2)和D(4,3)之间差异值为8.65、池塘水为10.47, 表明池塘水中粒径分布范围更宽。这些结果表明水葫芦池塘水中SS 比河水中形成的颗粒更大,分布范围更宽,这是由于水葫芦产生的根际分泌物促进细颗粒在短时间内聚集成较大的絮状物。G-0.75P 和G-1.5P水样中由于SS 沉降速度太快,无法准确测量SS 的粒径分布。
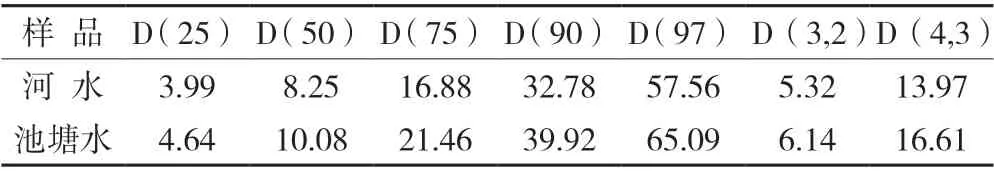
表2 河水与池塘水的悬浮颗粒的絮体粒径分布 (μm)
2.4 Zeta 电位测量
为了进一步探索详细的絮凝机理,测量不同处理下SS 的Zeta 电位,结果显示H-Water、G-Water、G-0.75P和G-1.5P 的ZETA 电位分别为-22.43、-17.23、-16.70和-13.61 mV。相比于河水,池塘水中的Zeta 电位有所增加,这是由于水葫芦的根系分泌物,比如糖、有机酸、氨基酸、类黄酮、铁载体和酶等造成的。在这些物质中,一些被认为能降低SS 负电荷的有机物,仅是具有正电荷的氨基官能团的有机物。而G-0.75P和G-1.50P 的Zeta 电位降低,是因为在OH-和PO43+同时存在的条件下,空气中氧气会将水体中Fe2+能快速氧化成Fe3+,从而降低SS 的Zeta 电势[8]。根据DLVO 理论,Zeta 电位的绝对值越小,颗粒之间的排斥力越弱,则分散体系稳定性越差,越容易聚沉,发生絮凝现象,从而导致SS 的沉积过程越快。
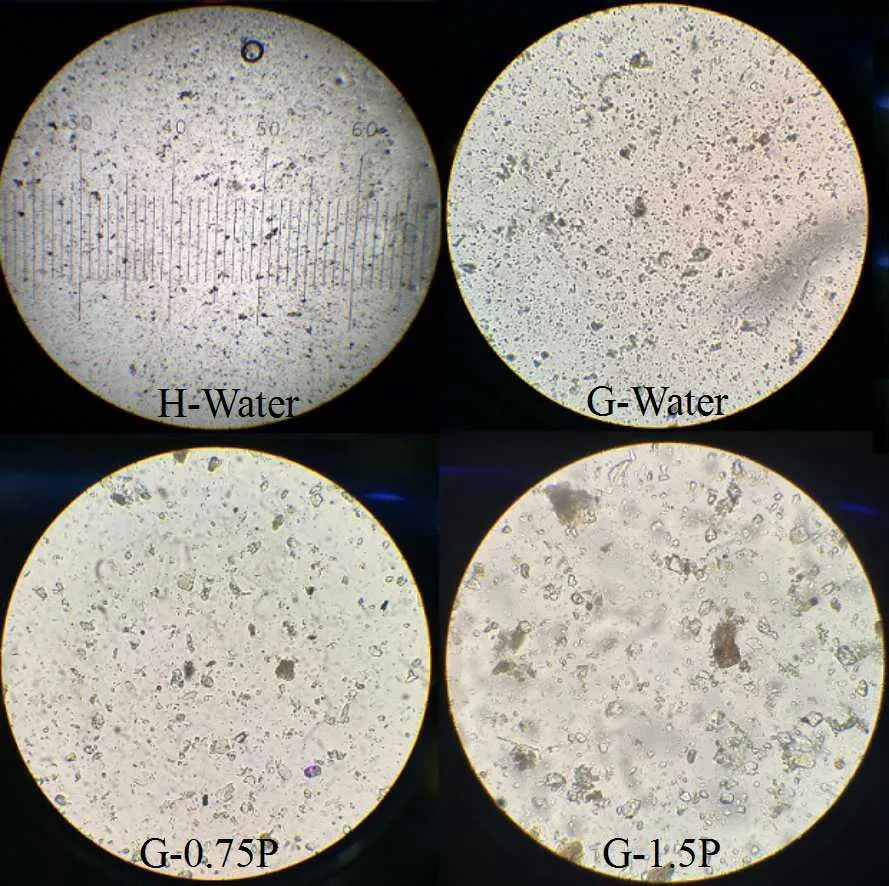
图2 H-Water,G-Water,G-0.75P 和G-1.5P 的悬浮物絮凝情况
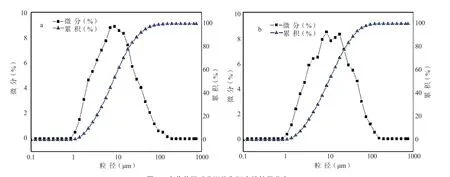
图3 水葫芦根系分泌物和河水的粒径分布(a: H-Water; b: G-Water)
2.5 电位滴定以及蛋白质和多糖
水样自动电位滴定试验结果显示(图4a),G-Water和H-Water 的滴定曲线存在明显差异。根据基团的质子化常数,可以将样品的基团分为:羧酸基团(4 <pKa<6),磷酸根基团(pKa=7)和羟基(或酚)/氨基(9<pKa <11)。电位滴定拟合结果于表3。H-Water 的pKa 分别为8.30 和9.68,分别对应于磷酸和羟基/氨基官能团;而G-Water 的pKa 分别为5.13 和9.09,它们分别与羧基和羟基/氨基符合。此外,磷酸基团和羟基/氨基分别占河水和池塘水的主导地位。池塘水中的官能团总数高于河水,这是由于水葫芦分泌了根系分泌物引起的。考虑到G-Water 中SS 的Zeta 电位低于H-Water,推测在根系分泌物中存在大量的氨基。氨基在pH 值为7.5 时具有正电荷,可以中和SS 的负电荷。根系分泌物中含有一定量的羧酸基团,它们以苹果酸、草酸、丙酸、乙酸、琥珀酸、苯甲酸和癸二酸等有机酸的形式产生。大分子上的羧基对重金属具有较强的螯合和络合能力,促进了Cd 的聚集和沉淀。但是羧基的小分子会干扰镉的沉淀。
水葫芦根系分泌物主要包括多糖、蛋白质和核酸,其中前2 种物质占主要地位。为进一步探索影响絮凝机理,笔者测量了水中蛋白质和多糖含量,结果显示于图4b。H-Water 和G-Water 的蛋白质含量分别为3.450 和3.625 μg/L,2 种水体中蛋白质含量基本一样;多糖含量分别为19.46 和63.72 μg/L,池塘水中多糖含量约为河水的3 倍。G-Water 的絮凝速度高于H-Water的絮凝速度,可能是由于G-Water 中多糖含量较高所致。多糖在SS 中的不同颗粒之间产生桥接作用,然后形成聚集。其他研究表明,污泥中的胞外聚合物含有76.3%的多糖,21.6%的蛋白质,对SS 具有较高的絮凝效果[11]。根据前人研究和试验结果,推测出某些具有氨基官能团的多糖,如透明质酸,是水葫芦根系分泌物的主要组分,是引起絮凝作用的关键物质。
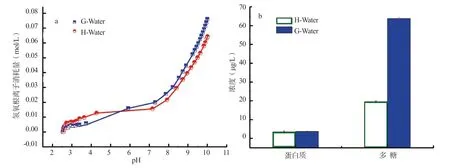
图4 25℃时池塘水和河水的电位滴定曲线(a)、蛋白质和Eps 含量(b)
3 结 论
水葫芦与磷肥的协同效应能有效地促进灌溉水中镉的去除。在葫芦科植物水葫芦根系分泌物作用下,镉的去除速度是没有生长水葫芦的12 倍。在经水葫芦与磷肥的协同处理后,去除速度是没有生长水葫芦的36 倍。40 μg/L Cd 仅需2 h 即可降至5 μg/L 以下,水葫芦根系分泌物中含有氨基多糖,可以中和悬浮固体的负电荷,絮凝悬浮镉。磷肥可以通过增加Fe3+/Fe2+的比例来降低悬浮固体的Zeta 电位。研究表明,在养殖水葫芦的池塘中施加磷肥是一种快速去除灌溉水中微量镉的有效方法。

表3 池塘水和河水的电位滴定结果
