光遗传操控D2-MSNs揭示跑台训练改善帕金森病小鼠运动行为障碍的可能机制
2020-11-24刘晓莉张丹昱赵刚乔德才
刘晓莉 张丹昱 赵刚 乔德才
北京师范大学体育与运动学院(北京100875)
纹状体(striatum,Str)是接受运动皮质信息传入,参与基底神经节直接/间接通路运动调节的重要核团。该核团约95%的投射神经元是γ-氨基丁酸(γaminobutyric acid,GABA)能中等多棘神经元(medium spiny neurons,MSNs),根据其细胞膜上表达不同多巴胺(dopamine,DA)受体亚型分为多巴胺Ⅰ型受体(D1DR)的MSNs(D1-MSNs)和多巴胺Ⅱ型受体(D2DR)的MSNs(D2-MSNs);激活D1DR,兴奋直接通路,易化运动;激活D2DR,兴奋间接通路,抑制运动的发起及多余动作的产生;直接与间接通路协同配合共同完成运动信息整合、处理、优化,精确调节运动行为的执行[1]。近些年来,有研究采用光遗传学技术(optogenetics),通过光刺激兴奋性(channelrhodopsin-2,ChR2)或抑制性(halorhodopsin,NpHR)光敏感蛋白,实现对MSNs 特定神经元精确控制[2],成功诱导并缓解了震颤等帕金森病(Parkinson's disease,PD)症状[3]。本实验室前期研究证实,运动具有明显改善PD模型大鼠行为功能障碍的效果[4],并推测其可能机制与运动促进纹状体MSNs 的功能可塑性有关,主要作用靶点是D2-MSNs[5]。本研究采用光遗传学技术靶向操控纹状体D2-MSNs,观察PD模型小鼠自主活动行为的变化,为进一步揭示D2-MSNs在改善PD动物运动行为障碍中的作用提供实验依据。
1 材料与方法
1.1 实验动物与分组
实验动物为雄性转基因小鼠(D2-Cre小鼠,特异性表达多巴胺Ⅱ型受体重组酶,体重18~25 g,由北京师范大学认知神经科学与学习国家重点实验室提供),分笼饲养,自由饮食饮水,动物房12 h 光照和12 h 黑暗交替,温度与湿度保持恒定。实验过程按实验动物使用3R原则给予人道主义关怀。正式实验前先进行1周环境及跑台适应性训练,剔除无法完成预设跑台训练方案的小鼠,将所有剩余实验小鼠随机分成假手术安静组(Control 组,n=6)和6羟基多巴胺(6-Hydroxydopa⁃mine,6-OHDA)注射模型组(n=28);模型组随机分为帕金森组(PD组)、帕金森运动组(PD+Ex组)和帕金森光刺激组(PD+Laser 组),各组分批次进行手术后剔除死亡和不符合模型标准的小鼠,最终保证每组样本量一致(n=6)。
1.2 纹状体病毒转染
PD+Laser 组小鼠适应性喂养结束后24 h禁食,自由饮水,腹腔注射5%水合氯醛麻醉(350 μg/g)后将小鼠固定于立体定位仪上,沿颅顶矢状缝切开皮肤,于纹状体处(AP:+ 0.5 mm,R:1.8 mm,DV:-3.0 mm)[6]钻孔,注射含抑制性光敏感蛋白(rAAV- Ef1α- DIOeNpHR3.0-EYFP-WPRE-pA)的病毒(枢密科技,武汉),注射结束后杀菌缝皮(图1)。

图1 光敏感蛋白病毒注射及光纤埋置示意图
1.3 PD小鼠模型建立及鉴定
PD+Laser 组小鼠病毒注射1周后,依据于燕等[7]纹状体两点注射6-OHDA药物的方法对PD组、PD+Ex组和PD+Laser组建立PD小鼠模型。手术方案同前,小鼠麻醉后固定于立体定位仪上,沿颅顶矢状缝切开皮肤,于纹状体处(AP:+ 0.5 mm,R:1.8 mm)钻孔[6],在颅骨下-3.0 mm 和-2.0 mm 两点分别注入6-OHDA 溶液(2 μg/μL,含0.02%抗坏血酸和0.9%生理盐水),共4 μL,以0.5 μL/min 的速度注射完后留针3 min,匀速退出。10 min 后再将光纤头和套管植入目标靶区,牙科水泥和螺钉固定。Control组于相同位点注射等量含0.02%抗坏血酸的生理盐水。
6-OHDA注射后第7天对实施PD造模的小鼠腹腔注射阿扑吗啡(APO,0.125 g/L,0.5 μg/g)诱导旋转试验,并记录旋转圈数;筛选净旋转圈数>120 r/30 min作为PD小鼠模型制备成功的判断标准之一[7]。
1.4 运动干预方案
PD+Ex 组在手术后一周开始运动干预;非运动组小鼠置于跑台中相同时间,但不参与运动。运动干预方案[8]采用匀速跑台运动(18 m/min,40 min/d,5 d/w,4 w),运动强度约为70%~76%VO2max[30]。
1.5 小鼠自主活动能力评价
运动干预结束后24 h,通过旷场实验(open field test,OFT)测试各组小鼠的自主活动能力。将Control组、PD组和PD+Ex小鼠置于40×40×40 cm的无盖立方体中,数码摄像机位于箱体正上方80 cm处,待小鼠适应性活动5 min 后,通过SMART 3.0 软件记录小鼠在旷场内10 min自主活动情况,通过跟踪小鼠质心得到运动轨迹,统计各组小鼠10 min 内运动总距离、平均运动速度和活动模式占比等参数。活动模式划分:速度>15 m/s 定义为快速移动(fast movement),速度<5 cm/s定义为静止状态(resting),速度介于两者之间为慢速移动(slow movement)。
PD+Laser 组小鼠的旷场实验中采用光遗传设备(Shanghai Laser & Optics Century Co.,Ltd.)的光源控制器给予PD+Laser 组小鼠589 nm 波长、10 mW 的黄光刺激,刺激方案为30 s 光照、30 s 关闭,30 s 间隔的循环,重复7 组,共10 min[9](图2)。统计10 min 内运动总距离、平均运动速度和活动模式占比等参数,并根据PD+Laser 组小鼠在30 s 刺激前(Pre)、30 s 光照(Laser)、30 s 关闭(Post)状态的运动轨迹统计各30 s内运动距离、平均运动速度和活动模式占比等参数。
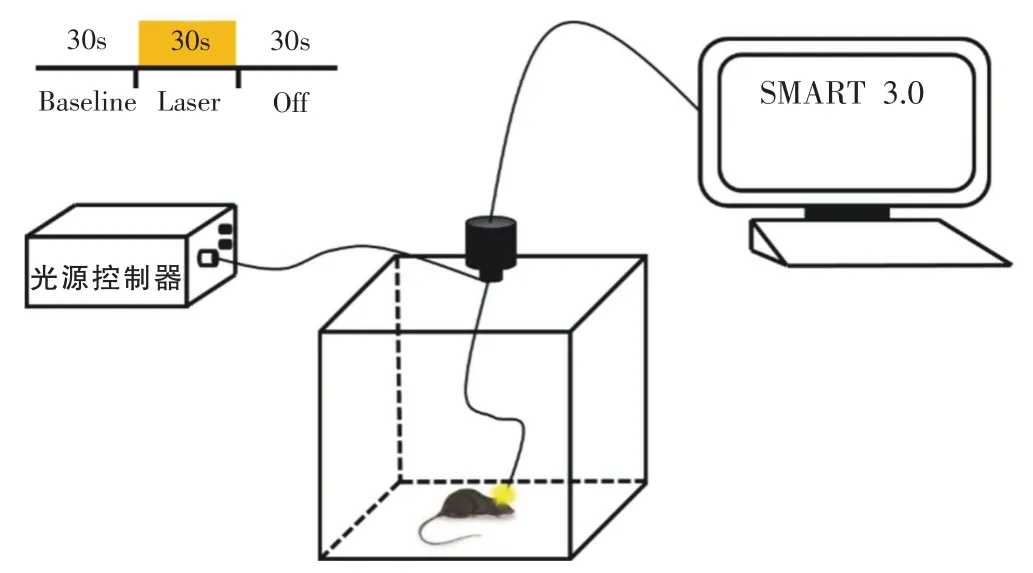
图2 旷场及光遗传实验装置示意图
1.6 纹状体酪氨酸羟化酶检测
所有实验结束24 h 后,选择PD 组和Control 组小鼠各6只,腹腔注射5%水合氯醛麻醉(350 μg/g),用生理盐水(30 mL)和4%多聚甲醛溶液(30 mL)经左心室-升主动脉插管灌流,并迅速取出脑组织置于30%蔗糖的多聚甲醛溶液中固定保存24 h。将脑组织取出后进行脱水、修块、包埋,连续冠状切片。从每只小鼠纹状体的连续切片中每隔5张选取1张,每个脑组织平均选择6 张切片进行免疫组织化学染色、脱水、透明、封片,用Olympus-DP72 型显微镜对纹状体区域拍照;采用Image-Pro Plus 6.0软件对纹状体酪氨酸羟化酶(ty⁃rosine hydroxylase,TH)免疫阳性纤维光密度(optical density,OD)进行统计分析。
1.7 纹状体D2-MSNs动作电位记录及光敏蛋白表达
所有实验结束后对PD+Laser 组D2-Cre 转基因小鼠进行离体脑片(300 μm)制备,在全细胞膜片钳Iclamp模式下,通过记录电极注入电流(40 pA,0.1 Hz,500 ms)使D2-MSNs 爆发动作电位,统计光刺激前后D2-MSNs 动作电位发放个数;并对脑片固定、脱水、包埋,在激光共聚焦显微镜下观察病毒转染情况。
1.8 统计分析
所有实验数据均以(±s)表示,采用独立样本t检验分析Control组与PD组小鼠TH免疫阳性纤维光密度比值的组间差异,配对样本t检验分析光刺激前后小鼠运动距离、速度的组内差异,one-way ANOVA 分析Control组,PD组和PD+Ex组及光刺激前、中、后小鼠运动距离、速度的组间差异,卡方检验分析不同模式活动占比的组间差异;P<0.05表示差异具有统计学意义。
2 结果
2.1 PD小鼠模型及光敏蛋白表达的验证
APO 诱导旋转行为试验是评价偏侧损伤PD 动物模型可靠性的经典方法之一[10]。旋转行为试验结果显示,Control组均无异常旋转行为,注射6-OHDA组小鼠(n=28)中向健侧旋转圈数与损毁侧旋转圈数差值>120 r/30 min共18只,PD成模率约为64.3%,剔除其余未达标小鼠。免疫组织化学结果显示,Control 组小鼠双侧纹状体TH阳性纤维表达均匀、对称,PD组小鼠损毁侧(右侧)纹状体DA合成限速酶TH阳性纤维出现大量丢失,呈现明显不对称性(图3A、B),表明纹状体DA投射大量减少,PD小鼠模型复制成功。
行为学实验结束后,采用全细胞膜片钳技术观察光刺激前后D2-Cre 转基因小鼠D2-MSNs 对注入电流的反应;当给予30 s 波长为589 nm 光刺激后D2-MSNs 动作电位发放个数减少(如图3C)。通过激光共聚焦显微镜在绿色激发光下观察到光敏蛋白eN⁃pHR3.0 在D2-MSNs 表达(图3D),表明病毒转染成功,为下一步激光精准操控纹状体D2-MSNs奠定了基础。
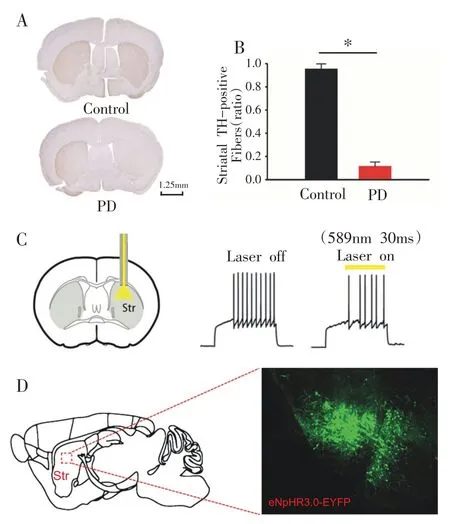
图3 纹状体TH染色及光敏感蛋白表达
2.2 运动干预对小鼠自主活动能力的影响
10min 旷场实验统计结果表明,PD 组小鼠自主活动总距离和平均运动速度较Control 组小鼠显著减少(P<0.05);PD+Ex 组小鼠自主活动总距离和平均运动速度均较PD组小鼠显著增加,但仍低于Control组小鼠(图4A、B,P<0.05)。与Control 组相比,PD 组小鼠静止状态占比显著增加(P<0.05),慢速和快速移动占比显著减少(P<0.05);PD+Ex 组小鼠静止状态占比显著增加(P<0.05),快速移动占比显著减少(P<0.05),慢速移动无显著变化(P>0.05);与PD 组小鼠相比,PD+Ex 组小鼠静止状态占比显著减少(P<0.05),慢速和快速移动占比显著增加(P<0.05,图4C)。

图4 运动干预对小鼠自主活动能力的影响(n=6)
2.3 光刺激对PD小鼠自主活动能力的影响
给予PD+Laser组小鼠10 min间歇、重复的黄光刺激后,其在旷场中运动总距离和平均运动速度较PD组显著增加(P<0.05);静止状态占比较PD 组显著降低(P<0.05),慢速和快速移动占比较PD 组显著增加(P<0.05,图5A、B、C)。
与光刺激前相比,给予30 s黄光刺激PD+Laser 组小鼠活动总距离、平均运动速度均显著增加(P<0.05),且快速移动占比显著增加(P<0.05),静止状态占比显著减少(P<0.05,图5D、E、F)。
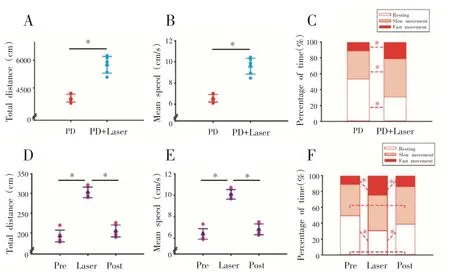
图5 光刺激对PD小鼠自主活动能力的影响(n=6)
2.4 运动与光刺激后PD 小鼠自主活动能力变化情况对比
运动与光刺激两种干预方式对PD 小鼠自主活动行为影响的对比分析如图6所示。与干预前相比,运动和光刺激后小鼠总运动距离及平均运动速度均显著增加(P<0.05,P<0.05,图6B、C);静止状态占比显著减少(P<0.05),快速移动占比与慢速移动占比显著增加(P<0.05,P<0.05,图6D);可见运动与光刺激两种干预方式对PD小鼠自主活动行为的改善作用基本相似。
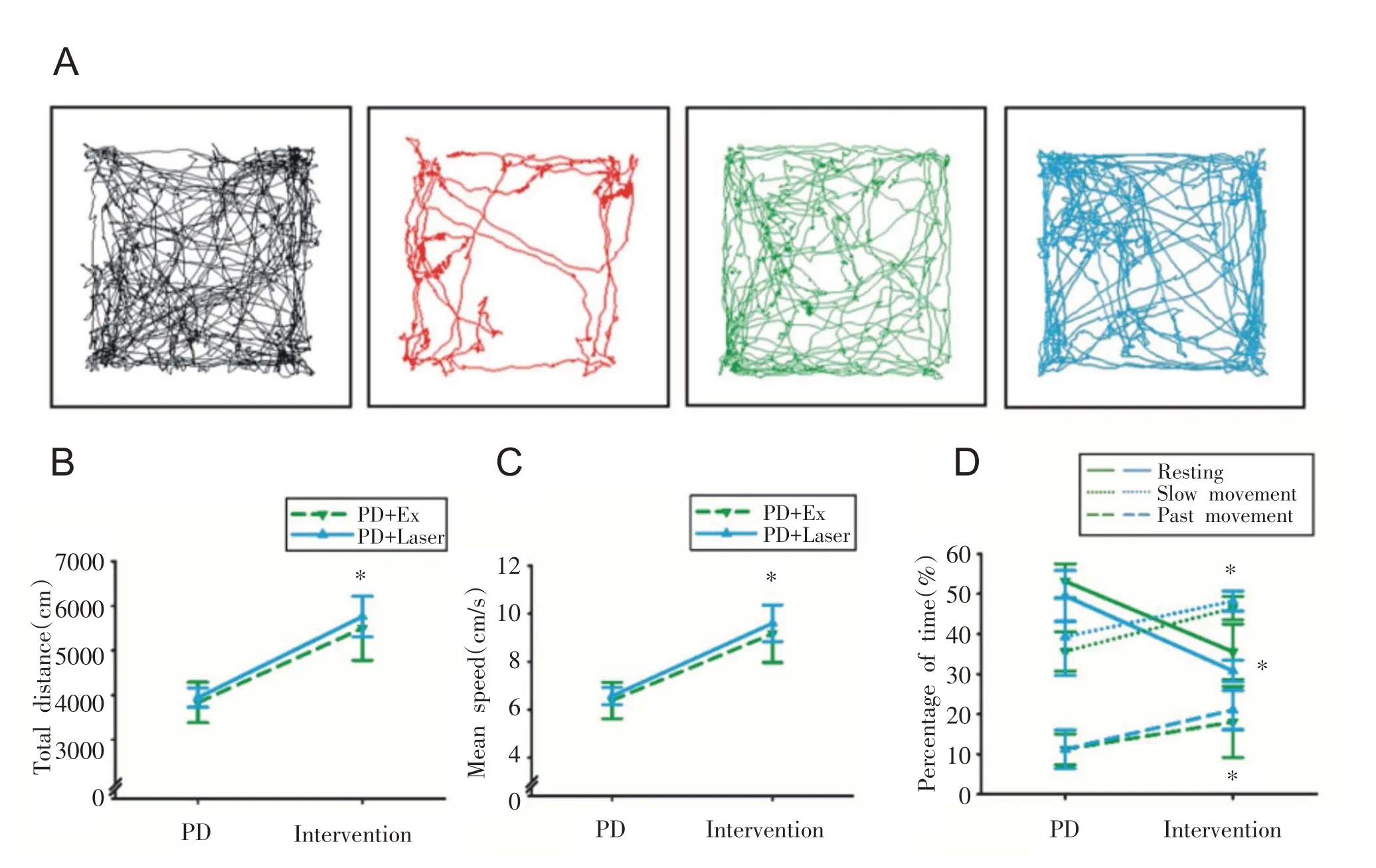
图6 运动与光刺激后PD小鼠自主活动能力及活动模式占比情况比较(n=6)
3 讨论
纹状体神经元主要由两类表达不同DA 受体的MSNs 组成,D1-MSNs 接受来自皮层和黑质致密部(SNc)投射,再将信息投射至下游苍白球内侧部/黑质网状部复合体(GPi/SNr),构成运动调节的直接通路(Str-SNc-GPi/SNr);来自黑质致密部的DA神经元释放DA 至纹状体后,通过作用于D1DR 引起Gs 蛋白偶联反应,并介导P 物质(substance P,SP)和强啡肽(dynor⁃phin,DYN)表达,兴奋直接通路。D2-MSNs 接受的信息经苍白球外侧部(GPe)投射至丘脑底核(STN),最终到达GPi/SNr 复合体,构成运动调节的间接通路(Str-GPe-STN-GPi/SNr);DA 释放至纹状体后作用于D2DR主要引起Gi/o 蛋白偶联反应,并介导脑啡肽(enkepha⁃lin,ENK)表达,抑制间接通路[1]。因此,纹状体是基底神经节直接/间接通路的起始核团,分别通过D1-MSNs和D2-MSNs 调控直接与间接通路之间的平衡,实现对运动行为的精确调控。
PD 是一种常见的神经退行性疾病,黑质致密部DA 能神经元变性缺失及纹状体DA 水平明显减少是PD的主要病理特征。PD发病机制尚未明确,但目前认为基底神经节直接/间接通路功能失衡是导致PD 患者运动行为障碍的主要原因[11]。研究发现,随着黑质致密部DA 神经元的渐进性丢失,PD 大鼠纹状体D1-MSNs 和D2-MSNs 树突棘出现脱落现象,进而引起黑质-纹状体微环路功能异常[12];进一步研究发现,纹状体DA水平减少会导致皮层-纹状体通路Glu投射的代偿性增强,纹状体D2DR 敏感性增高,间接通路过度兴奋并引发PD 患者的行为功能障碍[13];给予适量左旋多巴胺(levodopa,L-DOPA)或D2DR 激动剂治疗后D2-MSNs兴奋性降低,PD患者的行为功能异常减轻[14]。由此推测,D2-MSNs 的过度兴奋可能是导致基底神经节直接/间接通路功能失衡,引发PD 患者行为功能障碍的重要原因。
运动的神经性保护作用可调节中枢神经系统的功能[15],促进突触可塑性[16]。规律的体育活动明显降低了PD的患病风险[17],不同方式运动干预对PD模型动物运动行为和黑质-纹状体DA系统产生有益的影响。Chen等[18]研究发现,运动改善了PD 大鼠的步速及步态,且延长在转棒上停留的时间。Zhou 等[19]研究也发现,自主运动或强迫性运动均可以改善PD 大鼠在转棒和水迷宫测试中的运动表现。Forouzan等[20]研究显示,运动可显著提高PD大鼠的四肢力量和平衡能力。此外,运动还可以减轻PD大鼠D2-MSNs 树突棘脱落[21],下调纹状体多巴胺转运体(DAT)表达[22],并上调D2DR表达[23],逆转D2DR超敏现象。本实验室前期研究也已经证实,跑台运动干预可以改善PD 大鼠的步态异常[24]及四肢协调性[25];增加纹状体D2DR 表达及其功能,促进纹状体MSNs树突棘重塑,进而改善基底神经节直接与间接通路的失衡[26];推测纹状体D2DR 可能是运动改善PD模型动物行为功能障碍的重要细胞分子靶点。
光遗传学又称光刺激基因工程(optical stimulate plus genetic engineering),是基因遗传与光控操作相结合的一种新兴技术,利用光刺激光敏感蛋白实现对生物体内某一特定神经元活动及功能的精准控制。转染视紫红质通道蛋白ChR2 的神经细胞,350~550 nm 的蓝光刺激使通道打开,Na+、Ca2+等阳离子进入胞内,引起细胞去极化,从而兴奋神经元。转染盐系菌视紫红质蛋白NpHR 的神经细胞,425~650 nm 的黄光刺激使通道打开,Cl-等阴离子进入胞内,引起细胞超极化,从而抑制神经元的兴奋性。近些年来,光遗传技术应用于神经科学的研究领域,弥补了电生理学方法对神经元操控缺乏特异性和药理学方法对神经元操控缺乏时间准确性等方面的不足,将PD病理机制的研究逐渐深入到细胞及分子水平[27]。Kravitz 等[9]利用光遗传学手段蓝光激活纹状体中转染ChR2的D2-MSNs,诱导小鼠出现运动迟缓行为。Gradinaru等[28]利用黄光抑制间接通路中丘脑底核传入神经元的兴奋性,震颤等PD症状得到缓解。Dobbs等[29]用光遗传技术研究发现,纹状体相邻D1-MSNs 与D2-MSNs 之间还存在侧抑制效应,激活表达ChR2的D2-MSNs可对D1-MSNs产生抑制作用,参与直接/间接通路之间的信号调控。本研究对D2-Cre 小鼠纹状体转染抑制性光敏感蛋白病毒(rAAVEf1α-DIO- eNpHR3.0-EYFP-WPRE-pA),并采用589nm 黄光刺激抑制D2-MSNs 兴奋性,试图通过光遗传方法精准操控D2-MSNs 兴奋性,进一步揭示跑台运动改善PD 模型小鼠运动行为障碍的可能机制。当给予黄光刺激后,PD小鼠总运动距离与平均运动速度均明显增加,静止状态占比降低,快速移动占比增加;且上述结果与跑台运动干预对PD 小鼠自主活动行为影响的结果基本相似;提示纹状体D2-MSNs 可能在运动改善PD小鼠运动行为障碍中具有重要作用。
4 小结
PD小鼠出现明显自主活动障碍与纹状体DA水平减少,引起D2-MSNs兴奋性改变有关。4周跑台运动干预有效改善了PD模型小鼠自主活动障碍,这一结果与光遗传操控D2-MSNs 兴奋性对PD 小鼠自主活动行为的影响基本相似。这提示纹状体D2-MSNs可能是运动改善PD 小鼠运动行为障碍的重要细胞分子靶点。后续研究工作拟采用光遗传与全细胞膜片钳技术相结合的手段,精准识别并操控D2-MSNs胞体,观察跑台运动是否能够抑制PD小鼠纹状体D2-MSNs的兴奋性,从细胞水平进一步揭示D2-MSNs 在运动改善PD 小鼠运动行为障碍中的具体调控机制。
