帕金森病伴发睡眠障碍的脑结构形态学分析
2020-11-23李晓昶杨改清祁萌萌徐志强
李晓昶,杨改清,祁萌萌,徐志强
帕金森病(PD)是一种常见的神经退行性疾病[1]。随着年龄的增长,男性和女性的发病率都在上升,总体发病率为每10万人年17例[1]。PD病理特征表现为黑质多巴胺神经元变性,神经元内沉积了大量路易小体,进而导致多巴胺能投射通路障碍和多巴胺与乙酰胆碱两大递质系统失衡[2]。睡眠障碍严重影响了PD患者的日常生活[3]。目前PD患者与睡眠障碍相关的解剖学变化的研究较少。本研究的目的是评估PD患者的皮质和皮质下脑组织体积与睡眠障碍的联系。
1 对象与方法
1.1 对象 PD组选取2018年6月至2019年6月在郑州市中心医院就诊的PD患者30例,纳入标准:(1) PD总病程持续时间超过5年;(2)患者对左旋多巴的治疗有显著疗效; (3)排除精神疾病及口服精神类药物;(4)排除Alzheimer’s病患者及继发性帕金森综合征患者;(5)患有MRI禁忌证或语言无法交流的患者。另外选取30名年龄、性别与PD组匹配的对照者,纳入标准: 身体健康;无神经系统疾病。如果Freesurfer软件需要手动校正,则将患者排除在分析之外。研究设计和同意程序得到郑州大学附属郑州市中心医院伦理委员会的批准。所有患者在纳入研究之前都签署了知情同意书。
1.2 方法
1.2.1 PD运动功能评估 PD患者的严重程度使用统一PD评定量表(UPDRS)评估,该评分分为评估心理、行为和情绪的第一部分,评估日常生活活动的第二部分,评估运动功能的第三部分,评估治疗并发症的第四部分。本研究使用UPDRS的第三部分(UPDRSⅢ)评估“开启”和“关闭”药物状态期间的PD严重程度。
1.2.2 认知功能评估 所有入组者均接受MMSE检查。MMSE可筛查患者的全局认知功能,它专注于注意力和计算、回忆、语言、重复和复杂的命令。总MMSE评分范围0~30分,其中较高的分数意味着更好的认知功能。
1.2.3 PD睡眠质量评估 PD睡眠量表(PDSS)用于评估PD患者的睡眠问题[4]。 PDSS包括PD患者通常遇到的15个睡眠模拟量表问题。 这些问题旨在评估夜间睡眠(问题1),睡眠入睡和维持性失眠(问题2和3),夜间睡眠不安(问题4和5),夜间精神状态和幻觉(问题6和7),夜尿症(问题8),尿失禁(问题9),夜间运动症状(问题10~13),睡眠质量(问题14)和白天打瞌睡(问题15)[5]。 患者在视觉模拟评分频率和睡眠质量严重程度上表示令人不安的问题。 对所有项目的得分进行求和,得出总分从0(最严重的症状)到150(无症状)。 总PDSS评分低于82或任何得分低于5的项目表明显著的睡眠障碍。 所有完成PDSS的PD患者都包括在分析中。
1.2.4 MRI检查 所有扫描均使用3.0 T Siemens Avanto扫描仪获得。 成像方案包括整个脑的轴向T2W,T1W/mpr/p2/iso和矢状T2W/spcp2/iso序列,并使用以下参数:T2W:TR 4 740 ms;TE 104 ms;厚度2.0 mm;FoV 250(192×256);连接2,翻转角120°;T2W/spcp2/iso:TR 3 200 ms;TE 376 ms;厚度1.0 mm;FoV 260(256×256);串联1:T1W/mpr/p2/iso:TR 1 900 ms;TE 3.35 ms;厚度1.0 mm;FoV(192×256);连接1,翻转角15°。研究期间没有进行MRI扫描仪的硬件或软件升级。
1.2.5 图像处理和分析 使用FreeSurfer图像分析软件(v6.0,Harvard,MA,https://surfer.nmr.mgh.harvard.edu)进行基于自动体素的皮质下分割分析和皮质分割。 图像处理先前已有描述,并证明了不同MRI扫描仪的良好重测信度。 皮质分割每个半球提供34个皮质估计(基于Killiany/Desikan图谱)。皮质下分割提供46个区域体积。对于数据的进一步统计分析,使用由Freesurfer计算的皮质厚度和体积的实际值。
2 结 果
2.1 PD组与对照组基线资料的比较 见表1。两组年龄、性别、MMSE比较差异均无统计学意义。

表1 PD组及对照组的基线资料的比较[M(Q25~Q75),n=30]特征PD组对照组P值年龄(岁)57(54~65)55(50~66)0.18男性/女性(例)15/1515/150.79左旋多巴等效剂量(mg)600(400~725)--UPDRSⅢ (分)17(13~22)--MMSE (分)26(23~29) 29(27~30)0.15PDSS (分)81.7(63.8~106.3)--
2.2 PD患者睡眠质量评估及分组 根据总PDSS评分,14例(47%)PD患者没有睡眠障碍,为PDnSD组,平均总PDSS分数>81分;其余16例(53%)PD患者有睡眠问题,为PDSD组。对PDSS的详细分析显示,PDSD组中最常见的问题是入睡困难[32.9(4.12~57)分]和夜尿症[20(3.5~43.5)分]。 最严重的睡眠问题是幻觉[93(87~99)分]和尿失禁[88.9(42.7~98.3)分]。
2.3 PDSD组与PDnSD组临床资料比较 见表2。在年龄、性别、左旋多巴等效剂量及UPDRSⅢ、MMSE评分方面,PDSD组与PDnSD组比较差异均无统计学意义。

表2 PD组PDSD与PDnSD临床资料分析[M(Q25~Q75)]特征PDSD组(n=16)PDnSD组(n=14)P值年龄(岁)56(53~66)55(50~61)0.18男性/女性(例)7/96/80.79左旋多巴等效剂量(mg)600(400~725)600(400~725)0.67UPDRSⅢ (分)17(13~22)16(14~23)0.23MMSE (分)27(24~28)28(26~29)0.15
2.4 PD组与对照组脑形态特征的比较 见表3。经年龄、性别、MMSE、ICV调整后,PD组两侧扣带回后部及左侧中央前回皮质厚度较对照组减小,右侧侧脑室较对照组增大,两侧海马体积较对照组减小,两侧额极皮质表面积较对照组减少(均P<0.05)。
2.5 PDSD组与PDnSD组脑形态特征的比较 见表4。PDSD组左额中回后部、两侧扣带回后部、两侧中央前回及右侧颞叶内侧皮质厚度均较PDnSD组减小,两侧海马体积较PDnSD组减小,两侧额及皮质表面积较PDnSD组减少(均P<0.05)。

表3 PD组与对照组脑形态特征的比较(x±s,n=30)脑区PD组对照组单变量的P值调整过的P值皮质厚度(mm) 左额中回后部2.52±0.182.61±0.980.040.38 左侧扣带回后部2.37±0.162.48±0.170.020.01 左侧中央前回2.26±0.192.41±0.180.010.03 右侧扣带回后部2.33±0.162.48±0.170.020.01 右侧中央前回2.25±0.222.41±0.100.020.05 右侧颞叶内侧区2.81±0.142.92±0.090.020.07 右侧颞横回2.39±0.19 2.39±0.170.040.08大脑皮质下的结构(mm3) 左侧侧脑室74.47±30.4555.88±23.120.040.06 右侧侧脑室70.53±25.3656.76±23.410.030.04 左侧海马体积41.54±38.6045.16±44.000.010.01 右侧海马体积42.63±28.8048.41±49.180.030.01白质容积(mm3) 左侧顶叶9.23±0.1110.04±0.120.500.60 左侧额中回前部9.03±0.2310.01±0.120.600.50 右侧顶叶10.20±0.1310.35±0.230.700.70 右侧内嗅皮质8.42±0.238.56±0.130.700.80 右侧颞横回9.56±0.139.59±0.220.500.60 右侧岛叶9.42±0.199.56±0.230.700.70皮质表面积(mm2) 左侧额极22.20±2.7526.35±3.140.030.01 右侧额极26.53±2.4028.34±5.100.030.02
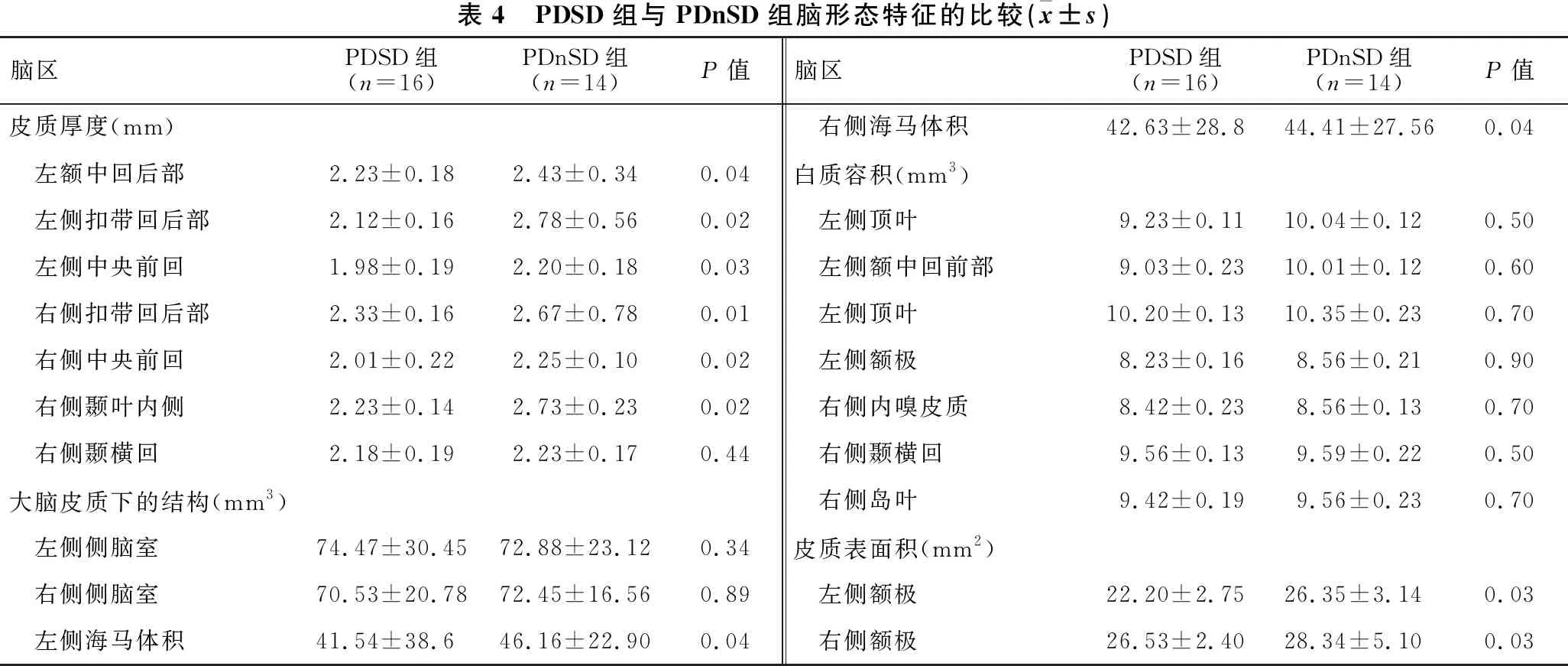
表4 PDSD组与PDnSD组脑形态特征的比较(x±s)脑区PDSD组(n=16)PDnSD组(n=14)P值脑区PDSD组(n=16)PDnSD组(n=14)P值皮质厚度(mm) 右侧海马体积42.63±28.844.41±27.560.04 左额中回后部2.23±0.182.43±0.340.04白质容积(mm3) 左侧扣带回后部2.12±0.162.78±0.560.02 左侧顶叶9.23±0.1110.04±0.120.50 左侧中央前回1.98±0.192.20±0.180.03 左侧额中回前部9.03±0.2310.01±0.120.60 右侧扣带回后部2.33±0.162.67±0.780.01 左侧顶叶10.20±0.1310.35±0.230.70 右侧中央前回2.01±0.222.25±0.100.02 左侧额极8.23±0.168.56±0.210.90 右侧颞叶内侧2.23±0.142.73±0.230.02 右侧内嗅皮质8.42±0.238.56±0.130.70 右侧颞横回2.18±0.19 2.23±0.170.44 右侧颞横回9.56±0.139.59±0.220.50大脑皮质下的结构(mm3) 右侧岛叶9.42±0.199.56±0.230.70 左侧侧脑室74.47±30.4572.88±23.120.34皮质表面积(mm2) 右侧侧脑室70.53±20.7872.45±16.560.89 左侧额极22.20±2.7526.35±3.140.03 左侧海马体积41.54±38.646.16±22.900.04 右侧额极26.53±2.4028.34±5.100.03
3 讨 论
PD患者常常出现睡眠障碍,主要包括夜间睡眠障碍[失眠、不宁腿综合征、周期性腿动、快速眼动睡眠行为障碍(RBD)、睡眠呼吸障碍]和日间睡眠障碍(日间过度嗜睡、睡眠发作)[6]。PD运动症状前期也可以出现睡眠障碍[7]。良好的睡眠质量对PD患者的身心健康至关重要。基于体素的形态测量学研究通常侧重于特定的睡眠障碍或综合征,睡眠障碍PD患者的整体性研究较少。与睡眠有关的解剖结构相当广泛, 包括上行网状结构、中缝核、孤束核、蓝斑核、丘脑网状核、下丘脑、额叶底部以及眶部皮质等[8]。额叶在认知过程、情绪调节、动机、社交能力等方面起着至关重要的作用,额叶功能障碍已经在各种神经系统和精神疾病中被发现,如抑郁症、焦虑症、Alzheimer’s病、PD和成瘾等[9]。扣带回参与了语义认知功能,而扣带回也是工程记忆存储和情节记忆再认的重要部位[10]。扣带回皮质和额束、海马协同作用,是执行记忆处理的认知任务相关要素。在评价人的快速眼球运动(REM)睡眠功能性神经解剖学的PET荟萃分析研究中发现,REM睡眠中楔前叶、后扣带回、顶叶皮质出现活动度下降;另一项研究利用PET扫描发现RBD在扣带回前部葡萄糖代谢降低。PDSD组与PDnSD组对比也发现了中央前回体积减小的现象,与睡眠障碍到运动功能恶化相一致。中央前回与各种强协调试验如记忆再认,注意力、程序记忆和睡眠有关,并于新纹状体相联。
本研究对PD组和对照组的脑功能活动进行了检测和比较,结果显示,在左额中回后部、左侧中央前回、右侧中央前回、右侧颞叶内侧区域,PDSD皮质厚度小于PDnSD组,提示这些区域可能在PD睡眠障碍的病理生理中起到关键作用。
虽然一系列的睡眠障碍主要与非多巴胺能缺陷有关,如抑郁、体质量指数改变和疲劳,但多巴胺能系统也被认为是PD非运动症状的关键因素,反映了该疾病的多系统性质。多巴胺导致多种非运动症状,包括睡眠障碍、神经内分泌问题和自主神经功能障碍[11]。睡眠障碍可以是运动功能恶化的危险因素,加重运动迟缓。既往研究表明,RBD影响多达45%~60%的PD患者,其特征是痛苦的梦,在床上移动很多,大喊大叫,在梦中与人打架[12]。本研究发现,PD组中53%的患者存在严重的睡眠障碍。PDSD组中最常见的抱怨是难以在入睡困难和夜尿症。最令人不安的睡眠问题是令人痛苦的幻觉和由于肢体僵硬症状引起的尿失禁。研究显示,夜尿症影响多达62%的PD患者,并对生活质量有着显著的不良影响[3,13]。小脑不仅与异动症等运动症状及认知功能损害等非运动症状的产生有关,可能在扣带回、额叶、基底节区的神经网络均有关,可能代偿基底节区的多巴胺损害。
睡眠障碍患者静息态MRI发现局部脑活动在双侧丘脑、躯体运动及运动相关的脑区升高。利用静息态MRI功能连接的方法研究睡眠障碍患者大脑内神经网络的变化,发现右侧后扣带回及内侧前额叶皮质、左侧颞叶内侧的功能连接受损。研究表明,抱怨噩梦的PD患者的壳核累积量减少可能作为即将到来的认知能力下降的可能标志[14]。有研究表明,扣带回参与了PD噩梦的生成,这一研究结果支持了Levin Nielsen在2007年的理论,该理论认为前扣带回是梦魇的核心,但是小脑的参与表明小脑可能是痛苦梦想的产生者[15-16]。
本研究的主要局限是本次研究的样本量较小,考虑到招募大量这些患者进行研究困难,样本量与PD RBD睡眠障碍其他影像学中的研究样本量相似。本研究小组注意到其他睡眠障碍,如阻塞性睡眠暂停、不宁腿综合征已经显示与T1加权MRI扫描测量的体积变化有关,但最近的研究未暗示与PD海马或额中叶的体积变化有关。
综上所述,PD睡眠障碍可能与认知及躯体运动相关脑区(左侧额中回后部、中央前回,右侧颞叶内侧区)体积减小有关,PD认知及运动障碍与睡眠障碍有一定解剖联系。
