SSZ-13分子筛选择性吸附分离CO2与CH4
2020-11-21冯佳伟胡云峰
冯佳伟,胡云峰
(东北石油大学 化学化工学院,黑龙江 大庆 163000)
CH4是21世纪的清洁能源,在当今能源结构中占比日益增多。随着人们消耗能源总量的增加,对含有甲烷的天然气和沼气的需求量越来越大。但是天然气和沼气的主要成分是CH4,体积分数为55%~65%,其次是CO2,体积分数为30%~40%[1]。过多的CO2不仅影响沼气的燃烧效果,导致单位能量的运输和储存成本提高,而且会腐蚀运输CH4的管路,严重影响沼气工程的工业发展[2]。另一方面,CO2作为一种“潜在碳资源”,被合理的利用,也是急需解决的问题之一。而在可用于CO2/CH4分离的不同可循环方法中,使用醇胺溶液洗涤是工业上捕获和储存CO2最常用的技术[3]。但是胺洗涤存在设备腐蚀、溶剂损失、由热引起的胺降解、具有毒性以及由于与CO2结合太强而导致的再生能量需求高等缺点,无法高效回收CH4中的CO2[4]。
从混合气中回收CH4和CO2的吸附法逐渐成为研究热点。Cavenati S等利用13X分子筛研究了CH4/N2/CO2混合气在真空变压吸附(VPSA)中的吸附能力[5];Aguilar-Armenta G等研究了CO2/N2和CH4在天然斜发沸石上的动力学特性[6];Vaduva M等进行了采用碳分子筛(CMS)从CH4/N2/CO2混合气中分离CO2的实验[7];Bae Y S等研究了CH4/CO2在新型吸附剂金属有机骨架化合物(MOFs)中的分离特性[8]。Carlos A Grande等分别考察了13X分子筛,4A型分子筛以及活性炭3种吸附剂的CH4/CO2吸附特性[9]。
SSZ-13分子筛是一种新型吸附剂,与硅铝系菱沸石(Chabazite)同属一系,具有CHA拓扑结构的小孔分子筛,孔道尺寸为0.38 nm×0.38 nm,硅铝比远高于Chabazite[6]。SSZ-13分子筛以硅氧四面体(SiO4)和铝氧四面体(AlO4)作为骨架基础,通过氧原子为桥梁首尾相接而有序排列,形成具有八元环孔道和三维交叉孔道的晶体结构(见图1)。

图1 SSZ-13分子筛结构示意图
SSZ-13分子筛的结构单元是2个六元环和1个大的椭圆形孔道(0.73 nm×1.2 nm),由八元环孔道(自由孔径约0.38 nm)进入[10]。在SSZ-13的晶体结构中,每个晶胞单元有12个T原子(T=Si,Al),但是不对称的单元中只有1个T原子[9]。碱金属阳离子在SSZ-13中可以位于3种不同的位点,在六元环孔道中心(位点SⅡ,绿色圆球,每个晶胞中有2个位点);在八元环中,接近四元环的顶角(位点SⅢ,红色圆球,每个晶胞中有4个位点);或者接近八元环的中心(位点SⅢ’,紫色圆球,每个晶胞中有2个位点)[11]。Cheemtham和同事们研究了菱沸石中碱金属阳离子的位置,发现K+优先位于SⅢ’位点;Li+相比于SⅢ,优先位于SⅡ位点;Na+位于SⅡ和SⅢ 2个位点[12]。利用从头周期计算法,Ugliengo和同事们报告了在Na-CHA[n(Si)∶n(Al)=11]中SⅡ位比SⅢ位更稳定[13]。
SSZ-13分子筛的结构特点使其具有了较高的水热稳定性、离子交换性、酸性可调性、高吸附选择性等特性[14],因此被广泛应用于吸附分离领域,如CO2/N2、CO2/CH4、CH4/N2等气体混合物的分离等。
作者使用N,N,N-三甲基金刚烷基氢氧化铵(TMAdaOH)为模板剂,NaOH、SiO2、Al(OH)3为原料,以水热合成法合成SSZ-13分子筛。通过XRD、红外光谱(FTIR)等对晶体结构进行表征。并且测试了SSZ-13分子筛对于CO2/CH4的吸附分离性能。
1 实验部分
1.1 试剂与仪器
TMAdaOH:纯度≥99%,上海博栋化学科技有限公司;气相SiO2(比表面积150 m2/g)、氢氧化钠、氢氧化铝、硝酸铵、硝酸锂、硝酸钾:均为分析纯,上海阿拉丁生化科技股份有限公司。
高压气体吸附仪:3H-2000PH,贝士德仪器科技(北京)有限公司;气相色谱仪:GC-8890A,辽宁东科分析仪器有限公司;质量流量计:D07-7CM,北京七星华创流量计有限公司;傅里叶变换红外光谱仪:IRspirit,日本岛津公司;X射线衍射仪:DMAX-2000,丹东通达科技有限公司。
1.2 Na-SSZ-13的合成
向反应釜中分别加入NaOH、TMAdaOH、去离子水和氢氧化铝,磁力搅拌30 min。然后加入气相SiO2,将上述混合物在室温下搅拌,得到含有m(TMAdaOH)∶m(Na2O)∶m(Al2O3)∶m(SiO2)∶m(H2O)=10∶10∶3∶100∶4 400的均匀凝胶,放入静态晶化箱,160 ℃下晶化96 h。反应结束后将产物抽滤、洗涤、100 ℃干燥12 h。最后将产物在550 ℃下程序升温在空气中焙烧10 h,除去晶体中的水和模板剂,即可得到SSZ-13分子筛。
1.3 结构表征
在X-ray粉末衍射仪上,用Cu Kα源(λ=0.154 18 nm)在2θ=5.0°~55.0°采集了X射线粉末衍射(XRD)图谱,步长为0.02°和1.7 s。将SSZ-13样品与硅标准样品混合以校正峰位置,然后根据不同角度的峰位置确定样品晶体结构。
在光谱仪上记录了傅里叶变换红外光谱(FTIR)数据。通过将分子筛粉末与溴化钾颗粒研磨压在一起,形成部分FTIR透明自支撑颗粒,从而制得样品。
1.4 离子交换
在70 ℃下,将Na-SSZ-13与NH4NO3溶液混合搅拌,进行离子交换,制备NH4-SSZ-13。然后将产物抽滤并用去离子水洗涤,将得到的NH4-SSZ-13产品在100 ℃下干燥12 h。将NH4-SSZ-13分别和LiNO3、NaNO3、KNO3混合,水浴加热至80 ℃,搅拌4 h,制备离子交换后的Li-SSZ-13、Na-SSZ-13和K-SSZ-13,所得阳离子交换后的SSZ-13产品在100 ℃下干燥12 h。重复2次离子交换得到完全的碱金属离子交换形式的SSZ-13。将NH4-SSZ-13在空气中焙烧4 h以得到H-SSZ-13。
1.5 吸附分离性能测定
等温吸附线测定:取1 g样品,使用高压吸附仪测定温度为298 K时p=(5~1 000)kPa下的吸附量,以吸附量为纵坐标,p为横坐标绘制吸附等温线。
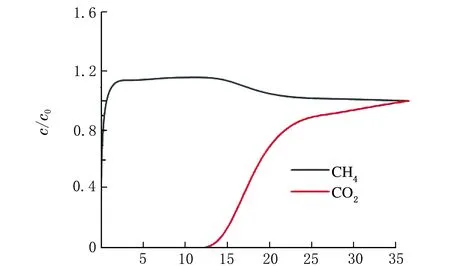
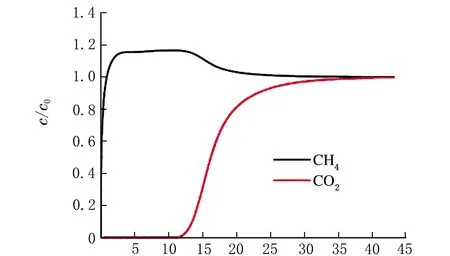
穿透曲线测定:常温常压下,取1 g样品,通入m(CH4)∶m(CO2)=85∶15混合气,使用气相色谱检测器,记录时间t以及CH4和CO2的出口浓度c。以t为横坐标,c/c0为纵坐标,绘制穿透曲线。
2 结果与讨论
2.1 结构表征
对以水热合成法合成的产物Na-SSZ-13以及离子交换后的H-SSZ-13、Li-SSZ-13、K-SSZ-13分子筛进行XRD表征,结果见图2。

2θ/(°)图2 4种SSZ-13分子筛的XRD图
将Na-SSZ-13谱图与Chabazite XRD谱图标准卡片PDF#53-1177进行对比可知,样品特征峰与标准谱图完全吻合,说明样品为纯相SSZ-13,且结晶良好。K-SSZ-13、Li-SSZ-13、H-SSZ-13的XRD谱图与Na-SSZ-13对比发现,不同离子交换后,晶体结构与结晶度没有明显变化,所有样品均为Chabazite结构。
4种样品的傅里叶红外光谱图见图3。
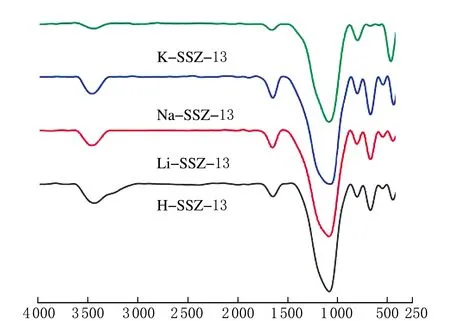
σ/cm-1图3 4种SSZ-13分子筛的FTIR图
由图3可知,4种样品特征峰的分布情况基本一致,3 460及1 700 cm-1为晶格水及羟基的振动峰,1 000~1 300 cm-1为Si—O—Si或Al—O—Al不对称伸缩振动峰,约800 cm-1的峰为Si—O—Si对称伸缩振动峰,约640 cm-1的峰为双六元环的振动峰,530 cm-1为Al—O的弯曲振动峰,约450 cm-1的峰为Si—O的弯曲振动峰[14]。这些振动峰的存在均说明样品具有Chabazite骨架结构,与XRD表征结果一致。
2.2 吸附分离能力测试
2.2.1 吸附等温线
CO2和CH4气体物理参数见表1。
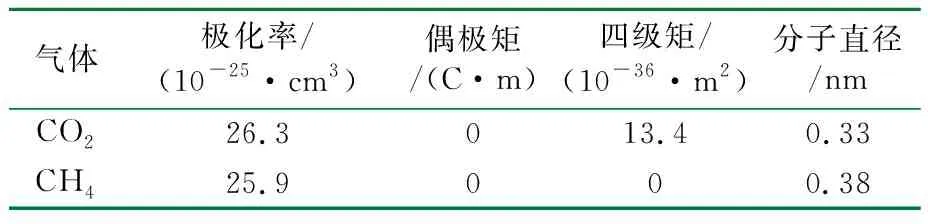
表1 CO2和CH4气体物理参数
由表1可知,CO2和CH4的动力学直径分别为0.33 nm和0.38 nm,小于SSZ-13(0.38 nm×0.38 nm)的孔径,使得这些吸附质可以在分子筛中自由扩散[15]。但CO2和CH4的分子性质有很大的差异。除其尺寸和几何形状外,CO2具有更大的极化率和四极矩[16],从而使CO2分子与沸石骨架发生更强的电子相互作用。因此,CO2与沸石骨架的相互作用能远高于CH4,从而拥有远高于CH4的吸附量。
测定纯气体吸附等温线,以评价不同电荷补偿阳离子的SSZ-13分子筛的CO2/CH4分离能力。298 K和100 kPa条件下,CO2和CH4在4种SSZ-13分子筛上的吸附等温线见图4。所有的等温线均用Langmuir模型拟合,拟合参数见表2和表3。

p/kPaa SSZ-13分子筛对CO2的吸附等温线

p/kPab SSZ-13分子筛对CH4的吸附等温线图4 4种SSZ-13分子筛对CO2和CH4的吸附等温线
表2 Langmuir模型拟合CO2单组分气体在SSZ-13分子筛上的吸附等温线
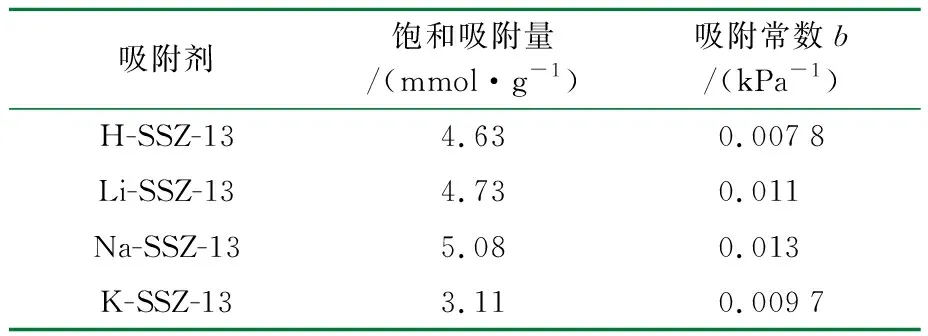
吸附剂饱和吸附量/(mmol·g-1)吸附常数b/(kPa-1)H-SSZ-134.630.0078Li-SSZ-134.730.011Na-SSZ-135.080.013K-SSZ-133.110.0097
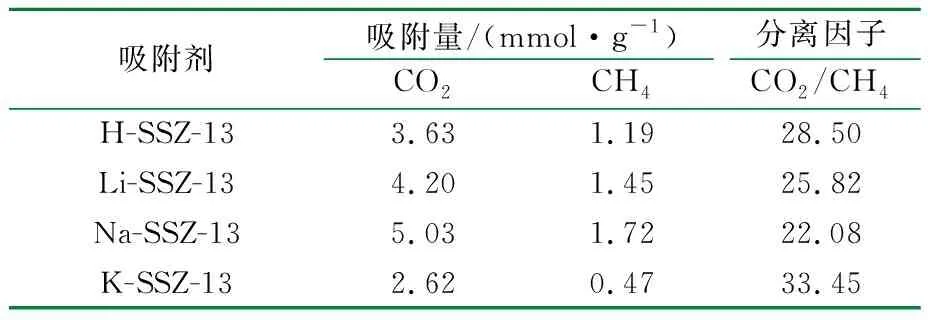
吸附测试表明,CO2和CH4的吸附量遵循Na-SSZ-13>Li-SSZ-13>H-SSZ-13>K-SSZ-13的顺序。一般情况下,吸附等温线的变化趋势明显取决于分子筛中电场的强度[16]。阳离子的极化率与第ⅠA族元素的电荷密度或离子半径成反比[17]。沸石中阳离子的电场大小顺序[18]为H+ 2.2.2 理性吸附溶液理论(IAST)预测吸附选择性 IAST是仅用纯组分吸附等温线预测多组分吸附平衡最可靠的理论之一[22],并已用于预测许多沸石中的混合气体吸附。利用IAST预测温度为298 K时吸附等温线的CO2/CH4的分离选择性,并应用Langmuir模型拟合的等温线进行计算。 IAST方法计算的SSZ-13分子筛对CO2/CH4的吸附选择性见表4。 表4 IAST法计算SSZ-13对CO2/CH4的理想选择性 由表4可知,K-SSZ-13的吸附选择性远远高于其他分子筛。这是由于K+具有较大的阳离子半径(见表5),K+在八元环窗口中的位置将有效地阻止CO2和CH4进入SSZ-13笼中[23],进而阻碍了K-SSZ-13对2种气体的吸附。与CO2相比,极性较小且半径更大的CH4气体难以进入笼中[24],导致K-SSZ-13具有比其他分子筛更高的吸附选择性。 表5 阳离子半径数据 2.2.3 穿透曲线 吸附气体分离的实际过程通常是在动态条件下进行的,基于热力学平衡测试[25]的吸附等温线不足以评估工业应用的吸附剂潜力,而穿透曲线实验更准确地描述了吸附分离过程[26]。因此,根据穿透曲线研究了填料床分离CO2/CH4的动力学行为,以确定吸附剂在分离过程中的可行性[27]。在298 K和100 kPa下m(CO2)∶m(CH4)=15∶85混合物在SSZ-13分子筛上的穿透曲线见图5。 t/mina H-SSZ-13 t/minb Li-SSZ-13 t/minc Na-SSZ-13 t/mind K-SSZ-13图5 CO2/CH4气体混合物在不同阳离子的SSZ-13样品上的穿透曲线 由图5可知,与平衡等温线一致,SSZ-13在混合气体中对CO2具有较高的选择性。所有分子筛的穿透时间都有很大的差异。由穿透曲线推断了动态吸附过程,弱吸附组分(CH4)首先穿透吸附床,因为CO2被强吸附,因此出口浓度前沿移动较慢,在穿透曲线中后穿出;CH4的吸附强度高于投料至吸附床的强度,这是CO2竞争吸附的结果。最后,吸附床完全饱和,出水的强度与进料气体的强度相等。 根据混合气体在4种吸附剂上的穿透点和流干点,分别计算了4种吸附剂对于混合气体中2种组分的吸附量,结果见表6。 表6 SSZ-13分子筛的吸附性能 由表6可知,吸附量的顺序与吸附等温线的结果一致。Na-SSZ-13具有最高的吸附量,K-SSZ-13具有最好的吸附选择性。根据分离因子,判断SSZ-13分子筛的吸附选择性。4种分子筛对于CO2/CH4气体混合物的分离情况与IAST预测结果相一致。实验表明,K-SSZ-13以牺牲吸附量为前提,大大提高了对CO2气体的选择性,是一种分离CO2/CH4混合气体的有效吸附剂。这些结果将有助于从成本和应用角度优化合成SSZ-13分子筛,并根据特定的气体分离目标选择合适的沸石吸附剂。 (1)以TMAdaOH为模板剂,合成Na-SSZ-13分子筛;用硝酸铵、硝酸锂、硝酸钾对样品进行离子交换;通过XRD和FTIR对样品结构进行表征,确定合成产物为目标产物,且进行离子交换后的分子筛结构并未发生改变; (2)吸附等温线结果表明,CO2在所有样品上的吸附量都优于CH4,CO2和CH4的吸附量遵循Na-SSZ-13>Li-SSZ-13>H-SSZ-13>K-SSZ-13的顺序,Na-SSZ-13的吸附量最高,选择性最低,这是因为Na+的电场较高以及在分子筛结构中的占位问题。由于分子陷门效应,K-SSZ-13虽然吸附量不高,但拥有极好的吸附选择性; (3)穿透曲线结果表明,CH4属于弱吸附质,在穿透曲线中优先穿出,而CO2属于强吸附质,后穿出;4种样品分子筛对CO2和CH4混合气体的吸附量顺序与吸附等温线结果一致,Na-SSZ-13的吸附量最高,分离因子最低,而K-SSZ-13具有较高的分离因子。

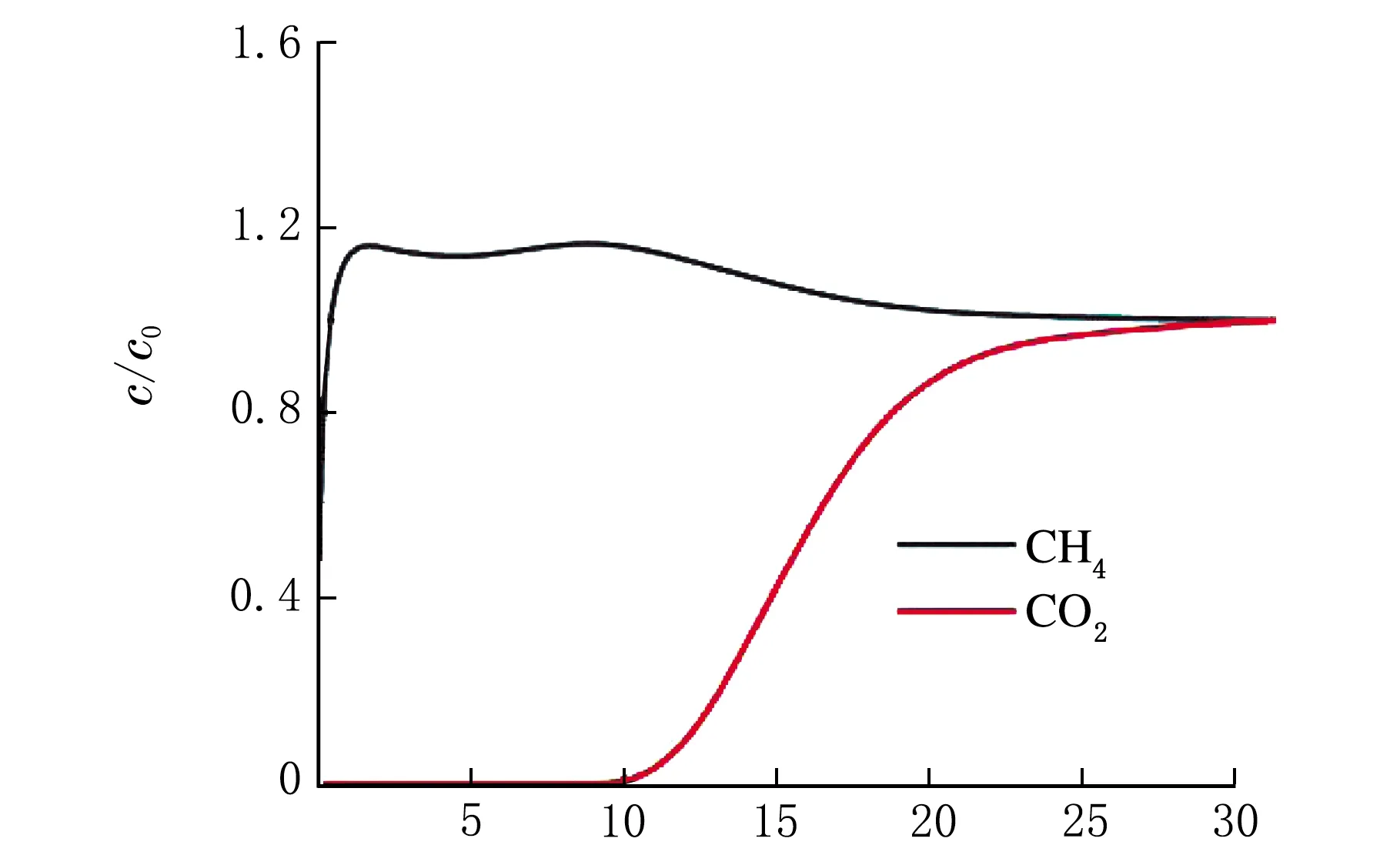

3 结 论
