稀土Tb3+掺杂CoAl2O4钴蓝色料的晶体结构与光学性能的研究
2020-11-20彭小晋金娜
彭小晋 金娜

摘 要:本文采用溶胶凝胶法制备了一系列稀土Tb3+掺杂的CoAl2O4钴蓝色料,并揭示了Tb3+对CoAl2O4色料的晶体结构和光学性质的影响规律。采用TG-DSC、XRD、UV-vis和FT-IR等手段研究了Tb-CoAl2O4色料前驱物的热失重特性,并从微观上分析了Tb-CoAl2O4色料的晶体结构与光学特性之间的关系,初步探讨了Tb-CoAl2O4色料的呈色机理。结论表明:当Tb3+/ Co2+ ≤ 1.5%时,Tb-CoAl2O4色料主晶相为CoAl2O4尖晶石,四配位的Co2+为发色离子,色料呈现深蓝色;当Tb3+/Co2+ ≥ 2%时,CoAl2O4晶相减少,黑色的Co3O4、CoO等逐渐增加,成为主晶相,所以Tb- CoAl2O4色料整体表现为黑色。
关键词:稀土Tb3+掺杂;CoAl2O4色料;晶体结构;光学特性
1 序 言
在无机材料的大家族中,有一类以尖晶石构型(AB2O4)为主要特征的无机氧化物材料备受关注。这类材料普遍具有优异的热稳定性、化学稳定性、催化特性和光学特性等性能,一直以来都是科学研究和工业应用的热点。蓝色的无机颜料铝酸钴(CoAl2O4),就是其中一种典型的尖晶石型氧化物,被广泛用作陶瓷行业的着色剂。CoAl2O4晶体结构中,Co2+占据O2-形成的四面体空隙,形成[CoO4]四面体构型,Al3+则占据O2-形成的八面体空隙,形成[AlO6]八面体构型,这种结构称之为正尖晶石结构,反之则为反尖晶石结构。当然,一般的CoAl2O4尖晶石都是由正、反尖晶石相组成。从发色机理[1]来看,CoAl2O4尖晶石的发色主要取决于Co2+的配位状态,不同配位场状态下Co2+的3d轨道的分裂情况不同,电子在不同d轨道之间发生跃迁产生光波吸收,吸收光互补色即为色料呈现的颜色。当往CoAl2O4尖晶石结构中掺杂其他金属离子时,不同金属离子半径的差异,会导致Co2+的配位状态和CoAl2O4尖晶石构型发生变化,直接影响色料呈色。所以,通过掺杂其他金属离子来调整CoAl2O4着色剂的发色是一种有效手段。
稀土元素被材料行业尊称为“新材料宝库”,具有独特的光学、电学、热学和磁学性能,被广泛应用于材料的掺杂和改性。不少文献曾报道了利用稀土离子掺杂改性,来实现对尖晶石型物质的光学性能的调控:Fernández-Osorio等人[2]采用共沉淀法制备了一系列Eu3+掺杂ZnAl2O4 纳米晶体,实验结果表明Eu3+掺杂ZnAl2O4有望成为新一代耐高温陶瓷颜料;Radhika 等人[3]通过将稀土离子Ce-Nd共掺杂到CoAl2O4尖晶石中,制备出冷色调的CoAl2O4颜料,其近红外反射性能提高约10%;Tong等人[4]制备了高分散Re3+掺杂的CoAl2O4色料,论证了Re3+取代Al3+有助于改善钴蓝色料的发色。虽然稀土离子在尖晶石结构物质的光学性能调控方面应用广泛,但关于稀土Tb3+掺杂CoAl2O4尖晶石的研究还未见报道。基于此,本研究采用溶胶凝胶法制备出不同Tb3+掺量的CoAl2O4尖晶石,探明和揭示了稀土离子Tb3+掺杂对于CoAl2O4尖晶石的晶体结构与光学特性之间的关系。
2 实 验
2.1 实验原材料及样品制备
本实验所用的化学试剂均为分析纯:水合乙酸铽(III) (Tb(CH3COO)3·H2O,99.99%) 、硝酸鈷 (Co(NO3)2·6H2O,99%)、硝酸铝 (Al(NO3)3·9H2O,99%)、柠檬酸和乙醇等,所有试剂均由上海国药化学试剂厂提供。
实验样品过程如下:首先,称取0.03mol的Co(NO3)2·6H2O和0.06mol的Al(NO3)3·9H2O溶解于100ml蒸馏水中,在60℃水浴锅中搅拌0.5h直至混合均匀;其次,称取x mol (设定x/0.03=0、0.5%、1%、1.5%、2%、3%、4%、5%和6%,如表1所示)的Tb(CH3COO)3·H2O溶解于100ml乙醇溶液中,常温下搅拌至完全溶解;随后,将Tb3+/乙醇溶液逐滴加入到Co2+-Al3+/蒸馏水溶液中,水浴升温至80℃,边滴加边搅拌持续4h直至反应完全。随着反应进行,紫红色的反应液逐渐变粘稠,待反应结束后,将凝胶状的紫红色产物在自然条件下冷却,陈化24h后转移至马弗炉中,300℃条件下保温6h制备反应前驱物;最后,将该前驱物在玛瑙研钵中磨细,在1260℃温度条件下煅烧6h,最终得到稀土掺杂Tb-CoAl2O4尖晶石色料样品。根据Tb3+掺杂量的不同,所得最终产物编号分别记为T1、T2… … T9。
2.2 实验表征
采用NETZSCH公司DSC404F3型差热分析仪来表征前驱物样品的热失重效应,测温范围为RT~1380℃,升温速率为10℃/min,参比物为α-氧化铝粉末。样品晶相结构主要由XRD (D/MAX-UItimaIV, Rigaku)表征,实验条件为Cu Kα 辐射 (λ = 0.15405 μm) 、40 KV 、40 mA、2θ = 10°~70°。样品的光学特性主要由Lambda 750 S(美国Perkin Elmer)型紫外/可见/近红外分光光度计和Nexus型(Thermo Nicolet)傅立叶变换智能红外光谱仪来表征。
3 实验结果与讨论
3.1 CoAl2O4的呈色机理
CoAl2O4尖晶石呈色主要依赖于过渡金属Co2+,结构中Al3+和O2-离子对发色均无贡献。根据晶体场理论[1],所有过渡金属都存在未完全填满的d电子层,如果过渡金属离子周围不存在其他配位体场,则电子可以随机地占据dxy、dyz、dxz、dz2和dx2-y2五重简并轨道中任意一个;如果存在其他配位场,则d轨道会发生能级分裂,即五重轨道不再是等同状态,称之为简并的解除(如图1)。对于CoAl2O4尖晶石结构,当Co2+以[CoO4]四面体形式存在时,配位电子对将沿XY、YZ、XZ方向逼近d轨道,将dxy、dyz、dxz轨道能级推高;而当Co2+以[CoO6]八面体形式存在时,配位电子对则沿X、Y、Z轴方向逼近d轨道,则将dx2-y2、dz2轨道能级推高。由于Co2+在不同的配位场下3d轨道的分裂显著不同,电子在不同的d轨道之间发生跃迁,产生不同波段的光波吸收,吸收光的互补色即为色料的颜色。也就是说,当Co2+处于四配位(正尖晶石结构)时,色料呈蓝色;Co2+处于六配位(反尖晶石结构)时,色料不呈蓝色,或为紫红色。
3.2 稀土掺杂Tb-CoAl2O4前驱物热重分析
为了探究Tb3+掺杂对于CoAl2O4尖晶石形成过程中的热重效应的影响,选取编号为T1、T2、T3、T4、T6和T8的六组试样前驱物分别进行TG-DSC分析,结果如图2所示。随着反应温度升高,所有试样的热效应均表现出类似规律:在~75℃和~150℃附近出现两处吸热峰,质量损失约~10%左右,这主要是由前驱物中结构水的脱除,以及残留的硝酸根、醋酸根的受热分解所致[5]。在350℃~550℃范围内,CoAl2O4尖晶石形成,所有样品均出现明显的放热峰,试样质量损失也逐渐变大,这可能是前驱物中有机官能团燃烧产生的热效应所致[6]。继续升温,样品TG和DSC曲线都趋于平稳状态,说明整个反应过程基本完成。针对于350℃~550℃温度范围内,随着Tb3+掺杂含量的增加,放热峰峰位往高温方向偏移的现象,可能的解释是:由于Tb3+(0.092nm)和Co2+(0.075nm)、Al3+(0.0535nm)的离子半径相差太大,在CoAl2O4晶体形成过程中,半径过大的Tb3+进入晶格间隙中,促使CoAl2O4晶胞发生变形而阻碍Co2+和Al3+的迁移,所以需要更多能量来形成CoAl2O4尖晶石,宏观表现则为放热峰往高温方向移动。
3.3稀土掺杂Tb-CoAl2O4色料晶相分析
由于稀土离子掺杂量不同,Tb-CoAl2O4尖晶石的析晶行为也必定存在差异。为了弄清其规律,研究选取样品(T1、T2、T3、T4、T6和T8)进行XRD测试,结果如图3所示。T1为CoAl2O4空白对照样品,其衍射峰与CoAl2O4尖晶石(JCPDS card NO.: 03-0896)完全一致,说明未掺杂的CoAl2O4钴蓝色料的主晶相为CoAl2O4尖晶石。随着Tb3+掺杂量的提高,T2至T8所有样品CoAl2O4尖晶石的特征峰(3 1 1)峰强度逐渐减小,位于2θ = 48.907°附近的II峰甚至在Tb3+掺杂浓度高于1.5%后消失,这说明Tb3+对CoAl2O4尖晶石的形成具有抑制作用。当Tb3+/Co2+ ≤ 1%时,Tb3+对于CoAl2O4尖晶石的抑制作用比较小;当Tb3+/Co2+ ≥ 1.5%时,CoAl2O4尖晶石的衍射峰强度明显减小,这时抑制作用比较明显。同时还发现,随着Tb3+含量提高,体系中还出现了许多杂质晶相,比如Co3O4、CoO,甚至微量Co单质,如图3中T8结果所示。究其原因,可能是以下两点:a、Tb3+的离子半径过大,阻止了晶体结构中Co2+和Al3+的自由移动,CoAl2O4尖晶石的晶体形成速度变慢,量也随之减少;b、由反应原材料引入过多的有机阴离子,如醋酸根离子、硝酸根离子,还有有机物柠檬酸等,这些残留物质在高温下提供还原气氛,使得Co2O3发生氧化还原反应,生成Co3O4和CoO、Co单质等。另外,由于XRD结果中始终无法找到与Tb3+相关的晶相,所以暂不确定是XRD仪器测试误差还是Jade软件卡片库不全导致,有待后续深入研究。
晶体的平均晶粒尺寸(Dhkl)可由徳拜-谢乐公式(Debye-Scherrer formular)计算,具体公式如下:
其中,β为样品衍射峰半高宽度;K为Scherrer常数,在β为衍射峰半高宽时K = 0.9;λ为Cu靶的Kα射线的波长,约为1.5406 A;θ为布拉格衍射角。将样品T1-T9的晶粒尺寸计算数据统计如表2所示,所有样品的晶粒尺寸数据为10nm~30 nm,相对分布均匀。这是因为在液相反应体系中引入柠檬酸螯合剂,柠檬酸分子的有机基团附着在CoAl2O4纳米晶种表面,对晶粒的生长起到修饰作用,维持了晶粒尺寸的统一性[7]。
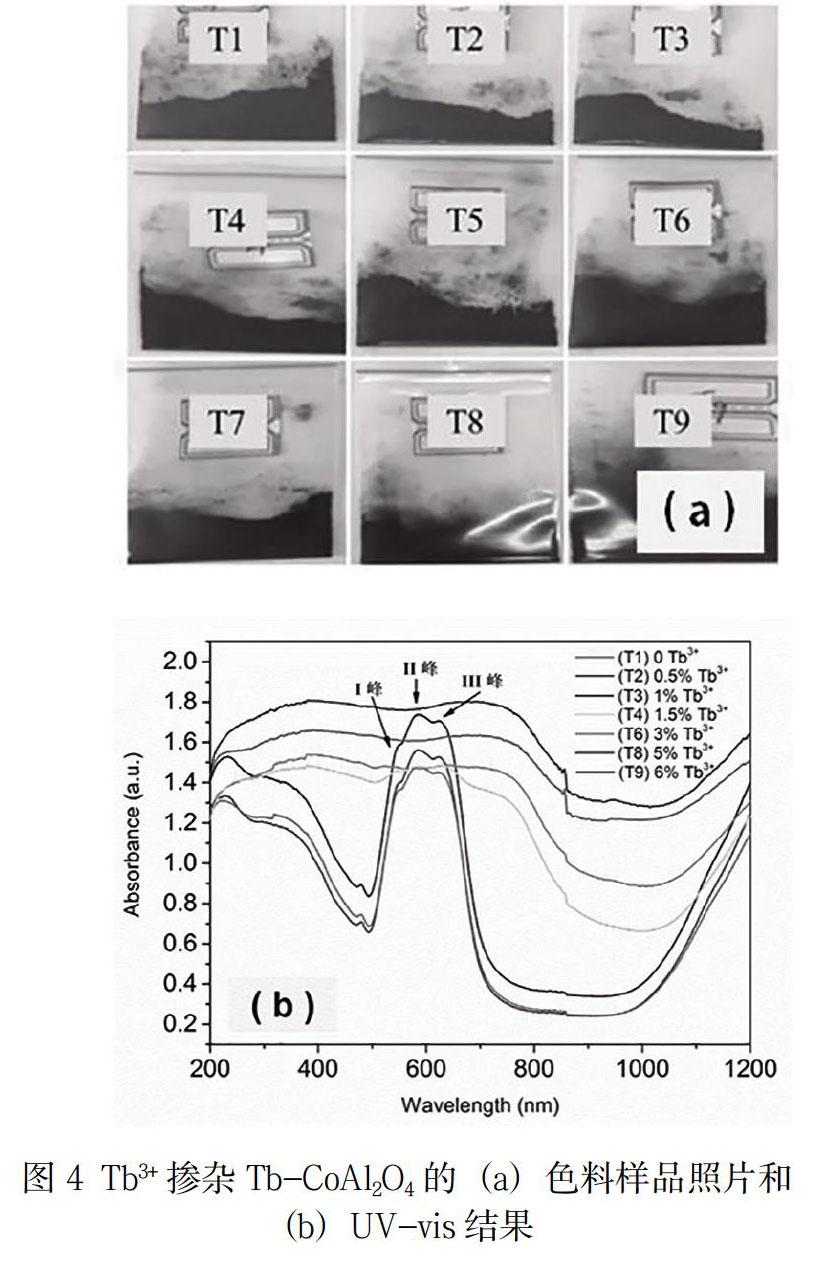
3.4稀土掺杂Tb-CoAl2O4色料呈色分析
图4(a)是Tb3+掺杂CoAl2O4尖晶石色料的照片,很容易发现当Tb3+/Co2+ ≤ 1%时,色料呈现出深蓝色调;当Tb3+/Co2+ ≥ 1.5%时,色料全部表现为黑色,这说明Tb3+掺杂多少对于CoAl2O4尖晶石的呈色影响很大。为了弄清其原因,挑选样品T1、T2、T3、T4、T6、T8和T9测试UV-vis光谱,结果如图3(b)所示。当Tb3+/Co2+ ≤ 1 %时,T1-T3样品都表现出相同的吸收规律,即在可见光(400nm~780nm)范围内出现一个明显的三重吸收峰,峰位分别为I峰:~553nm、II峰:~581nm和III峰:~622nm。这是因为,CoAl2O4尖晶石结构中,发色离子Co2+的第三种自旋容许跃迁V3: 4A2(F)→4T1(P)发生在可见光波范围内,且引起三次能量吸收[8],分别表现为图3(b)中光谱吸收带上的三重吸收峰。对于CoAl2O4尖晶石来说,位于[CoO4]四面体中心的Co2+对色料发色起决定性作用,即四配位的Co2+发生V3跃迁所需能量由不同颜色的光吸收提供,色料则呈现被吸收光的互补色,主要表现为蓝色。结合XRD分析结果, T1-T3主晶相为CoAl2O4尖晶石,所以色料呈现蓝色;T4-T9主晶相变为Co3O4,在可见光范围内没有Co2+的第三种自旋容许跃迁,所以不存在能量吸收,即色料显示本色黑色。
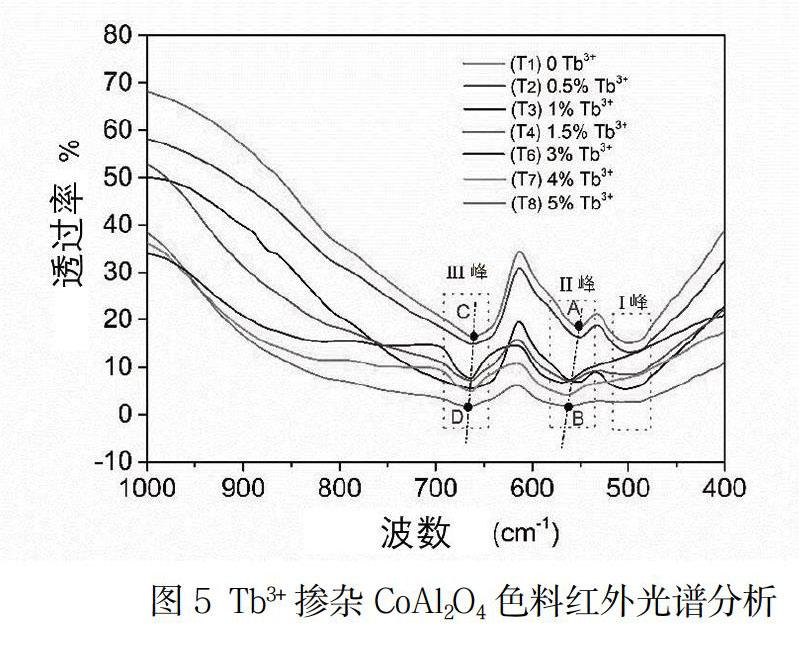
3.5 稀土掺杂Tb-CoAl2O4色料红外光谱分析
将编号为T1、T2、T3、T4、T6、T7和T8的七组Tb-CoAl2O4样品进行红外光谱测试,结果如图5所示。在500cm-1~700 cm-1頻率范围内,所有样品都表现出三重红外吸收峰,分别位于I峰~509 cm-1、II峰~556 cm-1和III峰~688 cm-1附近。I峰处的红外吸收主要是由四配位或者六配位状态的Co-O键振动引起;而六配位的Al-O和Tb-O键则主要引起高频率范围内II峰和III峰的红外吸收[9~11]。本实验中,Co2+优先占据四面体空隙,Al3+和Tb3+则优先占据八面体空隙,红外吸收特征明显。随着Tb3+掺杂量的增加,所有样品的三种红外吸收峰强度都逐渐减弱,说明呈四配位状态的Co-O键和六配位状态的Al-O键都在逐渐减少,即体系中正尖晶石的含量在减少,这与样品的晶相分析结果相吻合。
4 實验结论
本文通过溶胶凝胶法制备了一系列稀土离子Tb3+掺杂Tb-CoAl2O4尖晶石色料,揭示了Tb3+掺杂对Tb-CoAl2O4尖晶石的晶体特性和色料呈色之间的影响规律。当Tb3+/Co2+ ≤ 1%时,Tb-CoAl2O4体系以CoAl2O4正尖晶石为主,色料整体呈现深蓝色;当Tb3+/Co2+ ≥ 1.5%时,体系以黑色Co3O4晶相为主,CoAl2O4晶相逐渐减少,Tb-CoAl2O4色料整体呈现黑色。其中可能的原因是:Tb3+离子半径过大,阻碍体系中Co2+和Al3+的自由移动,导致CoAl2O4正尖晶石的含量逐渐减少;同时,反应体系中残留的有机物在高温下提供还原气氛,使Co2O3发生氧化还原反应,生成黑色的Co3O4、CoO等晶相。
参考文献
[1] Nassau K . The fifteen causes of color: The physics and chemistry of color [J]. Color Research & Application, 1987, 12(1):4-26.
[2] Fernández-Osorio A, Rivera C E , Vázquez-Olmos A, et al. Luminescent ceramic nano-pigments based on terbium-doped zinc aluminate: Synthesis, properties and performance [J]. Dyes and Pigments, 2015, 119:22-29.
[3] Radhika S P, Sreeram K J, Unni Nair B. Rare earth doped cobalt aluminate blue as an environmentally benign colorant [J]. Journal of Advanced Ceramics, 2013.
[4] Tong Y , Zhang H , Wang S , et al. Highly dispersed Re-doped CoAl2O4 nano pigments: Synthesis and chromatic properties [J]. Journal of Nanomaterials, 2016(5):1-7.
[5] Zayat M , Levy D . Blue CoAl2O4 particles prepared by the sol-gel and citrate gel methods [J]. Chemistry of Materials, 2000, 12(9):2763-2769.
[6] Duan X , Pan M , Yu F , et al. Synthesis, structure and optical properties of CoAl2O4 spinel nanocrystals [J]. Journal of Alloys & Compounds, 2011, 509(3):1079-1083.
[7] Salavati-Niasari M , Farhadi-Khouzani M , Davar F . Bright blue pigment CoAl2O4 nano crystals prepared by modified sol-gel method [J]. Journal of Sol-Gel Science and Technology, 2009, 52(3):321-327.
[8] Llusar M , A. Forés, Badenes J A , et al. Colour analysis of some cobalt-based blue pigments [J]. Journal of the European Ceramic Society, 2001, 21(8):1121-1130.
[9] Zawrah M F M , El K A A . Synthesis and characterisation of nano crystalline MgAl2O4 ceramic powders by use of molten salts [J]. British Ceramic Transactions, 2002, 101(2):71-74.
[10] Chapskaya A Y , Radishevskaya N I , Kasatskii N G , et al. The effect of composition and synthesis conditions on the structure of cobalt-bearing pigments of the spinel type [J]. Glass and Ceramics, 2005, 62(11-12):388-390.
[11] Koroleva L F . Synthesis of spinel-based ceramic pigments from hydroxycarbonates [J]. Glass & Ceramics, 2004, 61(9-10):299-302.
