弱光照条件下菊花叶片光合作用减弱的机理分析*
2020-11-18杨再强张源达陆思宇
杨 立,杨再强,2**,张源达,郑 涵,陆思宇
弱光照条件下菊花叶片光合作用减弱的机理分析*
杨 立1,杨再强1,2**,张源达1,郑 涵1,陆思宇1
(1.南京信息工程大学气象灾害预报预警与评估协同创新中心,南京 210044;2.江苏省农业气象重点实验室,南京 210044)
以切花菊品种‘红面’(Hongmian)为试材,于2019年8−10月在南京信息工程大学试验温室中开展环境控制实验,采用透光率分别为60%(L1)和30%(L2)的遮阳网进行遮光处理,持续时间分为3d(T1)、6d(T2)、9d(T3)和12d(T4),以自然光强为对照(CK),测定不同处理下菊花植株叶片的光合参数和快速叶绿素荧光诱导动力学参数,以探究遮光对温室菊花叶片光合特性的影响。结果表明,(1)不同遮光处理下菊花叶片的光饱和点(LSP)、最大净光合速率(Pmax)、表观量子效率(AQE)、气孔导度(Gs)以及蒸腾速率(Tr)均随着处理天数的增加而降低,而光补偿点(LCP)、暗呼吸速率(Rd)、气孔限制值(Ls)和水分利用效率(WUE)则随着处理天数的增加呈现升高的趋势,且L2处理各项指标的变化幅度均大于L1。遮光12d后,Pmax降至CK的51.1%,LCP则增至CK的2.75倍,Gs值较CK降低62.4%。弱光持续时间越长、程度越深,菊花叶片的净光合速率越小,光合性能越差。(2)菊花叶片的最大荧光值(P)随着遮光时间和遮光程度的加深而逐渐升高。(3)遮光处理对菊花叶片PSⅡ反应中心能量分配的影响在于提高了反应中心捕获的量子产额(φPo)和用于电子传递的量子产额(φEo),而降低了用于热耗散的量子比率(φRo)。其中,φPo在L2T3处理下达到最大值0.85,φRo经L1T4处理后降至最小值0.16。表明遮光使菊花叶片吸收的光能被反应中心捕获的概率升高,而用于热耗散的部分减小。(4)遮光处理对于菊花叶片PSⅡ反应中心活性的影响在于使单位活性反应中心吸收的光能(ABS/RC)、热耗散的光能(DIo/RC)、捕获的用于还原QA的光能(TRo/RC)和用于电子传递的能量(ETo/RC)全部降低。其中,ABS/RC、DIo/RC两个参数都在L2T3处理下达到最小值,分别为1.176、0.198。本研究证实,弱光处理使菊花叶片胞间CO2浓度降低,PSⅡ反应中心部分失活,还原PQ、QB的能力降低,天线色素吸收和捕获的光能减少,叶片的光合作用减弱。
菊花;弱光;光合作用;快速荧光;OJIP曲线
菊花()为菊科菊属多年生宿根草本植物,有3000多年的栽培历史,是世界四大切花之一,具有较高的经济价值和观赏价值。近年来,切花菊已成为中国出口花卉的主要种类,采用温室生产切花菊可以周年满足国内外市场的需求[1]。然而进行温室设施栽培时经常存在弱光照的问题,光照作为植物光合作用能量的来源,其多寡和质量高低直接关系到植物生长发育和产量品质形成[2]。因此,研究弱光条件下温室切花菊叶片的光合特性和荧光动力学特性,对于调节光照条件以控制温室菊花的生长并制定适宜的栽培措施具有重要意义。
目前,国内外学者关于弱光对菊花叶片光合作用的影响已经开展了广泛的研究,Kjaer等[3]研究发现,低平均光照强度促进了菊花叶片光合面积的扩大;Han等[4]研究了不同菊花品种对光照强度降低的响应,结果表明遮荫使得不同品种菊花叶片的最大相对电子传递速率降低,并且降低了其中一种菊花叶片(‘Puma Sunny’)的光捕获效率;王艳茹等[5]研究了不同光照强度(透光率分别为20%、40%、60%、80%、100%)对药用白菊光合特性的影响,发现光强减弱使白菊的光补偿点、净光合速率、气孔导度、胞间CO2浓度以及蒸腾速率降低,而使得气孔限制值、最大光能转化率等参数升高;梁芳等[6]研究表明,低温弱光使“神马”菊花叶片的光合参数Pn、Ls下降,Ci上升,而荧光参数ΦPSⅡ、qp和ETR降低;韩霜[7]研究发现,对于弱光敏感的菊花品种‘清露’而言,弱光下植株叶片可以通过增大气孔导度(Gs)和减少胞间CO2浓度(Ci)来减缓因光照不足而造成的光合速率下降。以往有关菊花幼苗期弱光处理对叶片荧光动力学特性、能量分配比率以及菊花叶片PSⅡ反应中心参数活性等内在机理方面的研究鲜有报道。因此,本研究以‘红面’菊花为试验材料,探讨不同弱光水平下菊花叶片光合特性和荧光动力学特性的变化,从而分析弱光照条件下菊花叶片光合作用减弱的内在机理,以期为菊花苗期弱光灾害防御及光环境调控提供参考。
1 材料与方法
1.1 试验设计
试验于2019年8−10月在南京信息工程大学试验温室(Venlo型)内进行,Venlo型温室顶高5.0m、肩高4.5m、宽9.6m、长30.0m,呈南北走向。以菊花品种‘红面’(Hongmian)为试材,于2019年7月6日定植,种苗高15cm,10~15片叶,定植的株行距为20cm×20cm,当苗高达到30cm时,在温室内离地面1.5m高处搭架,架上覆盖不同透光率的黑色遮阳网,试验设置透光率为60%(L1)和30%(L2)两种处理,遮光时间设计3d(T1)、6d(T2)、9d(T3)和12d(T4),以不遮光即自然光照为对照(CK),每处理6株。试验期间其它管理措施按正常进行。
1.2 测定项目与方法
1.2.1 叶片光合参数的测定
利用LI-6400便携式光合作用测定系统(USA产)在遮光处理结束当日的9:00−11:00,对菊花叶片的净光合速率(Pn,μmol·m−2·s−1)进行测量,每处理选择长势均匀的菊花植株重复测定3次,光响应曲线测量利用LI-6400光合作用测定系统(6400-02B)的红蓝光源,控制叶室内光合有效辐射(PAR)分别为0、50、100、200、300、400、600、800、1000、1200、1400、1600、1800、2000μmol·m−2·s−1共14个不同的水平。分别测定不同PAR水平下的净光合速率(Pn,μmol·m−2·s−1)、蒸腾速率(Tr,μmol·m−2·s−1)、气孔导度(Gs,μmol·m−2·s−1)、大气CO2浓度(Ca,μmol·mol−1)和胞间CO2浓度(Ci,μmol·mol−1)等参数,设定参比室内叶片温度为30±1℃,CO2浓度为500±5μmol·m−2·s−1。计算气孔限制值(Stomatal limitation,Ls)[8],Ls=1−Ci/Ca;水分利用率(Water use efficiency,WUE)[9]=Pn/Tr。叶片在每个PAR水平下适应120s,并进行3次重复读数。采用直角双曲线修正模型对菊花叶片的光响应曲线进行模拟,并计算出相应的暗呼吸速率(Dark respiration rate,Rd)、光补偿点(Light compensation point,LCP)、光饱和点(Light saturation point,LSP)、最大净光合速率(Maximum net photosynthetic rate,Pmax)和表观量子效率(Apparent quantum efficiency,AQE)值。
1.2.2 温室气象数据的测定
日光温室内气象数据由数据采集器(WatchDog 2000,USA)自动采集,采集内容包括温室内高度为1.5m处的空气温度、相对湿度和冠层上方1.5m的太阳光合有效辐射。采集频率为10s,存储每60min的平均值。2019年试验期间日光温室内部的日平均温度、相对湿度和光合有效辐射的变化如图1所示。
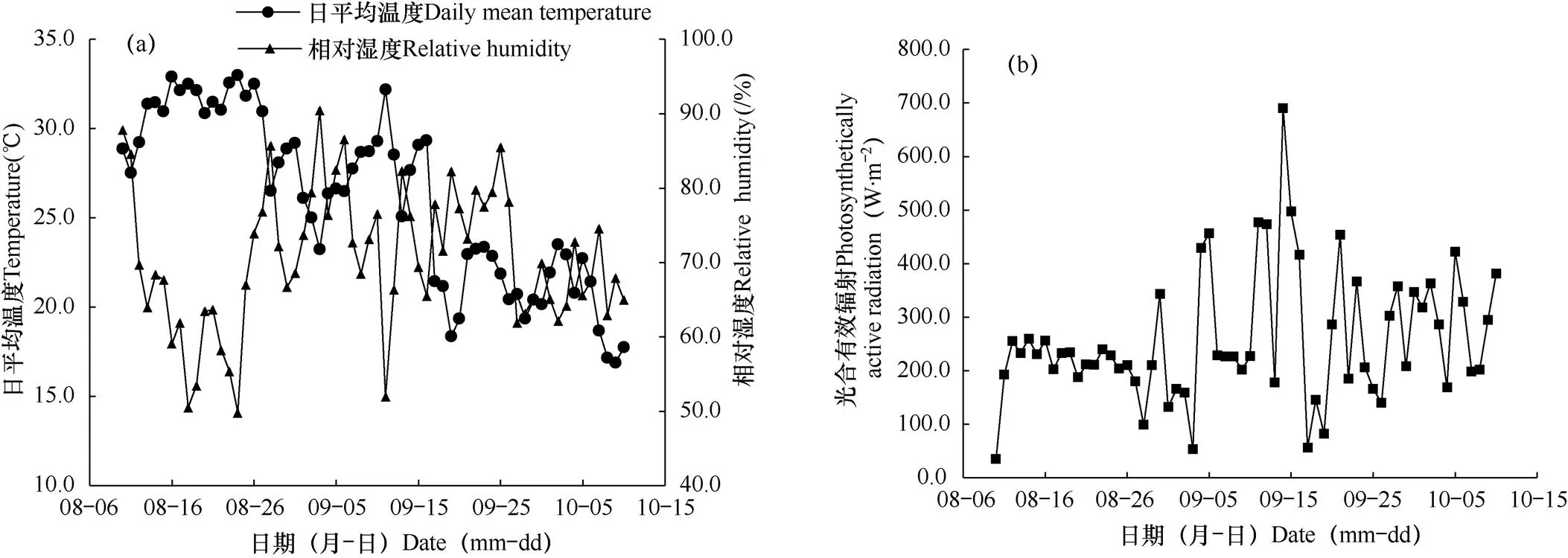
图1 2019年试验期间日平均温度、相对湿度(a)和光合有效辐射(b)的日变化
1.2.3 快速叶绿素荧光诱导动力学参数的测定
采用植物效率分析仪(PocketPEA,Hansatech,UK)在10:00左右测定菊花叶片的快速叶绿素荧光诱导动力学曲线[10−11](OJIP)。每个处理选取3株,每棵植株选取3个新梢顶端起的第5片完全展开叶作为测定对象,所有处理的叶片测定前均进行20min暗适应。20min后选择饱和脉冲光(3000μmol·m−2·s−1的诱导光强),1s测定完整的0.01~1000ms区间OJIP曲线(快速叶绿素荧光诱导动力学曲线),将获得的OJIP荧光诱导曲线进行JIP-test分析。
测量可得到以下荧光参数:最大光化学效率(Fv/Fm或φPo);反应中心吸收的光能用于电子传递的量子产额(φEo);用于热耗散的量子比率(φRo);捕获的激子将电子传递到电子传递链中超过QA的其它电子受体的概率(ψEo);单位活性反应中心吸收的光能(ABS/RC);单位活性反应中心捕获的用于还原QA的光能(TRo/RC);单位活性反应中心捕获的用于电子传递的能量(ETo/RC);单位活性反应中心热耗散的光能(DIo/RC)[12]。
1.3 数据处理
数据分析及图表绘制采用SPSS 25.0及Microsoft Excel 2016,采用Duncan检验法(P=0.05)进行显著性分析。
2 结果与分析
2.1 弱光照条件对菊花叶片光合作用的影响
利用直角双曲线修正模型即叶子飘模型[13]模拟不同光照条件下菊花叶片的光响应曲线,计算相应的光饱和点(LSP)、光补偿点(LCP)、表观量子效率(AQE)、暗呼吸速率(Rd)和最大净光合速率(Pmax)的拟合值(表1)。其中,各参数的计算式分别为
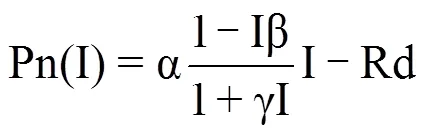
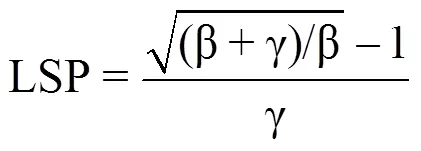
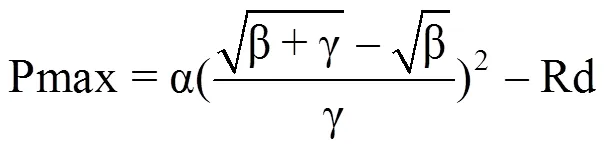
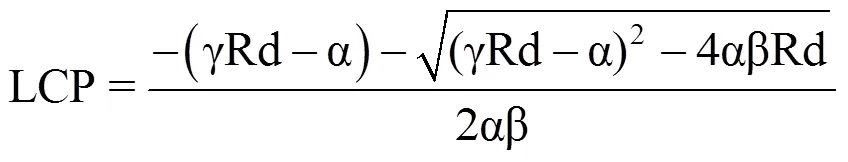

表1 叶子飘模型模拟的不同光照水平及持续时间条件下叶片光响应参数的比较
注:小写字母表示不同遮光处理间在0.05水平上的差异显著性。±表示均方差。L1、L2分别表示透光率为正常自然光照强度的60%和30%。T1、T2、T3和T4表示弱光照射的处理天数分别为3、9、6和12d。AQE为表观量子效率,LSP为光饱和点,LCP为光补偿点,Pmax为最大净光合速率,Rd为暗呼吸速率。下同。
Note: Lowercase indicates the difference significance among illumination level treatments at 0.05 level. “±” is mean square error. L1 and L2 mean that the light transmittance is 60% and 30% of the normal natural light intensity. T1, T2, T3 and T4 represent the treatment days of low light exposure: 3, 9, 6 and 12 days, respectively. AQE is apparent quantum efficiency, LSP is light saturation point, LCP is light compensation point, Pmax is maximum net photosynthetic rate and Rd is Dark respiration rate. The same as below.
式中,Pn(I)表示净光合速率(μmol·m−2·s−1),I是光合有效辐射(μmol·m−2·s−1),Pmax表示最大净光合速率(μmol·m−2·s−1),Rd是暗呼吸速率(μmol·m−2·s−1),LSP表示光饱和点(μmol·m−2·s−1),LCP表示光补偿点(μmol·m−2·s−1),α、β、γ 为系数。
光合作用是指太阳光能被绿色植物体吸收转化为储存能量的重要过程,净光合速率(Pn)是指光合作用固定CO2(或产生O2)的速率[14]。由表1可见,在弱光处理时间较短(3d)的情况下,菊花叶片的光补偿点(LCP)反而低于CK,但随着处理时间的延长,光补偿点(LCP)均明显抬升,且光照越弱、处理时间越长,LCP的抬升幅度越大,各处理间差异显著(P<0.05)。光照最弱且持续时间最长的L2T4处理(L2水平处理12d)中,叶片LCP比CK提升了27.57μmol·m−2·s−1。与此同时,表观量子效率(AQE)也会受到弱光照的影响,光照越弱、持续时间越长,叶片光响应曲线上的AQE越小,即净光合速率的增加变缓。表中显示,光饱和点(LSP)的变化情况与之相反,所有弱光处理中叶片光饱和点均低于对照,且随着光照减弱和持续时间的延长呈显著下降趋势(P<0.05),当光照最弱,处理时间最长(L2T4)时LSP的降幅最大,达到了324.81μmol·m−2·s−1。光补偿点的抬升和光饱和点的降低,意味着净光合作用的降低。由表中可见,叶片最大净光合速率(Pmax)随着光照减弱以及弱光照射时间的延长呈下降趋势,L2T4处理中菊花叶片的Pmax仅为CK的51.1%,下降了一半左右。说明弱光处理可显著降低菊花叶片的光合速率。
由表1还可见,在净光合速率下降的同时,所有弱光处理中菊花叶片的暗呼吸速率(Rd)均高于CK,且随着光照减弱以及弱光照射时间的延长呈升高趋势(P<0.05),L2T4处理中Rd可达到CK的2.38倍。可见,在弱光条件下,菊花叶片的表观量子效率(AQE)降低、光补偿点(LCP)提高、光饱和点(LSP)降低,从而使最大净光合速率(Pmax)降低而暗呼吸速率(Rd)增大,因此,光合作用效果明显降低。
2.2 弱光照条件对菊花叶片气体交换的影响
在L1、L2两种弱光水平下经过不同天数的处理后,菊花植株的气体交换参数变化情况如图2所示。由图2a、b可见,“红面”菊花叶片的气孔导度(Gs)和蒸腾速率(Tr)随着弱光照射时间的增长呈减小趋势。对于相同胁迫天数而言,光照水平越弱,Gs和Tr值越小;而对于同一弱光水平而言,Gs值经过较短的弱光照射时间(T1,即处理3d))即显著下降(P<0.05),L1、L2分别降至CK的58.7%、55.3%,随着弱光照射时间的延长,Gs的变化幅度逐渐减小;而Tr值则经过6d(T2)的遮光处理后才显著减小,L1、L2分别降至CK的55.4%、51.9%。当弱光照射时间增长到12d(T4)后,L1、L2两种弱光水平下菊花叶片的Tr分别降至最低值2.69和2.14μmol·m−2·s−1。表明菊花叶片的气孔对于光强减弱的响应较为灵敏,随着弱光照射时间的延长,气孔开张度减小,从而使空气中CO2分子扩散进入叶片光合组织和溶解于液相的概率减少,在光能较弱的情况下,菊花叶片的光合作用也随之减弱。同时,菊花叶片内部通过气孔经蒸腾作用扩散于大气中的水分也相应减少。
气孔限制值(Ls)通常用大气CO2浓度与胞间CO2浓度的差与大气CO2浓度之比计算而得,它与植物的光合作用、呼吸作用和蒸腾作用密切相关,可以直接反应气孔调节系统的受损状况。不同遮光处理持续不同天数后菊花叶片气孔限制值(Ls)的变化情况如图2c所示,由图可知,随着弱光照射天数的增加,不同处理菊花叶片的气孔限制值(Ls)均呈增加趋势。弱光照射3d(T1)后,各处理间Ls值差异不大;当处理天数增加至6d时,各处理与CK的差异达到显著水平(P<0.05)。弱光处理天数延长至12d时,L2弱光水平下菊花叶片的Ls值达到最大,为CK的1.44倍。由此可见,当菊花叶片的气孔导度(Gs)增大时,环境中CO2通过气孔进入叶片的阻力将会增大,叶片内胞间CO2浓度随之降低,从而不能满足植物的光合作用需求,使植物的光合速率降低,光合作用减弱。
叶片的水分利用效率(WUE)是指在田间,植物蒸散消耗单位质量水分所制造的干物质量,能够反映植物在生产过程中的能量转化效率,通常用叶片净光合速率(Pn)与蒸腾速率(Tr)的比值来表示,由图2d可见,菊花叶片的WUE随着弱光照射时间的延长而呈现增加趋势,且各处理的WUE值均比CK小。当弱光处理天数达到6d(T2)时,L1、L2两种弱光水平下菊花叶片的WUE值迅速升高,L1的变化幅度大于L2;不同弱光水平下,同一处理天数,均以L1处理下菊花叶片的水分利用率较高。当弱光照射时间达到12d(T4),L1遮光水平下的WUE值是L2的1.12倍,且此时两种弱光水平下的WUE均达到最大值,分别为4.23、3.78μmol·mmol−1。菊花叶片气孔限制值的增大,不仅降低了进入叶片光合组织内部的CO2浓度,同时也使得空气中的水分经由气孔进入叶片的含量降低,这引起了菊花叶片水分利用效率的升高,是植物对于光强减弱作出的抗逆反应。
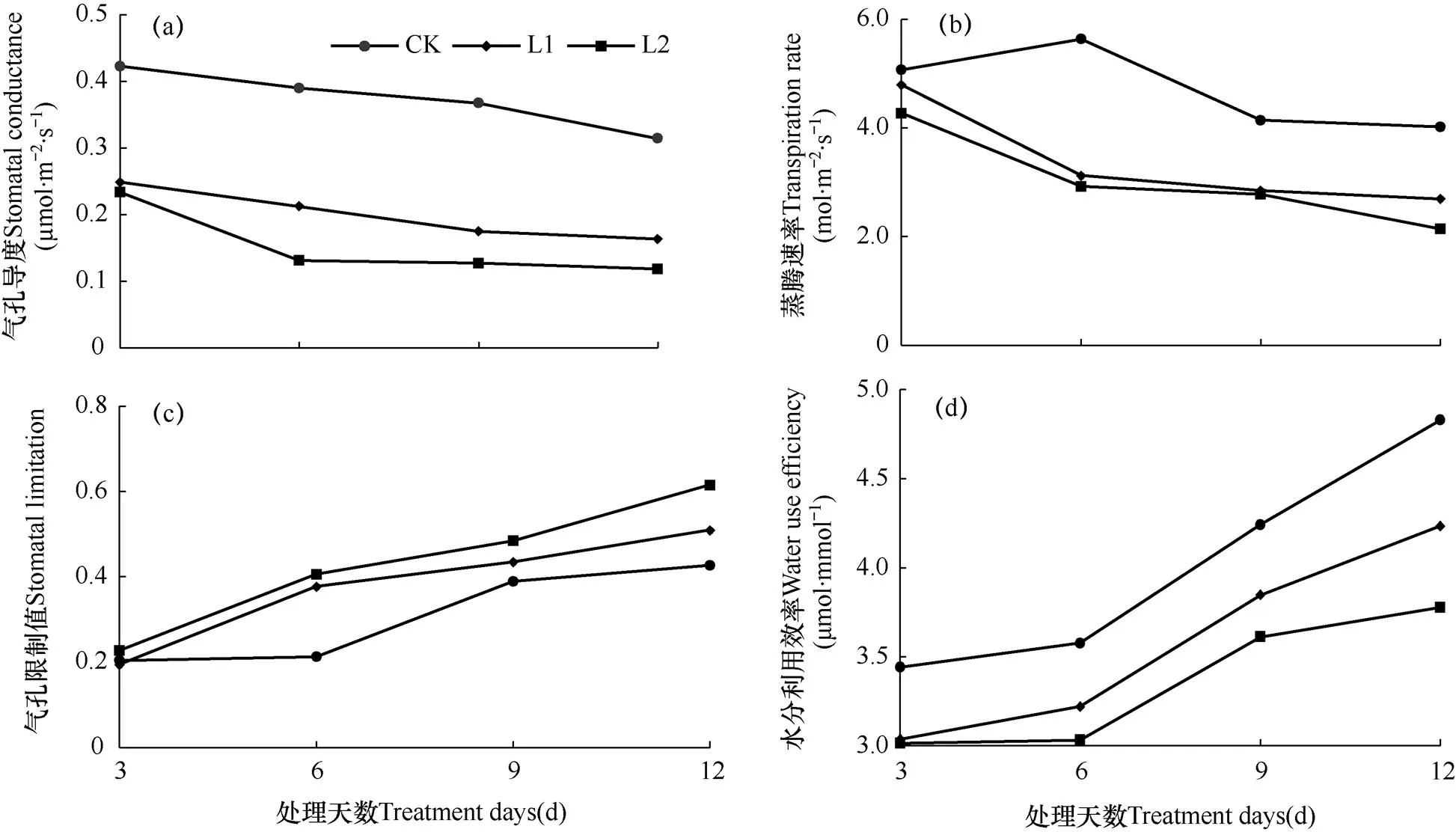
图2 两种弱光(L1和L2)处理持续不同天数后菊花叶片气体交换参数的比较
2.3 弱光照条件对菊花叶片光合中心效率的影响
2.3.1 快速荧光诱导动力学曲线
弱光胁迫使菊花叶片的快速荧光诱导动力学曲线(OJIP)发生了明显变化。由图3可见,不同处理的OJIP曲线在O点处的差异不大,随着弱光照射时间的增长,L1、L2两种弱光水平下菊花叶片OJIP曲线的最大荧光强度(P)均高于CK,且OJIP曲线与CK的偏离程度也在增大,其中J−I和I−P阶段呈现增加的趋势,增幅为T4>T3>T2>T1,T4(12d)处理与CK的偏离程度最大,其中,L1、L2两种弱光水平下处理12d后,I相分别增大至CK的1.58、1.64倍。对于不同的弱光水平,L2弱光胁迫处理后的OJIP曲线中J−I阶段的增幅大于L1,与CK的偏离程度也相对较大。L2弱光水平下处理不同天数的各个P相值也均高于L1处理,经T1、T2、T3、T4处理后L2的各P相值分别为L1的1.07、1.08、1.04、1.06倍。随着弱光胁迫天数的增加,光照强度越弱,J−I阶段和I−P阶段的荧光强度逐渐升高,说明弱光处理限制了菊花叶片PSⅡ反应中心还原PQ、QB的能力。
2.3.2 能量分配比率
φPo表示植物叶片吸收的光能被反应中心捕获的量子产额,实际上其意义与Fv/Fm(最大量子效率)相同。由图4a可知,L1、L2两种弱光水平处理下,φPo均随着处理天数的增加而呈现先升高后降低的变化趋势,并且均在处理9d(T3)后达到最高值,分别为0.850、0.853,且L2处理下菊花叶片的φPo值比同期CK显著提高了1.7%。弱光处理12d(T4)后φPo开始下降,但是各处理间的差异不显著。说明随着弱光胁迫时长的增加,菊花叶片吸收的光能被反应中心捕获的概率逐渐提高,即表明暗适应后菊花叶片的最大光化学效率逐渐提高。
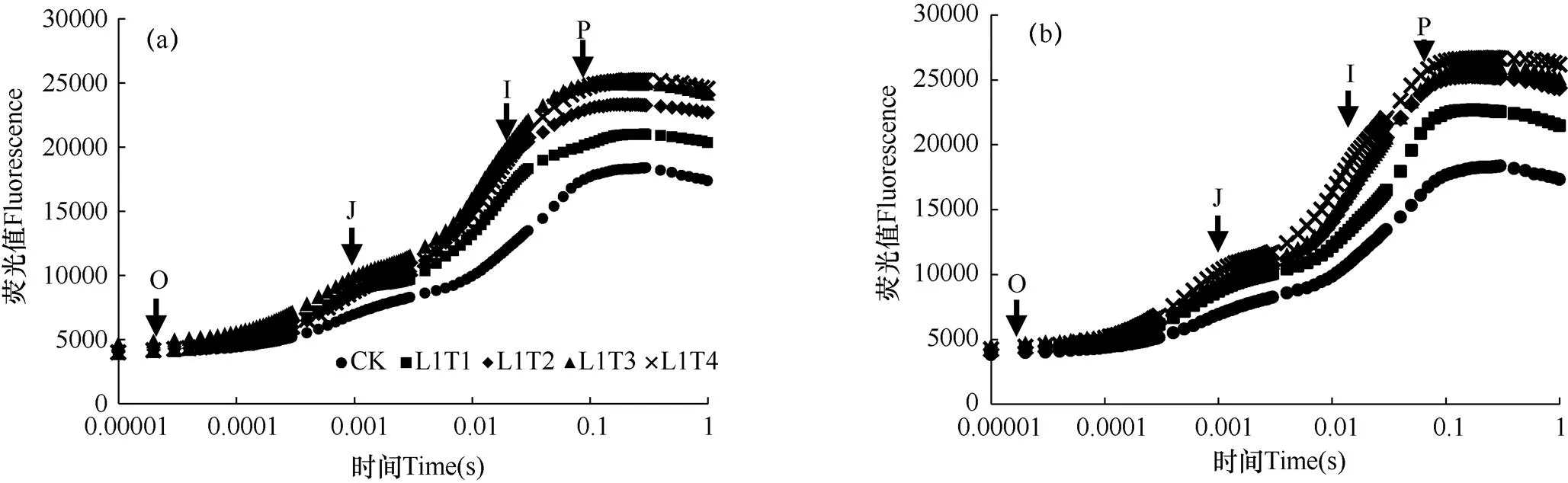
图 3 两种弱光(L1和L2)处理持续不同天数后菊花叶片快速荧光诱导动力学曲线的比较
注:O点表示PSⅡ作用中心完全开放,即所有电子受体处于最大程度氧化时的荧光,称为初始荧光;J点表示PSⅡ上的光电子受体QA首次处于瞬时最大程度还原态时的荧光产量;I点反映了PQ库的异质性,即快还原型PQ库和慢还原型PQ库的大小;P点表示PSⅡ的电子受体处于最大程度还原态时的荧光,称为最大荧光。下同。
Note : Point O indicates the fluorescence when the center of action of PSII is completely open, that is, when all electron acceptors are in maximum oxidation, be called initial fluorescence. Point J indicates the fluorescence of the electron acceptor QAof PSII when it is in the transient maximum reduction state for the first time. Point I reflects the heterogeneity of the PQ library, i.e. the size of the fast-reduction PQ library and the slow-reduction PQ library. Point P indicates the fluorescence of the electron acceptor of PSII when it is in the most reduced state, and be called maximum fluorescence. The same as below.
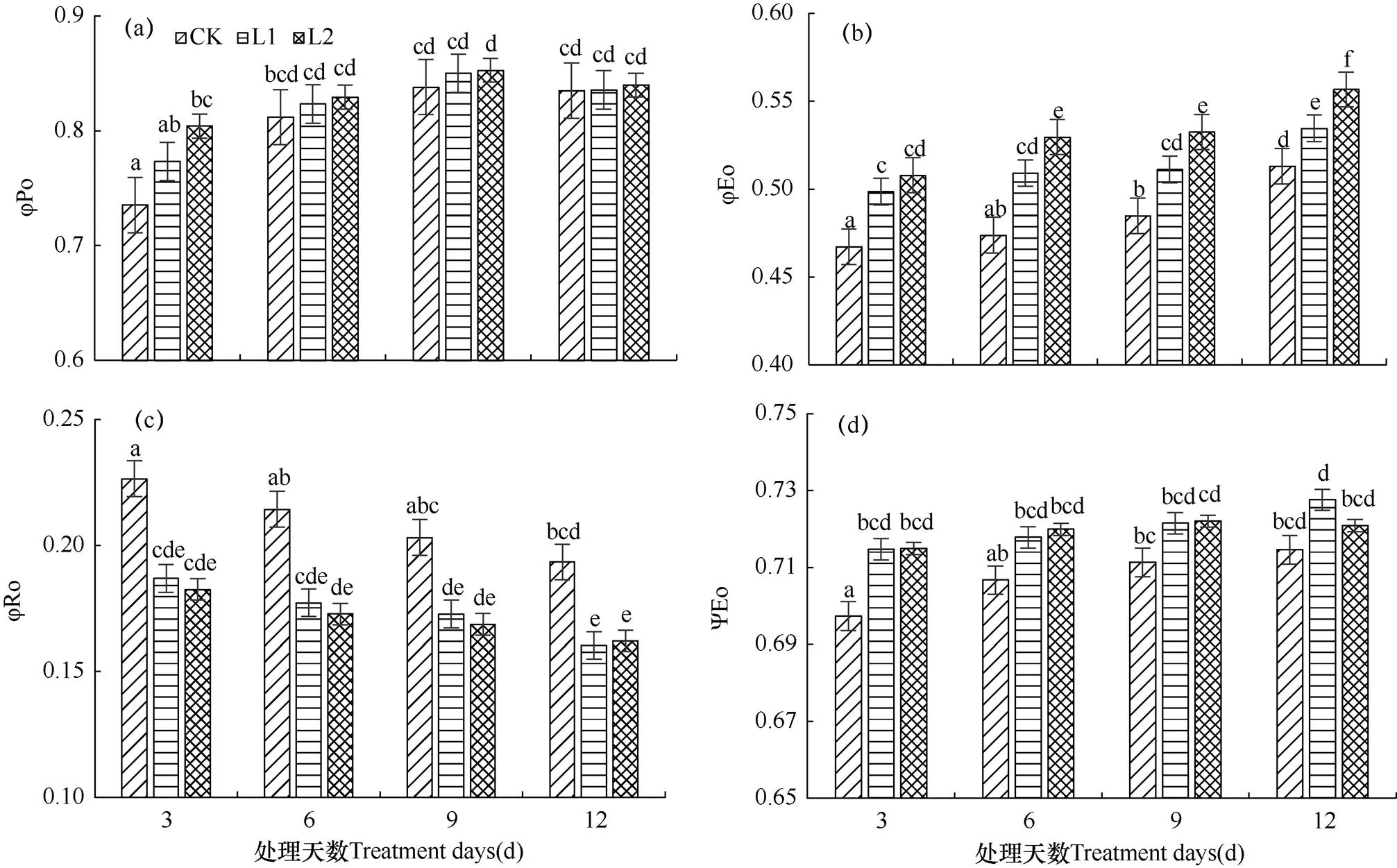
图4 两种弱光水平持续不同天数后菊花叶片各种能量分配比率参数的比较
φEo表示植物叶片反应中心吸收的光能中用于电子传递的量子产额。由图4b可知,L1、L2两种遮光水平处理下,φEo均随着处理天数的增加而呈现出升高趋势,且各个遮光处理后菊花叶片的φEo值均高于同期CK的φEo值。对于L1、L2两种不同的弱光水平而言,仅经过3d(T1)处理,菊花叶片的φEo值就有了显著升高(P<0.05)。对于同一弱光水平而言,L2弱光水平照射下各个处理之间差异显著(P<0.05);而L1弱光水平下,需经12d(T4)处理φEo值的差异才能达到显著水平。弱光处理12d后,L1、L2两种弱光水平照射下的φEo分别比同期CK增长了4.2%和8.5%。说明当光照强度降低时,菊花叶片光反应中心吸收的光能将电子传递到电子传递链中超过QA的其它电子受体的概率会逐渐提高。
φRo表示植物叶片用于热耗散的量子比率。如图4c所示,L1、L2两种弱光水平处理下,φRo均随着处理天数的增加而呈现降低趋势,且各个弱光处理后菊花叶片的φRo值均低于同期CK的φRo值。不同处理天数下,L2弱光水平胁迫下的φRo值均略低于L1弱光水平;当弱光处理天数达到12d(T4)后,L2弱光水平胁迫下的φRo值略高于L1,但是同一处理天数下,两种弱光胁迫处理间的差异不显著。说明在弱光照射下,菊花叶片吸收的光能中用于热耗散的部分将减少。
ψEo表示激子被反应中心捕获后,用于推动电子传递链中超过QA的其它电子受体的激子占用于推动QA还原激子的比率,即2ms时有活性的反应中心的开放程度。由图4d可知,L1弱光水平处理下,ψEo随着处理天数的增加而呈升高趋势;L2弱光水平处理下,ψEo随着处理天数的增加呈现先升高后降低的变化趋势。相同处理天数下,不同弱光水平处理菊花叶片的ψEo值均高于同期CK。经3d(T1)处理后,L1、L2两种弱光水平下ψEo值即显著高于同期CK,分别较同期CK增加了2.5%、2.6%。当处理天数达到12d时,L1弱光水平下的ψEo值达到最大,比同期CK增加了1.8%。说明随着弱光照射时间的延长,菊花叶片中推动电子传递到电子传递链中QA—下游的电子受体的概率逐渐提高,这意味着菊花叶片受到弱光胁迫后对于自身光合作用减弱作出了一定的适应性调节。
2.3.3 PSⅡ反应中心活性
通过快速叶绿素荧光诱导动力学曲线OJIP还可以分析出植物叶片PSⅡ反应中心的活性,当QA处在可还原态时,共有4个不同的用于描述单位PSⅡ反应中心活性的参数,即单位反应中心吸收的光能(ABS/RC);单位反应中心捕获的用于还原QA的能量(TRo/RC);单位反应中心捕获的用于电子传递的能量(ETo/RC)和单位反应中心耗散的能量(DIo/RC)。其中,RC表示活跃的单位反应中心。
如图5a所示,L1弱光水平下,ABS/RC随着处理天数的增加而逐渐降低;L2弱光水平下,ABS/RC则随着处理天数的增加先降低后升高,但是各处理间的差异并不显著。相对于CK而言,L1、L2两种弱光水平处理后的ABS/RC与CK相比较都有显著性差异(P<0.05),且数值均低于同时期的CK值。L2弱光水平下,处理9d(T3)达到最低值,与同时期CK相比,降低了17.7%。
如图5b所示,TRo/RC的变化情况与ABS/RC类似,各弱光处理与CK相较都产生了显著性差异(P<0.05),但是各遮光处理间差异不显著。L1、L2两种弱光水平下的菊花叶片分别在处理12d(T4)、9d(T3)后达到最低值,相比同一时期的CK而言,分别降低了14.4%和18.7%。
由图5c可见,L1、L2两种弱光水平处理后的ETo/RC均随着处理天数的增加呈现降低的趋势。其中,L1弱光水平下的ETo/RC与同一时期的CK相比较差异不显著;L2弱光水平下,经6d(T2)处理后菊花叶片的ETo/RC与同一时期CK差异达到显著水平(P<0.05),相比同时期CK显著降低了12.8%。
由图5d可见,DIo/RC参数随着弱光照射天数的增加呈现先降低后升高的趋势,且弱光处理后的DIo/RC值均显著小于同时期的CK。对于相同的处理天数而言,L1与L2在处理3d和6d时差异显著,且L2遮光水平下的DIo/RC值均小于L1,相比之下分别降低19.4%和17.6%;而当处理天数增长到9d和12d时,L1与L2两种弱光水平下的DIo/RC值差异不显著。
对PSⅡ反应中心活性参数的分析表明,菊花叶片单位PSⅡ反应中心吸收的光能、捕获的用于还原QA和电子传递的能量、热耗散的能量全部降低。说明弱光胁迫导致菊花叶片PSII反应中心部分失活,并抑制了光合代谢中的能量供应,从而使得光合作用减弱。
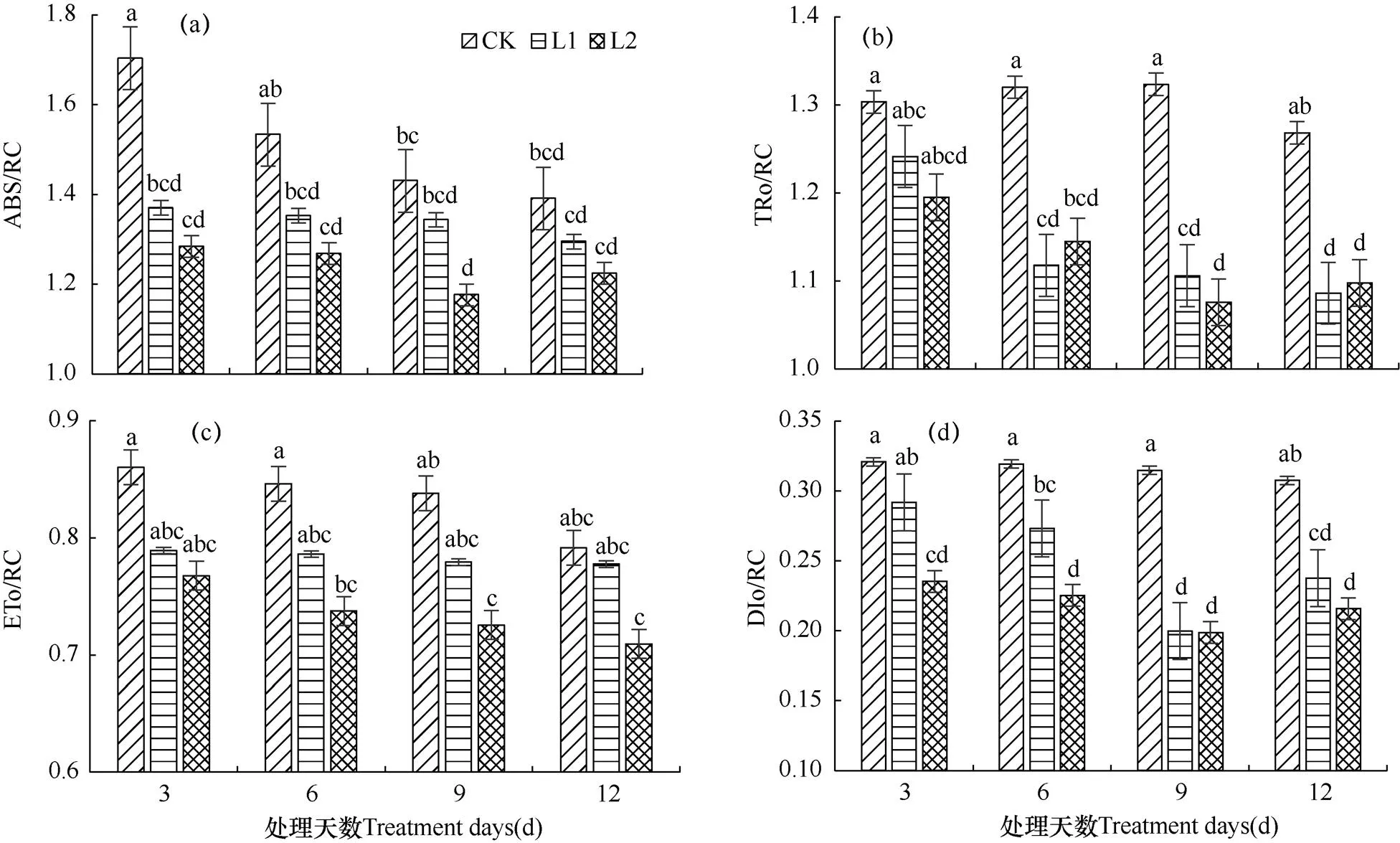
图5 两种弱光水平持续不同天数后菊花叶片各种PSⅡ反应中心活性参数的比较
3 结论与讨论
3.1 讨论
光合作用是植物对逆境最敏感的生理过程之一[15],在不适宜的光照条件下,植物的生长将会减缓甚至停止。关于弱光胁迫处理对不同作物光合特性的影响已有大量研究。已有研究发现,对植物进行弱光处理,一般将使植物叶片的净光合速率(Pn)、光饱和点(LSP)、表观量子效率(AQE)、气孔导度(Gs)以及蒸腾速率(Tr)降低;而使得植物叶片的光补偿点(LCP)、气孔限制值(Ls)和水分利用效率(WUE)升高[16−20]。
本研究结果表明,随着弱光照射时间的延长和程度的加深,菊花叶片的表观量子效率(AQE)逐渐下降,光补偿点(LCP)升高,光饱和点(LSP)降低,从而使最大净光合速率(Pmax)降低而暗呼吸速率(Rd)增大,导致菊花叶片的光合作用明显减弱。这与朱雨晴等[16−17]的研究结果一致。
叶片上的气孔是植物与大气间进行碳水交换的通道,气孔的开闭影响着植物的蒸腾和光合等生理机能,并能随着环境状况的改变而时刻发生变化,在植物体中起平衡调节的作用。气孔导度(Gs)则是衡量植物和大气间水分、能量及CO2平衡和循环的重要指标[21]。本试验结果表明,随着弱光处理天数的增加,各处理菊花叶片的气孔导度(Gs)和蒸腾速率(Tr)均逐渐降低,且均低于同时期CK值;而气孔限制值(Ls)和水分利用效率(WUE)则逐渐升高。这一结论与熊宇等[22−23]的研究结果一致。当弱光照射天数达到12d时,各处理的气孔导度和蒸腾速率达到最低值,L1、L2两种弱光水平下菊花叶片的气孔导度分别比同时期CK降低了48.0%、62.3%;蒸腾速率较同时期CK分别降低33.1%、46.7%。这表明弱光胁迫使得菊花叶片的气孔开张度减小,空气中CO2分子扩散进入叶片光合组织和溶解于液相的概率也降低,使得叶片内胞间CO2浓度下降,不能满足植物的光合作用需求,从而导致菊花叶片的光合作用减弱。
φPo、φEo、φRo、ψEo是与叶片能量分配比率有关的4个荧光参数。本试验中,菊花叶片的φPo、φEo、ψEo随着弱光处理天数的增加呈上升趋势,而φRo则有所降低,说明弱光照射使得菊花叶片调整了光能在PSⅡ反应中心的分配比率,表现在提高了用于电子传递的量子产额,而减小了用于热耗散的量子比率。这可能是菊花叶片在受到弱光胁迫后作出的适应性调节。
ABS/RC、TRo/RC、ETo/RC和DIo/RC反映了电子受体QA处于可被还原状态时,单位PSⅡ反应中心的活性。弱光胁迫一方面使菊花叶片PSⅡ反应中心部分失活,另一方面影响了天线色素的结构。其中,ABS/RC是衡量天线色素大小比例的重要指标,当该值和TRO/RC均减小时,说明天线色素尺寸显著减小[24]。本试验表明,ABS/RC、TRo/RC、ETo/RC和DIo/RC均随着弱光处理天数的增加呈现降低的趋势,这一结论与贾浩等[12]对桃树叶片的研究结果相同。两种不同程度的弱光照射处理下,菊花叶片的ABS/RC、TRO/RC均降低,说明天线色素尺寸减小,吸收和捕获的光能减少,使得用于还原的激发能(TRO/RC)及用于电子传递的能量(ETO/RC)均减少,从而导致用于光合代谢的能量不足,叶片的光合作用减弱。同时,与正常的自然光照对比,弱光胁迫下菊花叶片用于热耗散的能量也随着光合作用的减弱而降低。大多数学者通过研究光化学淬灭系数(qP)、非光化学淬灭系数(qN)和光合电子传递速率(ETR)来研究植物叶片的叶绿素荧光特性,并发现弱光胁迫使qP和ETR降低,而使得qN升高[5,19,23]。其中,ETR能反映植物光合速率的快慢,qP表征了植物的光合作用活性,qN则反映了植物的热耗散能力,即光保护能力。这三个参数与本研究使用的表征植物叶片荧光特性的参数虽然不同,但是它们所代表的意义却是一致的。
综上所述,可以从两个角度出发对弱光照条件下菊花叶片光合作用减弱的机理进行分析。从光合中心角度出发,在弱光照射胁迫的作用下,菊花叶片的天线色素尺寸减小,PSII反应中心部分失活,吸收和捕获的光能以及用于电子传递的能量都随之减少,并且弱光照射在一定程度上降低了电子PSⅡ反应中心受体侧的传递能力,限制PSⅡ反应中心QB和PQ被还原的能力,使得叶片光合代谢的能量不足,进而使得光合作用减弱;从分子角度出发,由于弱光照射条件下,菊花叶片气孔限制值增大,气孔导度降低,导致叶片的气孔阻力增大,气孔开张度减小,环境中CO2分子扩散进入叶片光合组织受到限制,使得胞间CO2浓度降低,不能满足光合作用的需求而使光合作用减弱。
本研究以‘红面’菊花为试验材料,对弱光照条件下菊花叶片光合作用的减弱作了详细的机理分析,可以为苗期菊花的光环境调控提供一定的科学依据。在光照不足的条件下,可以考虑增加人工光源,实施补光处理,以便更好地调控温室菊花的生长发育。本次试验只研究了苗期弱光处理对菊花叶片光合作用的影响,而未对后期菊花叶片光合能力的恢复情况进行监测,且仅考虑了光照条件的影响,而忽略了光照条件变化所引起的温度和湿度的相应变化,未能综合考虑各项环境因子。除此之外,不同品种的菊花对于光照条件的要求可能不同,未来可以增加不同品种的菊花对弱光胁迫调试能力的对比。
3.2 结论
(1)随着弱光照射时间的延长和程度的加深,菊花叶片的表观量子效率(AQE)逐渐下降,光补偿点(LCP)升高,光饱和点(LSP)降低,从而使最大净光合速率(Pmax)降低而暗呼吸速率(Rd)增大,导致菊花叶片的光合作用明显减弱。弱光持续时间越长、程度越深,菊花叶片的净光合速率越小,光合性能越差。
(2)随着弱光处理天数的增加,菊花叶片的气孔导度(Gs)和蒸腾速率(Tr)均逐渐降低,且均低于同时期CK;而气孔限制值(Ls)和水分利用效率(WUE)则逐渐升高。
(3)弱光照射下菊花叶片对光能在PSⅡ反应中心的分配比率进行了调整,用于电子传递的量子产额提高,而减小了用于热耗散的量子比率。
[1] 杨再强,罗卫红,陈发棣,等.温室标准切花菊发育模拟与收获期预测模型研究[J].中国农业科学,2007,40(6): 1229-1235. Yang Z Q,Luo W H,Chen F D,et al.A simulation model for predicting the development stage and harvesting date of standard cut chrysanthemum in greenhouse[J].Scientia Agricultura Sinica,2007,40(6):1229-1235.(in Chinese)
[2] 刘文科,杨其长.雾霾天气与设施园艺补光[J].科技导报,2014,32(10):12.Liu W K,Yang Q C.Haze weather and facility gardening supplement light[J].Journal of Science and Technology, 2014, 32(10):12.(in Chinese)
[3] Kjaer K H,Ottosen C.Growth of chrysanthemum in response to supplemental light provided by irregular light breaks during the night[J].Journal of the American Society for Horticulture Science,2011,136(1):3-9.
[4] Han S,Jiang J F,Li H Y,et al.The differential response of two chrysanthemum cultivars to shading: photosynthesis, chloroplast,and sieve element-companion cell ultrastructure[J]. Hortscence, 2015,50(8):1192-1195.
[5] 王艳茹,郭巧生,靳淼.光强对药用白菊花生长发育及光合特性的影响[J].中国中药杂志,2009,34(13):1632-1635. Wang Y R,Guo Q S,Jin M.Effects of light intensity on growth and photosynthetic characteristics of[J].China Journal of Chinese Materia Media, 2009, 34(13):1632-1635.(in Chinese)
[6] 梁芳,郑成淑,孙宪芝,等.低温弱光胁迫及恢复对切花菊光合作用和叶绿素荧光参数的影响[J].应用生态学报,2010,21(1):29-35. Liang F,Zheng C S,Sun X Z,et al.Effects of low temperature and weak light stress and its recovery on the photosynthesis and chlorophyll fluorescence parameters of cut flower chrysanthemum[J].Chinese Journal of Applied Ecology, 2010, 21(1): 29-35.(in Chinese)
[7] 韩霜.弱光对菊花‘清露’光合特性的影响[J]. 北方园艺, 2017, (6):81-85. Han S.Effects of low light on photosynthetic characteristic ofcultivar‘Puma sunny’[J]Northern Horticulture,2017,(6):81-85.(in Chinese)
[8] Berry J A,Downton W J S.Environmental regulation of photosynthesis[J].Photosynthesis,1982(2):263-343.
[9] Zhang Z.Research development in estimation models of crop water use efficiency and transpiration and evaporation[J]. Agricultural Research in the Arid Areas,1997,15(1):73-78.
[10] Strasser R J,Strasser B J.Measuring fast fluorescence transients to address environmental questions:the JIP test[C] //Mathis P.Photosynthesis:from light to biosphere. Dordrecht: KAP Press,1995:977-980.
[11] Strasser R J.The grouping model of plant photosynthesis: heterogeneity of photosynthetic units in Thylakoids[M] //Akoyuno-Glou G.PhotoynthesisⅡ:structure and molecular organization pf the photosynthetic apparatus. Philadelphia: BISS Press,1981:727-737.
[12] 贾浩,郝建博,曹洪波,等.遮荫对‘保佳红’桃树叶片快速叶绿素荧光诱导动力学曲线的影响[J].西北植物学报,2015,35(9):1861-1867. Jia H,Hao J B,Cao H B,et al.Effects of shading on fast chlorophyll fluorescence induction dynamics of ‘Baojiahong’peach leaves[J].Acta Botanica Sinica, 2015, 35(9): 1861- 1867.(in Chinese)
[13] Ye Z P,Yu Q.Comparison of a new model of light response of photosynthesis with traditional models[J].Journal of Shenyang Agricultural University,2007,38(6):771-775.
[14] 李佳帅,杨再强.薛思嘉,等.遮光对设施黄瓜叶片光合参数及光响应曲线的影响[J].北方园艺,2018,(14):63-71. Li J S,Yang Z Q,Xue S J,et al.Effects of sparse sunlight on photosynthetic parameters and light response curves of cucumber[J].Northern Horticulture,2018,(14):63-71.(in Chinese)
[15] 赵和丽,杨再强,王明田,等.高温高湿胁迫及恢复对番茄快速荧光诱导动力学的影响[J].生态学杂志, 2019, 38(8): 2405-2413. Zhao H L,Yang Z Q,Wang M T,et al.Effects of high temperature and high humidity stress and restoration on the fast fluorescence induction dynamics of tomato leaves[J]. Chinese Journal of Ecology,2019,38(8):2405-2413.(in Chinese)
[16] 朱雨晴,薛晓萍.遮阴及复光对花果期番茄叶片光合特性的影响[J].中国农业气象,2019,40(2):126-134. Zhu Y Q,Xue X P.Effects of shading and light restoration on photosynthetic characteristics of tomato leaves during flowering and fruit period[J].Chinese Journal of Agrometeorology, 2019,40(2):126-134.(in Chinese)
[17] 秦玉芝,邢铮,邹剑锋,等.持续弱光胁迫对马铃薯苗期生长和光合特性的影响[J].中国农业科学,2014,47(3):537- 545. Qin Y Z,Xing Z,Zou J F,et al.Effects of sustained weak light on seedling growth and photosynthetic characteristics of potato seedlings[J].Scientia Agricultura Sinica,2014,47(3): 537-545.(in Chinese)
[18] 赵和丽,杨再强.低温和遮光单因素胁迫对温室黄瓜叶片光合、器官干物质分配及果实品质的影响[J].北方园艺,2018(10):1-8. Zhao H L,Yang Z Q.Effects of low temperature and weak light single factor stress on photo-synthesis characteristics, dry matter distribution and fruit quality of greenhouse cucumber leaves[J].Northern Horticulture,2018(10):1-8.(in Chinese)
[19] 李凯伟,杨再强,肖芳,等.遮光胁迫对设施葡萄叶片光合特性的影响及评价[J].中国农业气象,2017,38(12):801-811. Li K W,Yang Z Q,Xiao F,et al.Effects and evaluation of low irradiation stress on photosynthetic characteristics of grapevine leaves in greenhouse[J].Chinese Journal of Agrometeorology,2017,38(12):801-811.(in Chinese)
[20] 张继波,陈辰,李楠,等.极端遮光天气对设施番茄光合特性及抗氧化酶活性的影响[J].山东农业科学,2017,49(3): 64-68. Zhang J B,Chen C,Li N,et al.Effects of extreme sparse sunlight on photosynthesis characteristics and antioxidant enzyme activities of tomato in greenhouse[J].Shandong Agricultural Sciences,2017,49(3):64-68.(in Chinese)
[21] 高冠龙,张小由,常宗强,等.植物气孔导度的环境响应模拟及其尺度扩展[J].生态学报,2016,36(6):1491-1500. Gao G L,Zhang X Y,Chang Z Q,et al.Environmental response simulation and the up-scaling of plant stomatal conductance[J].Acta Ecologica Sinica,2016,36(6): 1491-1500. (in Chinese)
[22] 熊宇,杨再强,薛晓萍,等.遮光处理对温室黄瓜幼龄植株叶片光合参数的影响[J].中国农业气象,2016,37(2):222-230. Xiong Y,Yang Z Q,Xue X P,et al.Effect of shading on photosynthetic parameters in greenhouse cucumber leaves[J]. Chinese Journal of Agrometeorology, 2016, 37(2): 222-230.(in Chinese)
[23] 朱静,杨再强,柳笛,等.设施芹菜光合特性对遮光胁迫的响应[J].干旱气象,2012,30(1):53-58. Zhu J,Yang Z Q,Liu M,et al.Response of the photosynthetic characteristics of celery to sparse sunlight in greenhouse[J]. Journal of Arid Meteorology,2012,30(1):53-58.(in Chinese)
[24]Brestic M,Zivcak M,Kalajih M,et al.PhotosystemⅡthermostability in situ:environmentally induced acclimation and genotype specific reactions inL[J].Plant Physiology and Biochemistry,2012,57:93-105.
Mechanism Analysis on Photosynthetic Attenuation in Chrysanthemum Leaves under Low Light Condition
YANG Li1, YANG Zai-qiang1,2, ZHANG Yuan-da1, ZHENG Han1, LU Si-yu1
(1.Collaborative Innovation Center on Forecast and Evaluation of Meteorological Disasters, Nanjing University of Information Science & Technology, Nanjing 210044, China; 2.Jiangsu Provincial Key Laboratory of Agrometeorology, Nanjing 210044)
In this paper, the changes of photosynthetic characteristics and fluorescence kinetic characteristics of chrysanthemum leaves under different low light levels were discussed, so as to analyze the internal mechanism of photosynthetic attenuation of chrysanthemum leaves under low light conditions, with the purpose of providing reference for the defense against low light disasters and the regulation of light environment in the seedling stage of chrysanthemum. In order to reveal the influence of shading treatments on greenhouse chrysanthemum leaf photosynthetic characteristics, a controlled experiment with varieties of cut-flower chrysanthemum ‘Hongmian’ was conducted in August 2019 to October 2019 in Nanjing University of Information Science and Technology experimental greenhouse. Chrysanthemum seedlings were planted in the greenhouse pools. When the height of seedlings reached 30cm, shelves were set up 1.5m above the ground, and the shelves were covered with black sunshade nets of 60%(L1) and 30%(L2) light transmittance respectively. Treatments lasted 3(T1), 6(T2), 9(T3) and 12(T4) days, contrasting with normal natural light intensity(CK). Photosynthetic parameters and fast chlorophyll fluorescence induction kinetic parameters of chrysanthemum were determined under different treatments. The results showed that, (1)the light saturation point(LSP), photosynthetic rate at irradiation saturation(Pmax), apparent quantum efficiency(AQE), stomatal conductance(Gs) and transpiration rate(Tr) of chrysanthemum leaves decreased with the increase of treatment days under different shading treatments, while the light compensation point(LCP), dark respiration rate(Rd), stomatal limit value(Ls) and water use efficiency(WUE) were opposite. In addition, the variation range of all indicators treated by L2 is larger than that of L1. After 12 days of shading, Pmax decreased to 51.1%, Gs decreased to 62.4%, while LCP increased to 2.75 times, compared with CK. (2)The maximum fluorescence(P) of chrysanthemum leaves increased with the shading time and shading degree. (3)In terms of PSⅡ energy distribution ratio, the effects of shading treatment on chrysanthemum leaves were to increase the quantum yield captured by the reaction center(φPo) and the quantum yield for electron transfer(φEo), while decreasing the quantum ratio for heat dissipation(φRo). Among them, φPo reaches a maximum value of 0.85 after L2T3 treatment, and φRo drops to a minimum value of 0.16 after L1T4 treatment. These results indicated that shading increased the probability that the light absorbed by chrysanthemum leaves captured by PSⅡ reaction center, while the part used for heat dissipation decreased. (4)In terms of PSⅡ reaction center activity, the values of light energy absorbed by the unit active reaction center(ABS/RC), the energy dissipated by the unit reaction center(DIo/RC), energy recovered by the unit reaction center for reducing QA(TRo/RC) and the unit reaction center for electron transfer(ETo/RC) all decreased after shading treatments. Among them, ABS/RC and DIo/RC reached their minimum values under L2T3 treatment, which were 1.176 and 0.198, respectively. This study confirmed that weak light treatments reduce the chrysanthemum leaf intercellular CO2concentration, the activity of the PSⅡ reaction center and the ability to restore the PQ, QB. The light energy absorbed and captured by the antenna pigment is also reduced. In conclusion, the photosynthesis of chrysanthemum leaves is reduced.
; Weak light; Photosynthesis; Rapid fluorescence; OJIP curve
10.3969/j.issn.1000-6362.2020.11.003
杨立,杨再强,张源达,等.弱光照条件下菊花叶片光合作用减弱的机理分析[J].中国农业气象,2020,41(11):707-718
2020−05−28
杨再强,E-mail: yzq@nuist.edu.cn
国家重点研究开发计划(2019YFD1002202)
杨立,E-mail: yangli980109@foxmail.com
