基于数字PCR方法的新型冠状病毒检测
2020-11-16周阳费明明黄左安
周阳 费明明 黄左安

摘要:荧光定量PCR(RT-PCR)检测方法作为检测SARS-CoV-2的金标准被广泛应用于临床。但由于标本病毒载量不同和RT-PCR的局限性,不可避免的会出现大量的假阴性报告,导致无法及时诊断、早期治疗、阻断传播、评估出院标准等问题。为了改善这一情况,我们探索了一种基于数字PCR(ddPCR)技术的检测SARS-CoV-2的方法。首先,使用新型冠状病毒数字PCR核酸检测试剂盒定量三例强阳咽拭子样本ORF1ab基因拷贝数,并与RT-PCR的Ct值进行分析,发现二者呈对数相关性。随后挑选1例阳性样本,进行倍比稀释检测,最终确定其检测试剂盒的最低检出限为250 copies/ml,远低于RT-PCR的1000 copies/ml。使用60例稀释至250 copies/ml对试剂盒检出限进行验证,发现ORF1ab基因检出率为93.3%,N基因检出率为100%。临床验证结果显示在检测的15例临床样本,其中8例RT-PCR诊断为疑似的样本,ddPCR结果5例是阳性,3例是阴性。因此,ddPCR在临床诊断SARS-CoV-2具有更高的灵敏度,减少了假阴性和假阳性诊断,对COVID-19诊断、治疗和防控等方面均具有重要意义。
关键词:SARS-CoV-2;COVID-19;核酸检测;RT-PCR;ddPCR
【中图分类号】R563.1 【文献标识码】A 【文章编号】1673-9026(2020)08-217-03
1.引言
2019年12月,湖北武汉爆发不明原因肺炎,并迅速在全国蔓延。目前,COVID-19的检测主要有CT检查[1],核酸检测[2,3]和抗体检测[4-6]。荧光定量PCR已经成为实验室检测SARS-CoV-2病毒核酸的主要方式[7],然而,核酸检测结果受到样本和取样时间的影响,存在假阴性情况[3,8,9],原因之一可能是样本的病毒载量未达到试剂的最低检出限。寻找具有更低检出限的核酸检测方法,成为了临床检测COVID-19的重要目标。
微滴式数字PCR(ddPCR)是一种将模板稀释到单分子水平并结合泊松分布定量DNA分子的方法[10]。与实时荧光定量PCR相比,它提供了更高的灵敏度和特异性。因此,本研究基于ddPCR技术,评估了RT-PCR检测与ddPCR检测新冠病毒的灵敏度与特异性,确定一种高灵敏的检测方法,以期降低臨床检测的假阴性率。
2.材料方法
2.1材料
鼻咽拭子样本共118份,其中阴性样本101份,阳性样本9份,疑似样本8份,由中国科学院大学宁波华美医院提供;核酸提取或纯化试剂(Ex-DNA/RNA病毒)、全自动旋转式核酸提取仪(GeneRotex 96)购自苏州天隆生物科技有限公司;数字PCR微滴式芯片(V2)、新型冠状病毒核酸检测试剂盒(数字PCR法)、样本制备仪(DG32)、PCR扩增仪(TC1)、生物芯片阅读仪(iScanner5)由领航基因科技(杭州)有限公司提供。新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法)购自上海伯杰医疗科技有限公司。全自动定量PCR仪(SLAN-96S)购自上海宏石医疗科技有限公司。
2.2实验方法
2.2.1核酸提取
取出-80℃冰箱保存的鼻咽拭子样本,室温融化,涡旋震荡混匀。取出核酸提取和纯化试剂,将深孔板颠倒混匀,重悬底部磁珠,轻甩孔板,使试剂及磁珠集中到底部,撕开封口膜。深孔板第一孔加入20ul蛋白酶K和200ul鼻咽拭子样本,第二孔放入搅拌套。加完样本后的孔板放入全自动旋转式核酸提取仪中,按照说明书的程序提取病毒核酸。取出最后一孔中的核酸样本到1.5ml无RNA酶的EP管中,-80℃保存。
2.2.2数字PCR扩增及芯片阅读
预热样本制备仪、生物芯片阅读仪。取出-20℃冰箱保存的新型冠状病毒核酸检测试剂盒(数字PCR法),冰上溶解ddPCR试剂。在生物安全柜中按照说明书配制反应体系,取14ul反应体系加入到数字PCR微滴式芯片进样口的杯子中,加入16ul油相补满。在进出口杯子上盖上硅胶帽,放入样本制备仪制备微滴。微滴制备完成后,将芯片放入PCR扩增仪中,按照程序扩增。取出扩增完成的芯片,放入生物芯片阅读仪扫描并记录结果。
2.2.3RT-PCR扩增
取出-20℃冰箱保存的新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法),冰上溶解RT-PCR试剂。在生物安全柜中按照说明书在八连管中配制反应体系。将八连管放入全自动定量PCR仪中,按照程序扩增并观察结果。
2.2.4阳性样本定量
挑选3个qPCR检测结果为强阳性的样本,用阴性稀释液稀释阳性样本的核酸,梯度为1,10,100倍稀释。取200ul样本,使用核酸提取或纯化试剂提取样本核酸,重复2次。提取的核酸进行数字PCR ORF1ab单基因定量,计算原始样本病毒拷贝数。
计算公式:
Y:原始样本病毒核酸拷贝数;D:稀释倍数;S:提取样本量;E提取后核酸体积;T:反应核酸体积;R:反应体系体积;Q:定量拷贝数。
2.2.5线性化验证
取2.2.5的阳性核酸样本,直接进行RT-PCR检测。通过GraphPad软件对数据进行线性分析,X为RT-PCR检测的Ct值,Y为Log10ddPCR定量的核酸数值,P < 0.05认为有意义。
2.2.6最低检出限确定
取1例定量后的阳性样本,用阴性稀释液,采用倍比稀释法将样本核酸拷贝数稀释到2000,1000,500,250 copies/ml,各三份。使用核酸提取或纯化试剂提取各样本核酸并收集。提取的核酸样本使用数字PCR核酸检测试剂盒进行ORF1ab和N基因双基因扩增检测。根据检出结果,确定最低检出限。
2.2.7最低检出限验证
取3例定量后的阳性样本,用阴性稀释液稀释到最低检出限的基因拷贝数,各20份。核酸提取或纯化试剂提取样本核酸并收集,使用数字PCR核酸检测试剂盒进行ORF1ab和N基因双基因扩增检测。检出率 > 90% 则认为该拷贝浓度是最低检出限。
2.2.8临床样本验证
取15例RT-PCR检测后的样本,1例为阴性,6例为阳性,8例为疑似阳性。样本核酸使用ddPCR进行OFR1ab和N基因双基因扩增检验,观察检出效果。
2.3实验结果
2.3.1阳性样本定量结果
以10倍稀释的样本ORF1ab检出数值预估原样本的浓度。样本A为7.5×106 copies/ml;样本B为1.1×107 copies/ml;样本C为3.0×107 copies/ml。
2.3.2线性化验证
提取的核酸进行RT-PCR检测,以Log10拷贝数和RT-PCR的Ct值进行比对,通过GraphPad软件分析二者结果是否呈线性相关,如图1所示。
从图1可以看出,ddPCR定量的SARS-CoV-2病毒ORF1ab拷贝数与RT-PCR检测的Ct值线性相关,且p值小于0.0001。
2.3.3最低检出限确定及验证
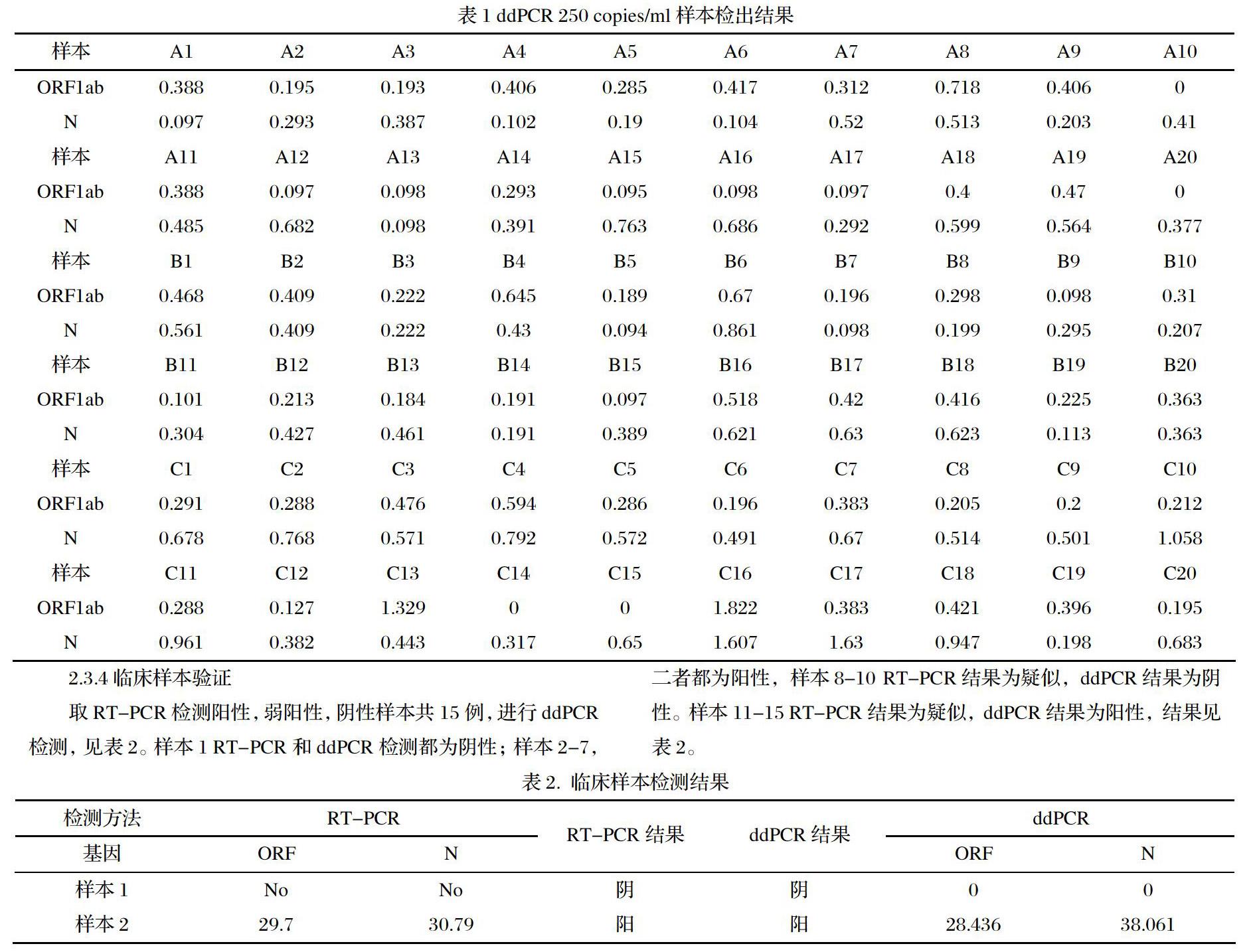
样本在2000,1000,500 copies/ml时,两个基因的检出率为100%,250 copies/ml,有一個样本的ORF1ab基因未检测到。因此最低检出限在500copies/ml和250 copies/ml两个浓度中产生。
取ABC三个样本,用阴性稀释液稀释到250 copies/ml,各20份样本,进行核酸提取和数字PCR检测,结果见表1。N基因的检出率为100%,ORF1ab的检出率为93.3%。可以确定该试剂盒的最低检出限为250 copies/ml。
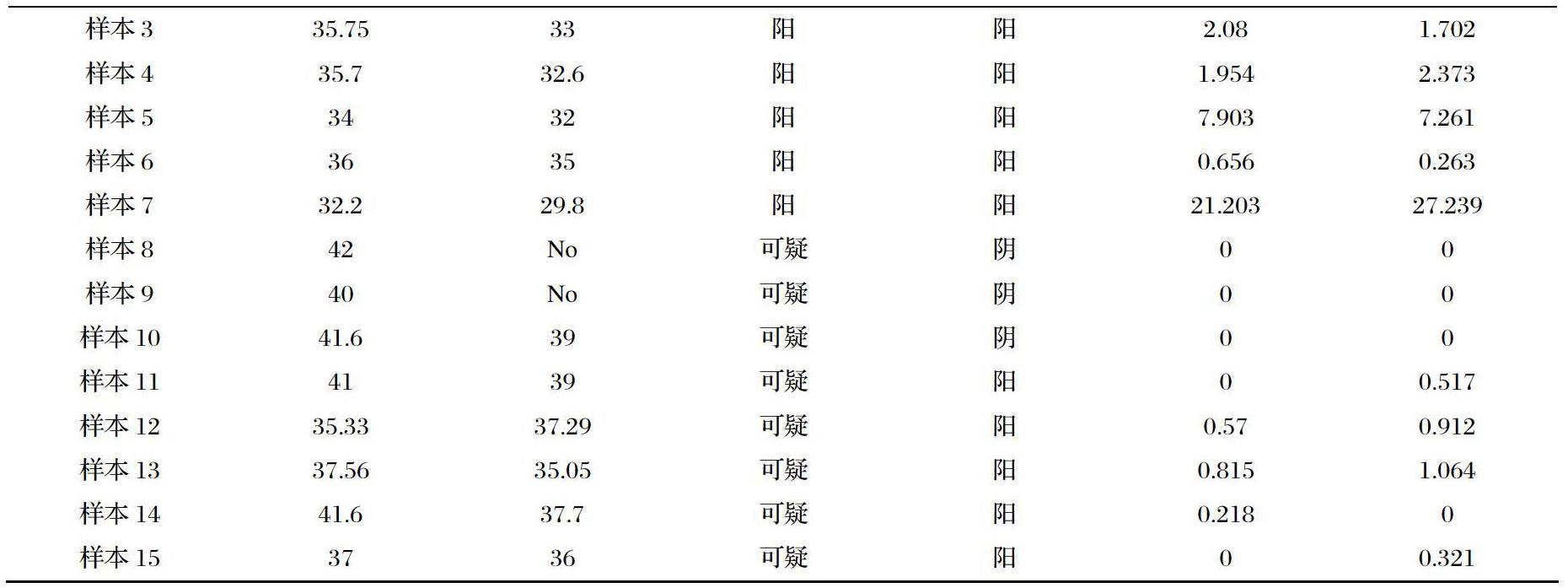
2.3.4临床样本验证
取RT-PCR检测阳性,弱阳性,阴性样本共15例,进行ddPCR检测,见表2。样本1 RT-PCR和ddPCR检测都为阴性;样本2-7,二者都为阳性,样本8-10 RT-PCR结果为疑似,ddPCR结果为阴性。样本11-15 RT-PCR结果为疑似,ddPCR结果为阳性,结果见表2。
2.4讨论
本研究使用领航基因生产的新型冠状病毒核酸检测试剂盒(数字PCR法)以及相配套的仪器,对3例阳性病人鼻咽拭子样本进行绝对定量。通过对比ddPCR定量结果和RT-PCR的Ct值确定二者呈线性相关(图1)。随后,选取1例阳性样本进行梯度稀释,测得ddPCR最低检出限为250 copies/ml,并用其他2例样本进行验证,ORF1ab基因检出率为93.3%,N基因检出率为100%。目前市场上的RT-PCR试剂盒检出限基本为1000 copies/ml[11],但患者的许多样本病毒含量达不到该检出限[12]。另外,笔者对15例样本进行临床样本,表2的结果显示有8例RT-PCR结果为疑似的样本,其中5例样本ddPCR的结果为阳性,3例为阴性,这表明ddPCR在检测低病毒载量样本方面更具有优势,减少假阴性和假阳性结果。这也与Suo[13]和Yu[14]等人的研究结果一致。随着新冠疫情在全球愈演愈烈,国际对于新型冠状病毒核酸检测试剂盒需求急剧上升。
越来越多基于RT-PCR的SARS-CoV-2核酸检测试剂盒被开发并上市,以满足临床大规模分子诊断的需要。目前为止,RT-PCR仍是COVID-19确诊的金标准,但是,受限于检测灵敏度不足,在检测病毒含量低的样本时无法检出信号,常导致假阴性的诊断结果[15]。目前市面上新冠核酸数字PCR试剂盒仅限用于科研,还未用于临床诊断。本研究中对比了RT-PCR和ddPCR两种检测方法对于SARS-CoV-2的检测灵敏度,研究表明,ddPCR能够检出相对较低的病毒载量样本,因此,在新冠病毒的检测中,利用ddPCR技术,能够有效降低样本假阴性和假阳性的产生,是核酸检测的一个重要补充方法,对COVID-19的确诊以及后续治疗效果验证具有重要意义。
参考文献
[1]H S,X H,N J,et al. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan,China: a descriptive study [J]. Lancet Infect Dis,2020,20(4):425-434.
[2]VM C,O L,M K,et al. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR [J]. Euro Surveill.,2020,25(3):
[3]J W,J L,S L,et al. Detection and analysis of nucleic acid in various biological samples of COVID-19 patients [J]. Travel Med Infect Dis,2020,101673.
[4]G S,G L,MJ K,et al. Rapid Detection of COVID-19 Causative Virus (SARS-CoV-2) in Human Nasopharyngeal Swab Specimens Using Field-Effect Transistor-Based Biosensor [J]. ACS Nano,2020,14(4):5135-5142.
[5]R Z,M L,H S,et al. Early detection of SARS-CoV-2 antibodies in COVID-19 patients as a serologic marker of infection [J]. Clin. Infect. Dis.,2020.
[6]X M,HC L,KY D,et al. Artificial intelligence-enabled rapid diagnosis of patients with COVID-19 [J]. Nat. Med.,2020,
[7]Liu R,Han H,Liu F,et al. Positive rate of RT-PCR detection of SARS-CoV-2 infection in 4880 cases from one hospital in Wuhan,China,from Jan to Feb 2020 [J]. Clin Chim Acta,2020,505(172-175.
[8]Valent F,Doimo A,Mazzilis G,et al. RT-PCR tests for SARS-CoV-2 processed at a large Italian Hospital and false negative results among COVID-19 confirmed cases [J]. Infect Control Hosp Epidemiol,2020,1-6.
[9]Kucirka L M,Lauer S A,Laeyendecker O,et al. Variation in False-Negative Rate of Reverse Transcriptase Polymerase Chain Reaction-Based SARS-CoV-2 Tests by Time Since Exposure [J]. Ann Intern Med,2020,
[10]PJ S,SH N,MJ B,et al. Quantitation of targets for PCR by use of limiting dilution [J]. BioTechniques,1992,13(3): 444-449.
[11]Visseaux B,Le Hingrat Q,Collin G,et al. Evaluation of the QIAstat-Dx Respiratory SARS-CoV-2 Panel,the first rapid multiplex PCR commercial assay for SARS-CoV-2 detection [J]. J Clin Microbiol,2020,
[12]Callahan C,Lee R,Lee G,et al. Nasal-Swab Testing Misses Patients with Low SARS-CoV-2 Viral Loads [J]. medRxiv,2020,
[13]Suo T,Liu X,Feng J,et al. ddPCR: a more accurate tool for SARS-CoV-2 detection in low viral load specimens [J]. Emerg Microbes Infect,2020,9(1): 1259-1268.
[14]Yu F,Yan L,Wang N,et al. Quantitative Detection and Viral Load Analysis of SARS-CoV-2 in Infected Patients [J]. Clin Infect Dis,2020,
[15]Arnaout R,Lee R A,Lee G R,et al. SARS-CoV2 Testing: The Limit of Detection Matters [J]. bioRxiv,2020,
作者簡介:周阳:硕士,中国科学院大学宁波华美医院
*通讯作者:张顺,蔡挺
资助项目华美基金,项目编号2020HMZD28;基于数字PCR技术的新型冠状病毒(COVID-19)高灵敏诊断平台,2020YJY0205
