柑橘Rboh家族鉴定及其对激素和柑橘溃疡病的响应
2020-11-16秦秀娟祁静静窦万福陈善春何永睿李强
秦秀娟,祁静静,窦万福,陈善春,何永睿,李强
(西南大学/中国农业科学院柑桔研究所,重庆 400712)
0 引言
【研究意义】柑橘溃疡病(citrus bacterial canker,CBC)是由柑橘黄单胞杆菌柑橘亚种(Xanthomonas citrisubsp.citri,Xcc)引起的检疫性病害,会导致柑橘树木落叶、落果、产量和品质下降,严重影响柑橘产业的健康发展[1-3]。传统防治方法难以根治,会造成巨大的人力、物力投入并影响环境[4]。随着柑橘转基因体系的日趋成熟,通过分子育种的方法高效获得抗溃疡病品种成为可能。通过将抗病基因利用农杆菌介导转入甜橙(Citrus sinensis)增加其抗溃疡病的能力[5]。分子育种相比传统杂交育种具有准确、高效的特点,近年来得到快速发展,运用分子生物学技术培育抗溃疡病柑橘品种也成为防治溃疡病侵害最根本、最有效的方式,而准确筛选候选基因是分子育种的关键[6]。植物应对生物胁迫时会产生大量活性氧(reactive oxygen species,ROS)以抑制病原体生长,或作为植物早期防御反应中的信号分子诱导下游抗性基因表达[7]。活性氧作为植物体内参与胁迫反应和调控植物生长发育的重要物质,其化学性质活泼、具备较强的氧化活性[8]。在植物体内产生机制多样,主要由植物呼吸爆发氧化酶(respiratory burst oxidase homologue,Rboh,又称NADPH氧化酶)介导生成[9-10]。研究呼吸爆发相关基因的功能与调控机理是发掘潜在抗溃疡病候选基因的重要途径。Rboh是参与植物活性氧产生的关键酶,因此,以柑橘为材料,基于全基因组数据,对 Rboh家族进行鉴定、信息学和诱导表达分析,挖掘抗柑橘溃疡病相关成员,对于抗病育种具有重要意义。【前人研究进展】植物Rboh蛋白N端区域含有保守的Ca2+结合EF手性模体结构,在调节NADPH氧化酶活性产生活性氧中起到重要作用[11]。当细胞受到激素、病原等刺激时,细胞产生 Ca2+与Rboh的EF结构结合后激活该酶,使之催化产生大量活性氧。植物Rboh以多基因家族形式存在,因Rboh在抵御胁迫方面的重要功能,越来越多的研究聚焦该家族。从第一个Rboh基因在水稻中被克隆出来后[12],Rboh家族陆续在拟南芥[13]、番茄[14-15]、烟草[16-19]、马铃薯[20-21]、玉米[22]、西瓜[23]、大麦[24-25]、苜蓿[26]和豌豆[27]等植物中得以鉴定和分析,揭示了不同物种该家族的进化和表达特性,为功能研究和机理探索提供了可能。当前,也有很多关于 Rboh在抵御胁迫中的功能研究。在拟南芥和烟草等模式植物中研究发现,该酶介导产生的活性氧参与了植物的逆境胁迫[10];YOSHIOKA等研究发现,NbRbohA和NbRbohB在烟草抗病反应中参与了 H2O2的生成和抵抗致病霉菌(Phytophthora infestans)[18];花叶病毒处理烟草叶片后可增加Rboh酶活性,从而经一系列反应促进H2O2的产生,且水杨酸(salicylic acid,SA)处理可增加NbRbohB的转录水平,最终诱导H2O2的大量积累[28];拟南芥中茉莉酸(jasmonic acid,JA)可诱导AtRbohD和AtRbohF表达升高,并伴随H2O2的积累;茉莉酸处理AtRbohD与AtRbohF双突变体后,H2O2并未明显上升[29];李业等分别利用水杨酸、茉莉酸甲酯(MeJA)和稻黄单胞菌稻致病变种(Xanthomonas oryzaepv.oryzae,Xoo)PX099 处理水稻秧苗,均提高了OsRboh家族部分成员表达量,并伴随H2O2的积累[30];脱落酸(abscisic acid,ABA)处理玉米幼苗,ZmRbohA-D的表达量和活性氧产量均显著升高,表明玉米 Rboh参与了脱落酸诱导的信号途径[31]。【本研究切入点】植物 Rboh受病原体和植物抗病相关激素的诱导,重建活性氧的平衡,进而调控植物对胁迫的抗性。前期对溃疡病菌诱导易感与抗病柑橘品种后的差异表达基因(differentially expressed gene,DEG)研究发现,部分 Rboh家族基因差异明显,这为深入挖掘和研究该家族与柑橘溃疡病抗性提供了依据。【拟解决的关键问题】鉴定并分析柑橘 Rboh家族,探索各成员在生物胁迫信号途径相关激素和柑橘溃疡病菌诱导下的应答模式,分析其与柑橘溃疡病发生的相关性,挖掘有潜力的候选基因用于抗溃疡病分子育种。
1 材料与方法
1.1 植物材料与菌体
2019年6月在西南大学温网室和国家柑桔品种改良中心育种圃(坐标:19°51′N,106°37′E)选取晚锦橙(Wanjincheng)和四季橘(Calamondin)叶片为材料进行诱导表达分析。供试溃疡病菌为西南大学柑桔研究所保存的柑橘黄单胞杆菌柑橘亚种A株系[2]。
1.2 CsRboh 家族鉴定
甜橙基因组和蛋白组数据下载于 Phytozome( https://phytozome.jgi.doe.gov/pz/portal.html)[32]和CAP 数据库(http://citrus.hzau.edu.cn/orange/)[33-34]。采用三步法对柑橘Rboh家族进行序列注释[35]。首先,从 RedOxiBase(https://peroxibase.toulouse.inra.fr/)[9,36]获取拟南芥 Rboh蛋白序列,与柑橘蛋白序列文件比对获得柑橘 Rboh蛋白序列;去掉错误和重复并从NCBI数据库中检测 EST(expressed sequence tag)支持,对上述错误进行校正;最终得到的 Rboh蛋白序列利用SCIPIO[37]获得相应染色体定位、基因和基因编码序列(CDS)。鉴定过程中使用蛋白质功能域分析工具 Pfam[38]和柑橘基因组变异数据库(CitGVD)[39]对其进行功能注释。
1.3 CsRboh 信息学分析
使用 ExPASy Proteomics Server(http://web.expasy.org/protparam/)分析 Rboh理化性质[40];CELLO[41](http://cello.life.nctu.edu.tw/)预测亚细胞定位;MEGA 7.0[42]分析系统发育关系(最大似然法,maximum likelihood method);GSDS[43](http://gsds.cbi.pku.edu.cn/)和Mapchart展示Rboh基因结构和染色体定位;MEME(http://meme-suite.org/tools/meme)[44]分析 Rboh 蛋白保守基序;PRABI(https://npsa-prabi.ibcp.fr/cgibin/npsa_automat.pl?page=npsa_sopma.html)分析蛋白二级结构;Pfam(http://pfam.xfam.org/)[38]分析功能结构域;PLANTCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析启动子顺式作用元件。
1.4 植物激素和柑橘溃疡病菌诱导处理
根据 LI等[45]的方法对晚锦橙和四季橘叶片进行处理,简述如下:采集成熟叶片(约3月龄)用75%的乙醇消毒后置于无菌培养皿;注射接种溃疡病菌菌液(OD600=0.5);于28℃光照培养;分别于0、12、24、36和48 h切取接种部位。叶圆片(直径7 mm)分别浸泡于茉莉酸(100 μmol·L-1)、脱落酸(100 μmol·L-1)、水杨酸(10 μmol·L-1)溶液和无菌水(对照)置于28℃光照培养,0、12、24、36和48 h取样。
上述样品使用RNA提取试剂盒提取总RNA(艾德莱,北京),使用反转录试剂盒(TaKaRa,日本)反转录为cDNA,利用实时荧光定量PCR(qRT-PCR)检测各样品中基因的相对表达量。
1.5 qRT-PCR 与统计分析
使用 NCBI Primer Blast根据CsRboh和柑橘内参基因CsActin(GenBank:GU911361.1)特异性区域设计qRT-PCR引物(表1)。利用ChamQTMUniversaL SYBR qPCR Master Mix(诺唯赞,南京)将溃疡病菌、激素处理的叶片cDNA分别进行实时定量检测。每个处理进行3次生物学重复和3次技术重复;相对表达量采用 2-ΔΔCt法计算(ΔCt=CtCsKat01-CtCsActin)[46];使用SPSS V25(IBM,美国)进行差异显著性分析。
2 结果
2.1 CsRboh家族鉴定和理化性质
对柑橘全基因组范围内 Rboh家族进行了鉴定和理化性质分析,最终从柑橘基因组中鉴定到7个Rboh成员。这些基因编码蛋白的长度在 784(CsRboh07)—946(CsRboh01)aa;其分子量变化范围为89 837.0—106 370.8 Da;等电点(PI)分布在 8.67(CsRboh05)—9.40(CsRboh01),均为碱性蛋白;该家族基因编码的蛋白质亲水性平均值分布在-0.015(CsRboh07)—-0.299(CsRboh02),除CsRboh07外,其他成员均为亲水性蛋白。CsRboh04编码的氨基酸脂肪指数最低(82.61),CsRboh07的最高(89.06),其余脂肪指数分布在 83.84—87.68。蛋白质不稳定系数分布在40.42—50.16,其中CsRboh01最不稳定。经 CELLO分析,柑橘CsRboh在细胞内膜(CsRboh04、CsRboh06和CsRboh07)、细胞外膜(CsRboh01和CsRboh03)、细胞质(CsRboh02和CsRboh05)均有分布(表2)。
二级结构分析发现,这些蛋白均由α-螺旋、β-转角、伸展链和不规则卷曲构成,且主要以α-螺旋为主(41.83%—44.61%),其次是不规则卷曲(34.87%—38.29%),占比较少的为伸展链(13.85%—16.28%)和β-转角(4.19%—5.48%)(表3)。柑橘Rboh家族各序列信息已提交至RedOxiBase数据库[9],其登录号为13472—13476、13487—13488。
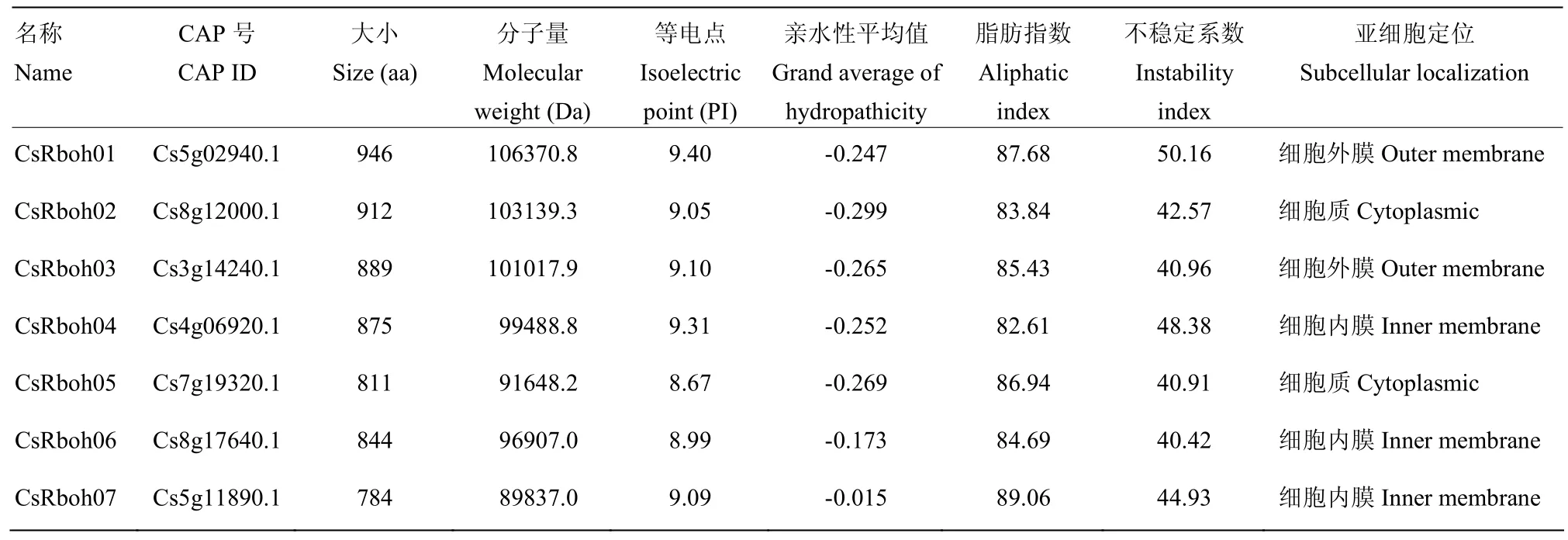
表2 CsRboh家族成员信息Table 2 The information of CsRboh family
2.2 CsRboh家族系统进化分析
为了研究 Rboh家族在多个物种中的进化关系,使用最大似然法构建了包含柑橘、拟南芥和杨树3个物种Rboh家族的系统发育树(图 1)。根据系统进化树,3个物种的27个Rboh蛋白(柑橘7个、拟南芥10个、杨树10个)可划分为I—IV 4个亚家族,其中I亚家族又可以分为A、B两个分支。4个亚家族分别包含3、2、1和1个柑橘Rboh成员。值得注意的是第IV亚家族为柑橘所特有,且只含有1个Rboh成员(CsRboh07),表明CsRboh07是进化过程形成的柑橘特有的酶,可能具有特殊功能。
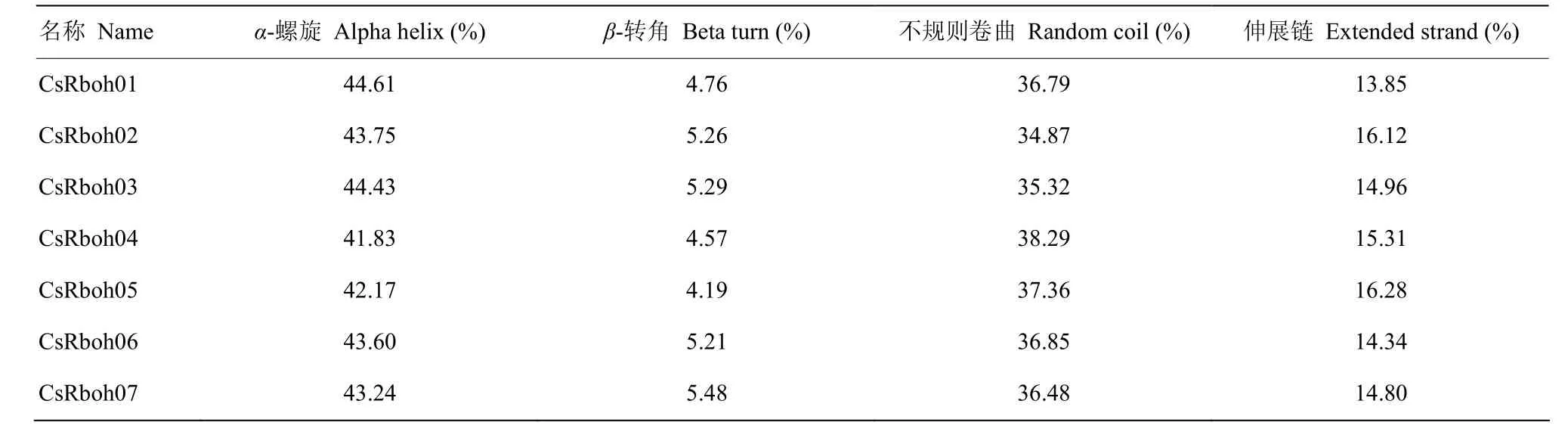
表3 CsRboh的二级结构Table 3 The secondary structure of CsRbohs
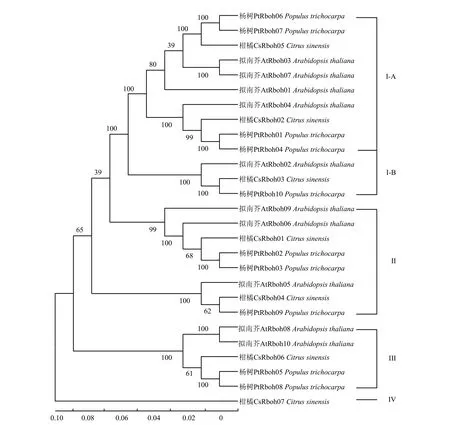
图1 多物种Rboh家族系统进化树Fig. 1 The phylogenetic tree of Rboh family in several organisms
2.3 CsRboh家族染色体定位和基因结构
对CsRboh在染色体上的定位进行分析和展示,发现CsRboh不均匀地分布于柑橘的5条染色体上(图2),其中,CsRboh03定位于3号染色体,CsRboh04位于4号染色体,CsRboh01和CsRboh07定位于5号染色体,CsRboh05位于 7号染色体,CsRboh02和CsRboh06定位于8号染色体。为更好地了解CsRboh的结构特点,利用 GSDS[43]对 CsRboh的基因结构进行了分析和展示(图2),发现7个基因均含11—13个外显子;结合系统进化树,发现相同亚家族基因具有相似基因结构,但内含子并非完全一致,其长度上有较大变异;柑橘Rboh家族第I亚家族中的基因均含11个外显子,CsRboh03与CsRboh02、CsRboh05相比,基因的内含子长度变异较大;第II亚家族中的基因具有12个外显子;第III亚家族中CsRboh06有12个外显子;第IV亚家族中的CsRboh07有13个外显子;III和IV亚家族中两个基因均无UTR区域。
2.4 CsRboh家族多序列比对及功能结构域
利用Pfam对7个CsRboh进行功能结构域分析,结果表明CsRboh家族成员均含有典型的4个功能结构域,从N端起分别为呼吸爆发NADPH氧化酶结构域(respiratory burst NADPH oxidase,NADPH_Ox,PF08414.10)、铁还原酶跨膜组件(ferric reductase like transmembrane component,Ferric_reduct,PF01794.19)、FAD 结合结构域(FAD-binding domain,FAD_binding,PF08022.12)和铁还原酶 NAD 结合结构域(ferric reductase NAD binding domain, NAD_binding,PF08030.12)(图3-A)。蛋白序列的比对发现NADPH氧化酶结构域为207—308号氨基酸、铁还原酶跨膜组件为514—677号氨基酸、FAD结合结构域为720—851号氨基酸、铁还原酶NAD结合结构域为856—1 070号氨基酸,这些结构域高度保守(图3-B)。
2.5 CsRboh家族保守基序分析
利用MEME对CsRboh家族保守基序进行预测,得到15个相关性最高的保守元件(图4-A),并整合基序的 Logo(图 4-B)。CsRboh01、CsRboh03和CsRboh04均包含 15个保守基序,CsRboh05和CsRboh06包含14个,CsRboh02、CsRboh07包含12个;除CsRboh02没有 Motif 5、Motif 9、Motif 10,其他 6 个成员均含有;Motif 1、Motif 2、Motif 3、Motif 6、Motif 8、Motif 12 和 Motif 13 共 7 个保守基序为 7个CsRboh共有,且分布几乎一致;结合Pfam分析的功能结构域(图3),发现这7个共有基序对应CsRboh的功能结构域。
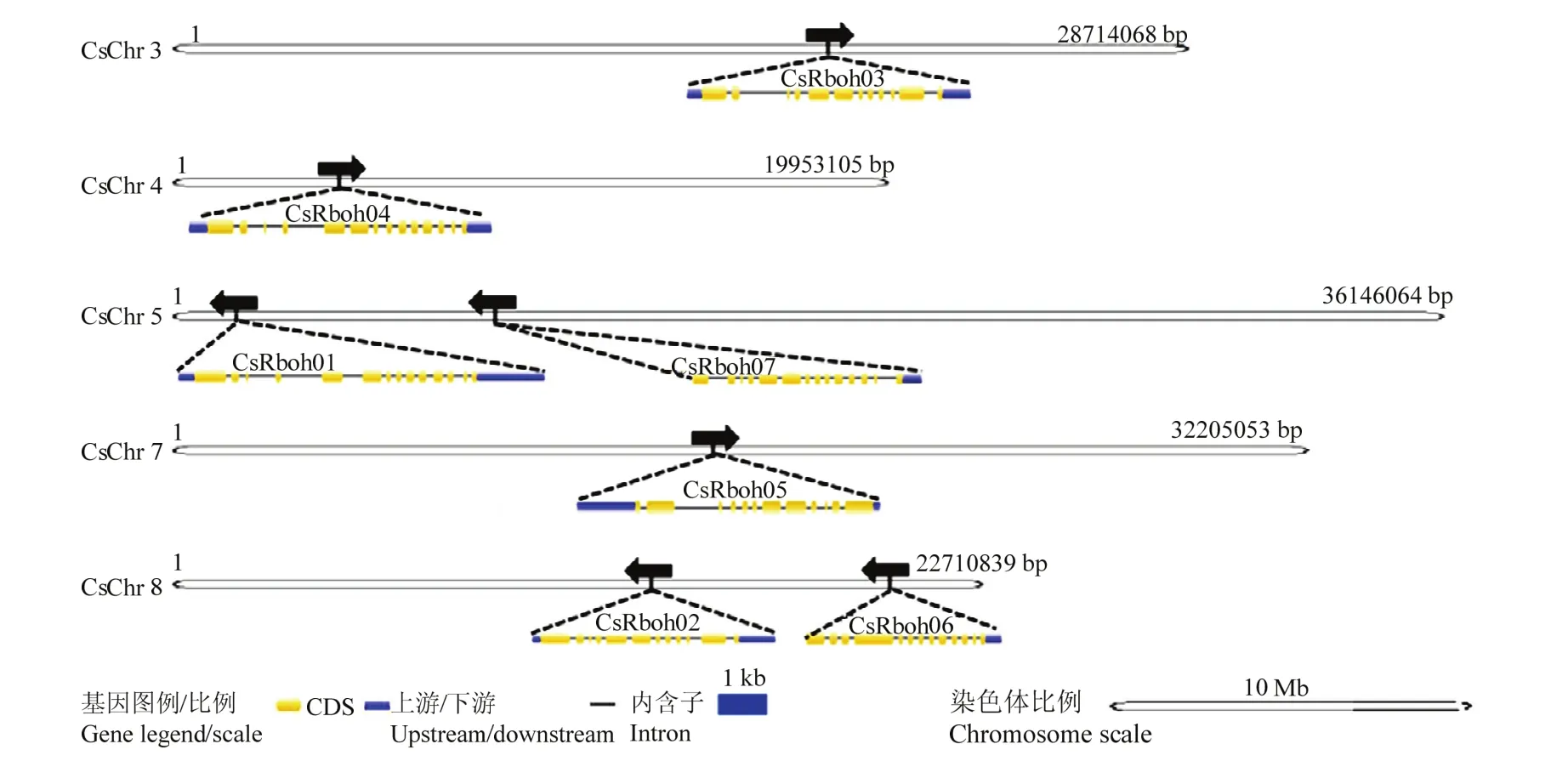
图2 CsRboh家族的染色体定位和基因结构Fig. 2 The chromosomal loci and gene structures of CsRbohs
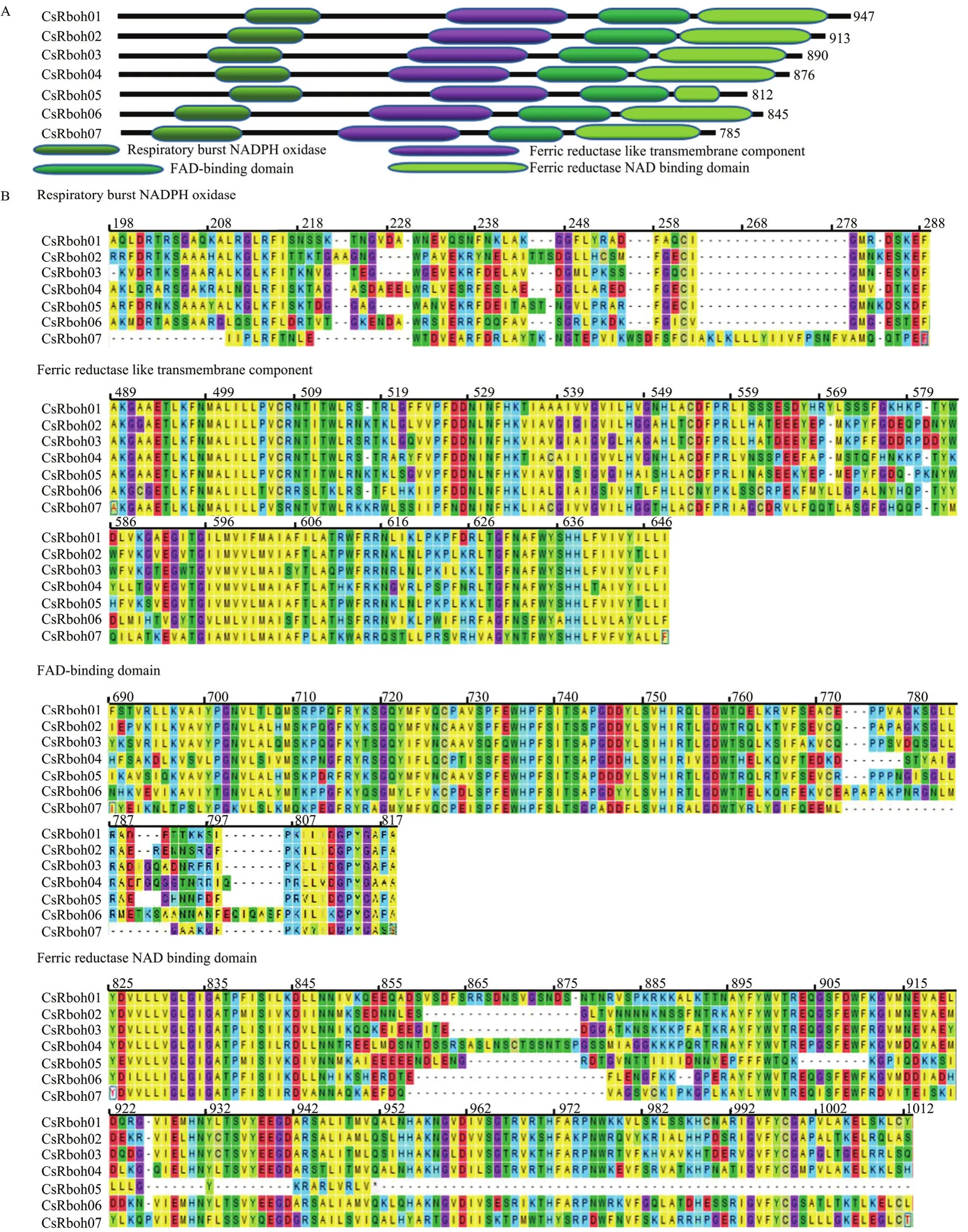
图3 CsRboh家族的功能结构域Fig. 3 The functional domains of CsRbohs

图4 CsRboh家族蛋白保守基序Fig. 4 Conserved protein motifs in CsRboh family
2.6 CsRboh家族启动子顺式作用元件分析
为深入了解 CsRboh家族基因对逆境信号的胁迫机制以及基因的诱导表达模式,对柑橘 Rboh的核心启动子顺式作用元件进行分析,发现植物抗病信号有关的 3种植物激素响应元件茉莉酸响应元件(CGTCA-motif)、脱落酸响应元件(ABRE)和水杨酸响应元件(TCA-element)在7个基因中呈现不均匀分布(表4)。除CsRboh05外,其余6个基因启动子均含有茉莉酸响应元件,数量在1—3个。水杨酸响应元件在该基因家族中较少,仅在CsRboh01、CsRboh02、CsRboh06中各包含1个。除CsRboh07外,其余基因均包含1—7个脱落酸响应元件。
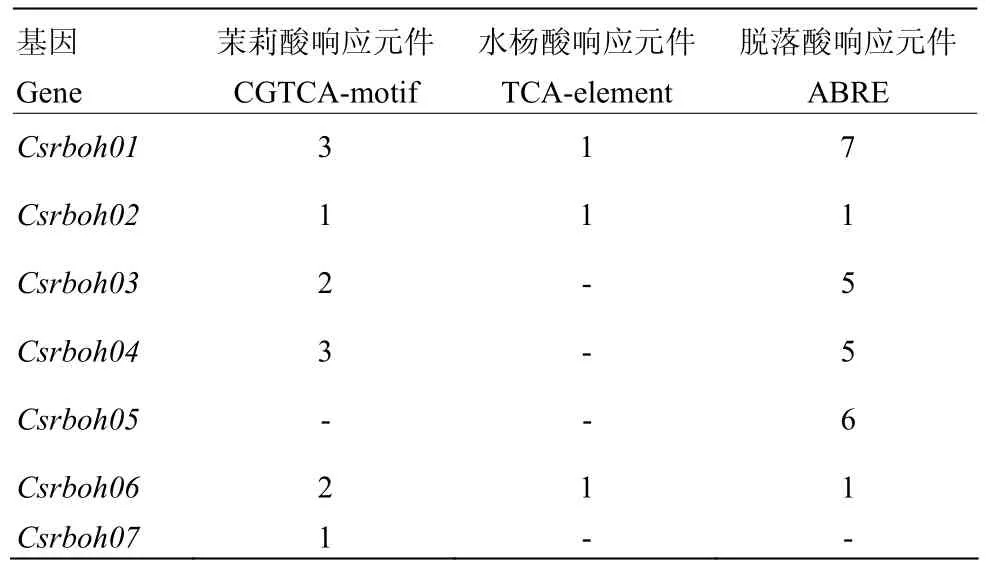
表4 CsRboh上游2 kb顺式作用元件分布Table 4 Putative cis-acting elements existed in the 2 kb upstream region of CsRbohs
2.7 植物激素诱导下CsRboh表达模式
在晚锦橙和四季橘叶片中,7个CsRboh表达均受脱落酸、茉莉酸和水杨酸诱导,但其诱导模式存在差异(图5—图7)。
脱落酸诱导时,CsRboh03、CsRboh04、CsRboh07在两个品种中诱导表达模式不同。晚锦橙中,CsRboh03在0—36 h内表达量先上升,后急剧下降;四季橘中,0—12 h内上调表达,12—36 h表达量下降,之后上升至最高水平。CsRboh04在两个品种中表达模式类似,0—24 h表达量逐步下降,之后上升。两个品种中CsRboh07也对脱落酸有明显响应,晚锦橙中,0—12 h内上调表达,后期呈下降、上升、下降的趋势;四季橘中则是在处理前24 h一直上调表达,之后表达量下降。其他基因虽响应脱落酸诱导,但效果并不明显(图5)。
茉莉酸诱导时,CsRboh01、CsRboh03、CsRboh05、CsRboh06和CsRboh07在四季橘中表达均先上升后下降,36 h达到最高,而在晚锦橙中CsRboh03和CsRboh07表达模式相似,CsRboh01、CsRboh05和CsRboh06无明显诱导。CsRboh02受茉莉酸诱导表达模式相反,晚锦橙中CsRboh02表达量先下降再上升,四季橘中CsRboh02表达量则先上升后下降(图6)。
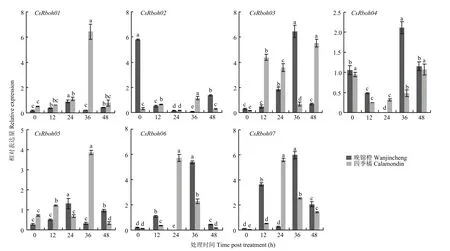
图5 脱落酸诱导下CsRboh的相对表达量Fig. 5 The relative expression of CsRbohs induced by ABA
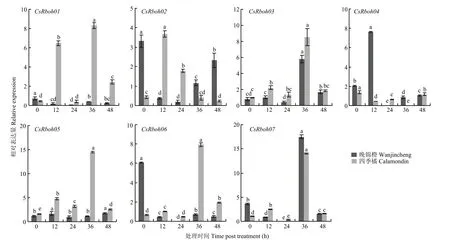
图6 茉莉酸诱导下CsRboh的相对表达量Fig. 6 The relative expression of CsRbohs induced by JA
水杨酸诱导时,晚锦橙中CsRboh01、CsRboh04、CsRboh05和CsRboh06表达量总体呈先升后降趋势,四季橘中这4个基因受水杨酸诱导不明显;CsRboh02、CsRboh03和CsRboh07在两个品种中受水杨酸诱导趋势相似(图7)。
2.8 柑橘溃疡病菌诱导下CsRboh表达模式
溃疡病菌侵染后,7个基因在两个品种中均有不同程度的响应(图8)。晚锦橙中,CsRboh01、CsRboh04表达量变化总体呈现先升后降趋势,CsRboh02、CsRboh06、CsRboh07表达量呈现出先升、后降、再升的趋势,CsRboh03、CsRboh05表达量变化为先降、后升、再降的趋势。四季橘中,CsRboh01、CsRboh05和CsRboh06表达呈现先降、后升、再降的趋势,CsRboh05则在 36—48 h内表达量再次升高。CsRboh03、CsRboh07表达量先升后降,CsRboh02、CsRboh04则是先升、后降、再升的趋势,CsRboh04在最后一个时间段内表达量出现下降。CsRboh02、CsRboh05和CsRboh07在两个品种中具有相似诱导趋势。除CsRboh07外,其他CsRboh表达量均在24 h达到最高。CsRboh04、CsRboh06在晚锦橙和四季橘两个品种中诱导总体趋势基本相反。
3 讨论
植物体在应对多种生物胁迫时产生大量的活性氧以对抗外界病原菌并激活信号转导途径,而 Rboh可控制植物体内活性氧产生来影响植物抗病性[47]。因此,越来越多的研究聚焦于Rboh的结构和功能分析。Rboh在不同物种中基因家族数目不同,在水稻[30]、拟南芥[28]、小麦[48]和烟草[49]中Rboh家族分别有9、10、5和20个基因成员,而本试验发现柑橘中有7个基因编码CsRboh蛋白(CsRboh01-07)。基因家族大小的不同与家族中基因复制事件相关,在烟草中含有较多的复制事件,使该家族得以扩张[49],而柑橘中并没有基因复制。各物种中Rboh家族均包含4个功能结构域,分别为呼吸爆发NADPH氧化酶结构域、铁还原酶跨膜组件、FAD结合结构域和铁还原酶NAD结合结构域。这些结构在进化上高度保守,是植物 Rboh的显著特征,也是发挥功能产生活性氧的前提。Rboh在不同物种中基因家族编码产物大多位于细胞膜,拟南芥和柑橘中分别有8和5个基因编码蛋白位于细胞膜,但葡萄中的一些 Rboh预测发现其位于叶绿体的类囊体膜上[50],这类酶亚细胞定位的多样性可能与该酶参与不同的胁迫应答有关。
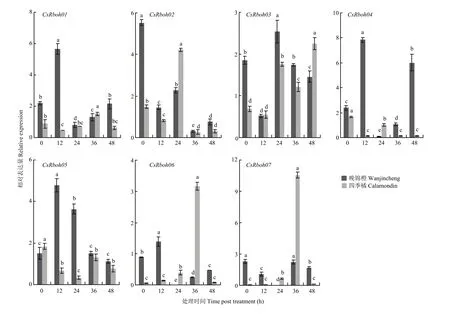
图7 水杨酸诱导下CsRboh的相对表达量Fig. 7 The relative expression of CsRbohs induced by SA
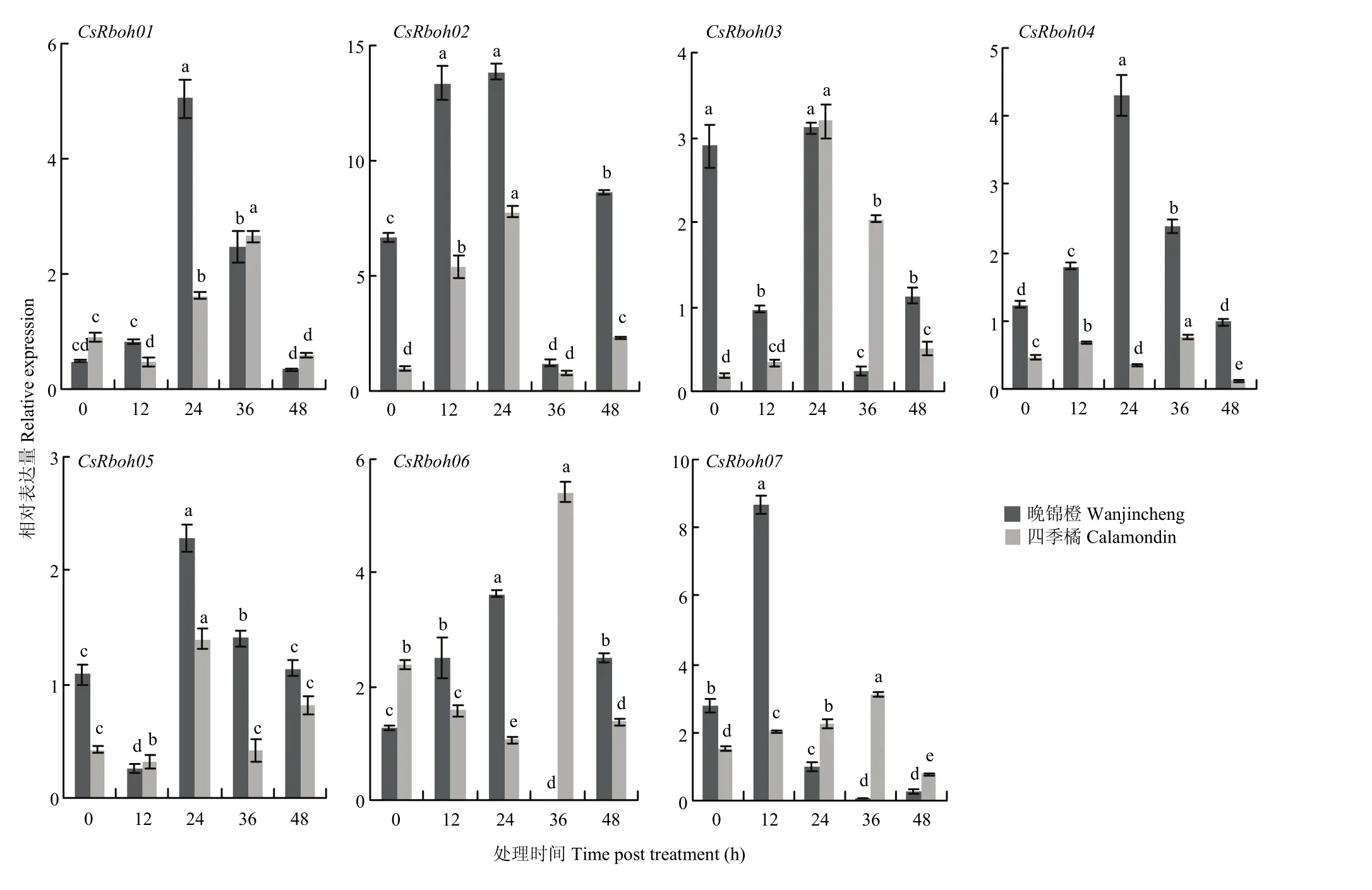
图8 柑橘溃疡病菌侵染诱导CsRboh的相对表达量Fig. 8 The relative expression of CsRbohs induced by Xcc infection
有研究发现将水杨酸喷施到拟南芥上,不仅诱导病原相关蛋白(PR)基因的上调表达,而且能获得系统性抗性,从而使植物对病原菌的抵抗能力普遍增强[51]。植物激素与植物抗病密切相关,但不同激素的信号途径交叉,有时相互拮抗[52]。本研究检测了 7个CsRboh在3种与生物胁迫应答相关的植物激素和溃疡病菌诱导下的表达情况,证实了某些成员在不同激素和溃疡病菌诱导下的表达模式,供试 qRT-PCR引物根据 Rboh家族基因保守结构域设计,确保两个品种 qRT-PCR结果可以真实反映 CsRboh在溃疡病抗、感品种中的表达模式。其中,CsRboh02均可响应柑橘溃疡病菌及3种植物激素的诱导。顺式作用调控元件常在应激条件下对基因转录进行关键的分子调控[53],CsRboh02响应激素诱导可能与其启动子元件中含有茉莉酸响应元件CGTCA-motif、水杨酸响应元件TCA-element和脱落酸响应元件ABRE有关,推测CsRboh02可能由于启动子区域含有激素响应元件响应脱落酸、茉莉酸和水杨酸,通过调节激素变化响应溃疡病菌诱导从而参与柑橘抗病过程。通过蛋白质序列比对发现CsRboh02与拟南芥AtRbohD、烟草NbRbohD具有较高同源性。AtRbohD可参与病原体诱导的活性氧产生和寡半乳糖苷诱导的植物免疫,从而抵御外界病原菌侵染[54]。另外,AtRbohD在活性氧依赖的脱落酸信号传导中起着重要作用,并参与植物防御反应期间活性氧中间体的积累[55]。YOSHIOKA等[18]研究表明NbRbohD、NbRbohA和NbRbohB也直接参与对真菌病原的抗性。CsRboh02在其他物种中的同源基因多与植物抗病性相关,且本研究发现CsRboh02在柑橘溃疡病菌诱导下表达水平明显高于家族其他基因,在溃疡病菌侵染的前24 h内,在抗病品种四季橘中CsRboh02上调表达,表明该基因参与柑橘的基础免疫。不过,CsRboh02表达量增长幅度高于晚锦橙,可能在抗病品种中经溃疡病菌诱导产生更多的H2O2,从而激活植物过敏反应。综上,该基因可能在柑橘抗溃疡病发生的早期发挥着关键的基础免疫作用,可在后续对其功能进行深入研究。
溃疡病菌侵染后,CsRboh04表达量在感病品种晚锦橙和抗病品种四季橘中明显不同,在晚锦橙中CsRboh04表达量受溃疡病菌诱导明显,表达量明显高于四季橘(图 8)。且前期通过 CAP甜橙数据库(http://citrus.hzau.edu.cn/orange/)对CsRboh04表达量预测时发现其在叶片中的表达量仅为0.3,其真实表达量较低,这与溃疡病菌诱导后CsRboh04在四季橘中表达量较低的情况相一致。系统进化树中聚类关系相近的基因之间可能具有类似的功能[56],结合系统进化树及其蛋白质同源序列比对发现拟南芥中AtRbohE为CsRboh04的同源基因,尽管尚未阐明AtRbohE的作用,但有研究表明,在生物胁迫期间,其启动子区域中存在伤口反应元件(W-box)[57]。W-box可与WRKY转录因子家族的成员相互作用,在生物胁迫中发挥关键作用[51]。大量研究证明 WRKY家族大部分基因都参与植物抗病反应[58]。由此可推断CsRboh04在柑橘中可能参与抗病。
本试验中,溃疡病菌诱导24 h内,CsRboh06在感病品种晚锦橙中表达量逐渐上调,在抗病品种四季橘中逐渐下调,在抗、感品种中表达趋势基本相反,且顺式作用元件分析发现该基因在启动子区域均包含脱落酸、水杨酸、茉莉酸响应元件,CsRboh06也受到相应激素不同程度的诱导表达,推断CsRboh06可能通过响应植物激素信号代谢通路进一步参与植物抗病过程。系统进化树聚类分析发现,AtRboh08(H)、AtRboh10(J)、PtRboh05、PtRboh08与CsRboh06同属第3组。目前对杨树中Rboh的功能研究相对较少,仅有部分研究发现拟南芥中NADPH氧化酶RbohH和RbohJ在花粉中特异表达,共同参与植物花粉管的生长发育,是重要的花粉基因[59]。CsRboh06在抗、感品种中所表现出的完全不同的表达情况及其与植物抗病反应的相关性均有必要在后续试验中进行功能的深入挖掘,不仅可为其他物种中相关基因的功能研究提供参考,也能为柑橘抗溃疡病分子育种抗病基因的筛选提供依据。相关研究表明,受柑橘溃疡病菌诱导后基因的表达差异性可能与抗病过程相关,比如CsBZIP40[3]、CsXTH04[60]和CsAP2-09[6]等在抗、感品种中以相反模式响应溃疡病菌侵染的基因,经功能验证均与溃疡病发生有紧密关系。综合以上分析,推断CsRboh02、CsRboh04、CsRboh06为有潜力的抗溃疡病候选基因。
4 结论
基于柑橘全基因组数据鉴定到7个Rboh基因;定位在柑橘5条染色体上,编码蛋白均含有Rboh保守结构域;CsRboh02、CsRboh04和CsRboh06在抗、感品种中受柑橘溃疡病菌诱导表现出不同的表达模式,推测其可能与柑橘对溃疡病抗性相关。
