Copine-8在胃癌组织中的表达与临床病理特征及预后的相关性
2020-11-16尹松祥
尹松祥
胃癌是世界范围内最常见的恶性肿瘤,尤其晚期胃癌患者预后较差,发病率及病死率在所有恶性肿瘤中位居前列,严重危害人类的生命健康[1-2]。在我国,胃癌在男性和女性的恶性肿瘤发病率分别居第2位和第4位,病死率居第2位[3]。早期大多数胃癌患者临床症状不典型、早诊率低,确诊时患者多处于中晚期,导致患者预后较差[4]。因此,研究胃癌的发病机制,筛选出胃癌早期诊断及预后的标志物迫在眉睫[5]。Copine-8(CPNE8)作为Copines家族成员之一,分布广泛而且高度保守,其通过依赖钙离子结合方式在调控细胞内的信号转导和膜的转运中发挥重要作用[6-7]。较多研究发现,CPNE8参与了多种实体肿瘤的发生发展,其表达改变影响患者预后[8]。目前,CPNE8在胃癌中的表达水平及生物学功能仍不清楚。因此,本研究通过免疫组织化学技术分别检测CPNE8在胃癌组织及癌旁组织中的表达,并分析其表达与胃癌临床病理参数和预后的关系。
1 资料与方法
1.1 一般资料
收集2011年3月—2014年3月于仙桃职业学院附属医院行胃癌根治术并经过病理证实的胃癌组织标本144例和距癌灶边缘5 cm以上且经病理证实为正常胃黏膜的癌旁组织。144例患者中,男76例,女68例;≤60岁者66例,>60岁者78例;中高分化患者80例,低分化患者64例;TNM分期中Ⅰ~Ⅱ期61例,Ⅲ~Ⅳ期83例。本研究经仙桃职业学院附属医院伦理委员会批准通过,在组织样本收集之前均获得患者知情同意并签署了知情同意书。
1.2 免疫组化
采用链霉菌抗生物素蛋白-过氧化物酶连结(Streptavidin-perosidase,SP)法检测CPNE8的表达,对石蜡块做4 μm厚连续切片,随后用梯度乙醇水化脱蜡,3%的过氧化氢10 min以去除内源性过氧化物酶活性,磷酸盐缓冲盐水(Phosphate buffered solution,PBS)洗涤,高温高压修复切片10 min,随后滴加兔抗人CPNE8一抗(购于英国Abcom公司,1∶200),4℃孵育过夜,次日,PBS洗涤3次,滴加二抗室温孵育20 min。最后用二氨基联苯胺试剂盒(福州迈新生物技术公司)对载玻片进行染色,再通过苏木素(福州迈新生物技术公司)复染,中性树胶封片。
1.3 免疫组化染色结果判定
最终免疫组化结果判读是基于每个标本的染色强度和范围的乘积进行综合评分,由两位经验丰富的病理科医生镜下随机选取5个高倍镜视野(400×),每个视野计数100个肿瘤细胞。染色强度按照以下标准进行评分:未着色为0分;浅黄色或黄色为1分;棕黄色为2分;棕色或棕褐色为3分。染色范围:无阳性细胞为0分;≤10%为1分;10%~50%为2分;≥51%为3分。CPNE8表达强度的总分评判:≥3分为高表达;<3分为低表达。CPNE8在胃癌组织中的高表达率=CPNE8在胃癌组织高表达数/总石蜡组织数×100%。
1.4 随访
通过电话和/或查阅病历的方式进行随访调查,所有患者随访至术后5年。总生存期(Overall survival,OS)指从出院当日开始至因任何原因死亡或末次随访日期。无病生存期(Disease-free survival,DFS)指从出院开始到患者出现疾病复发或由于疾病进展导致患者死亡的时间。
1.5 统计学方法
采用SPSS 21.0软件和Graphpad 7.0软件进行统计分析。计数资料以百分率(%)表示,采用McNemar检验比较胃癌组织与癌旁组织中CPNE8阳性表达率,采用χ2检验分析CPNE8表达与临床病理参数的关系。生存曲线绘制和比较采用Kaplan-Meier分析和Log-rank检验。采用Cox比例风险模型进行单因素和多因素预后分析,采用受试者工作特征(Receiver operating characteristic,ROC)曲线的曲线下面积(Area under curve,AUC)和Hosmer-Lemeshow拟合优度指标进行预测和拟合效能评价,P<0.05为差异有统计学意义。
2 结果
2.1 CPNE8在胃癌组织及癌旁组织中的表达
免疫组化结果表明,CPNE8在胃癌组织中表达较深,呈棕褐色,主要分布于细胞质中;而在癌旁组织中染色强度较浅,呈淡黄色或无着色(图1)。CPNE8在胃癌组织中阳性表达率为63.9%(92/144),在癌旁组织中的阳性表达率为26.4%(38/144),采用McNemar检验,CPNE8在胃癌组织与癌旁组织中的阳性表达率差异有统计学意义(χ2=36.450,P<0.001)(表1)。

图1 CPNE8在胃癌及癌旁组织中的表达水平(SP×200)Figure 1 The expression of CPNE8 in gastric cancer and adjacent tissues(SP×200)Note:A.The expression of CPNE8 in paracancerous tissue;B.The weak expression of CPNE8 in gastric cancer tissue(-);C.The low to moderate expression of CPNE8 in gastric cancer tissue;D.The strong expression of CPNE8 in gastric cancer tissue.

表1 CPNE8在胃癌组织及癌旁组织的表达
2.2 CPNE8表达与胃癌临床病理特征的关系
CPNE8的表达与胃癌患者的TNM分期及有无淋巴结转移有关(χ2=5.993,P=0.014;χ2=6.703,P=0.009),而与患者性别、年龄、肿瘤分化程度及T分期均无关(P>0.05)(表2)。
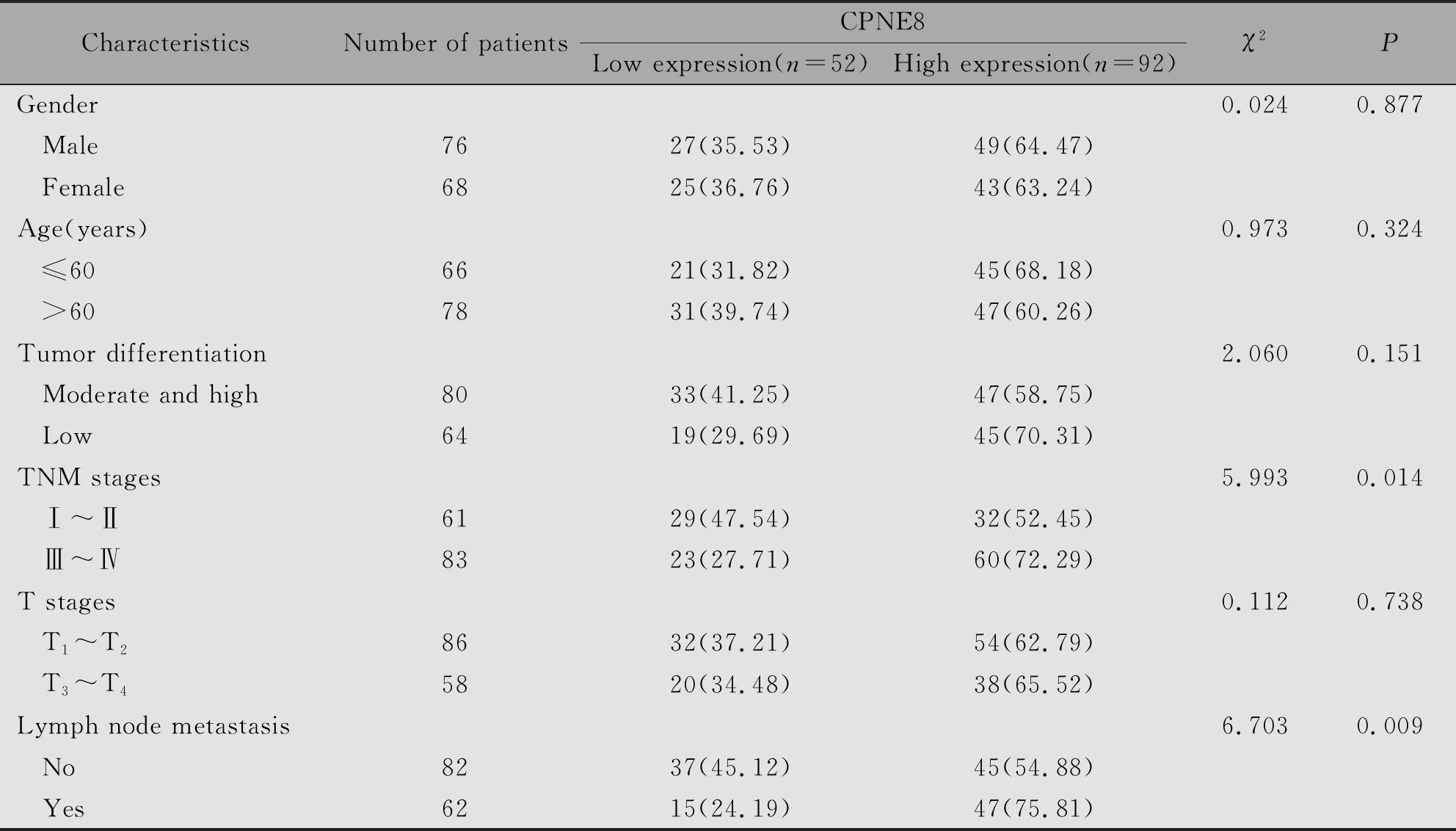
表2 CPNE8表达水平与胃癌临床病理特征的关系[n(%)]
2.3 CPNE8的表达与胃癌患者预后的关系
CPNE8高表达患者的OS范围为4~48个月,中位OS为20.0个月;CPNE8低表达患者的OS范围为6~60个月,中位OS为43.0个月;Kaplan-Meier分析结果表明CPNE8高表达患者的OS较CPNE8低表达患者明显缩短(χ2=23.130,P<0.001)。CPNE8高表达患者的DFS为3~45个月,中位无病生存期为16.0个月;CPNE8低表达患者的DFS为3~59个月,中位DFS为42.0个月;Kaplan-Meier分析结果表明CPNE8高表达患者的DFS较CPNE8低表达患者明显缩短(χ2=21.570,P<0.001)(图2)。

图2 CPNE8表达对胃癌患者术后预后生存曲线Figure 2 The survival curve of postoperative prognosis of gastric cancer patients with CPNE8 expression
2.4 影响胃癌患者OS的危险因素分析
单因素Cox回归分析结果显示,TNM分期、T分期、淋巴结转移、远处转移和CPNE8表达可能是胃癌患者OS的影响因素(P<0.05);进一步采用多因素Cox回归分析,结果显示TNM分期、淋巴结转移和CPNE8表达是影响胃癌患者OS的独立危险因素(P<0.05)(表3,表4)。

表3 胃癌患者OS危险因素的单因素分析

表4 胃癌患者OS危险因素的多因素分析
2.5 影响胃癌患者PFS的危险因素分析
在单因素Cox回归模型分析结果显示,TNM分期、淋巴结转移和CPNE8表达是胃癌患者PFS的影响因素(P<0.05);进一步采用多因素Cox回归分析,结果显示TNM分期和CPNE8表达是影响胃癌患者PFS的独立危险因素(P<0.05)(表5,表6)。

表5 胃癌患者PFS危险因素的单因素分析

表6 胃癌患者PFS危险因素的多因素分析
3 讨论
CPNE8蛋白首次在急性髓性白血病(Acute myeloidleukemia,AML)患者中被发现,属于Copines蛋白家族的成员,其与Copine-1、Copine-3、Copine-5蛋白具有相当高的同源性[9]。研究发现,CPNE8基因包含CPNE8-A和CPNE8-B两种亚型,CPNE8在人体大部分组织中表达较低或不表达,在大脑、肾脏、心脏、前列腺等器官中表达较高[10-11]。CPNE8属于钙依赖性磷脂膜结合蛋白,其定位在细胞膜上,在物质运输、能量转换、有丝分裂及信号转导中起着至关重要的生物学作用[12]。有研究报道多种肿瘤中存在CPNE8的异常表达或缺失,然而其在肿瘤中的生物学功能及其相关作用机制仍未阐明清楚。
Ramsey等[13]研究发现AML患者出现复发是由于AML1等位基因出现易位,进一步研究发现染色体上AML1基因与CPNE8基因发生融合,从而造成AML1基因的截断突变,使其失去了转录激活功能,而被截断的AML1可以阻碍细胞分化。作者推断CPNE8基因在AML组织中发生截断突变使得治愈后的急性白血病复发,其可能是增殖的负调控因子。Bu等[14]发现CPNE8参与乳腺的恶性进程,其表达水平与乳腺癌患者的临床病理特征密切相关。Nagasawa等[15]通过对27例日本卵巢癌患者标本进行RNA测序,通过主成分分析(PCA)对测序结果进行功能注释分析,并在PCA的基础上对所选基因进行敲除实验,结果表明,敲除CPNE8和BHLHE41的表达可明显抑制卵巢癌细胞的增殖能力。表明下调CPNE8表达可抑制肿瘤细胞增殖,其可能作为“原癌基因”参与卵巢癌的发生与发展。另外,有研究报道microRNAs可作为一类在肿瘤发生过程中发挥重要生物学作用的重要调节因子,miR-375被认为是多种肿瘤类型的抑癌基因,Liu等[16]通过非编码RNA芯片发现,与恶性程度低的腔内乳腺癌相比,恶性基底细胞样乳腺癌中miRNA-375的表达水平明显降低,且发现CPNE8作为miRNA-375的下游靶基因参与了乳腺癌的恶性进程。与上述Ramsey和Bu等研究结果相一致的是,我们免疫组化结果表明,CPNE8在胃癌组织中的阳性表达率显著高于胃癌旁组织;进一步分析发现CPNE8的表达水平与胃癌患者的TNM分期及有无淋巴结转移密切相关,提示其可能在胃癌的发生发展过程中扮演重要角色。通过对根治性胃切除术后患者进行随访调查,结果表明CPNE8高表达组患者的无病生存时间较CPNE8低表达患者明显缩短;并且TNM分期、淋巴结转移和CPNE8蛋白表达是影响胃癌患者总生存时间的独立危险因素,TNM分期和CPNE8蛋白表达是影响胃癌患者无病生存时间的独立危险因素,提示CPNE8高表达的胃癌患者具有较差的预后。随着早期胃癌患者可行胃镜下胃黏膜切除手术的进步与推广,判断早期胃癌患者是否有无淋巴结转移已成为行胃黏膜切除手术适应症的关键。因此,本研究结果将有助于CPNE8作为早期胃癌患者行胃黏膜切除手术的适应症的潜在指标之一。
当然,本研究仅限于分析CPNE8表达与胃癌临床病理参数之间的关系,对CPNE8如何参与胃癌进展的具体调控机制未作进一步的探讨,结合相关文献调研,CPNE8作为钙离子依赖性膜结合蛋白主要通过信号转导或细胞膜的转运间接调控其靶蛋白的功能,从而参与肿瘤细胞的增殖调控作用。因此,我们后续将重点研究CPNE8相关靶蛋白对胃癌的增殖调控机制进行深入探讨。
综上所述,本研究通过组织水平发现,CPNE8在胃癌中高表达预示患者不良的预后,提示其在胃癌的恶性进展过程中扮演重要的角色,可成为胃癌早期诊断和预后评估潜在的分子标志物。
