Ca2+信号通路对大鼠舌黏膜鳞癌形成影响的实验研究
2020-11-14凌永昌聂智亮
雷 雳,凌永昌,聂智亮
(赣南医学院第一附属医院口腔科,江西 赣州341000)
舌癌是临床上常见恶性肿瘤之一,以鳞癌为最常见类型。由于口腔颌面部解剖结构复杂,且毗邻颅脑、食道、气管等重要组织,该处发生恶性肿瘤容易侵犯颅脑、阻塞气管食道,后果严重[1-2]。深入研究舌黏膜鳞癌形成发生机制,是更好防治舌黏膜鳞癌的必要基础。近年发现Ca2+信号通路在多种肿瘤疾病中起着重要作用[3-5],而目前国内外关于Ca2+信号通路与舌黏膜鳞癌形成之间关系鲜有报道。本实验旨在探讨Ca2+信号通路对舌黏膜鳞癌形成的影响,了解其与舌黏膜鳞癌形成可能存在的关系。
1 材料与方法
1.1 动物造模及分组70只SPF级SD雄性大鼠,购于赣南医学院实验动物中心[许可证号:SCXK(赣)2014-0001],体重(250±20)g,饲养于动物实验中心,室温18℃~25℃,湿度30%~50%,24 h自然光暗循环、通风良好,自由进食、饮水,适应性喂养2周后。参照文献方法造模[6],用蒸馏水将4-硝基喹-1-氧化物(4-nitroquinoline-1-oxid,4NQO)(Sigma,美国)溶液配置成0.1%的4NQO致癌剂储存液,4℃避光保存备用。使用时以蒸馏水加入0.1%的4NQO致癌剂储存液配制成0.002%4NQO溶液试验用致癌口服溶液。64只SD大鼠分为对照组(A组随机抽取8只大鼠)和模型组(分别分为B组4周;C组8周;D组12周;E组16周;F组20周;G组24周;H组28周;每组随机分配8只大鼠)。A组(空白对照组)大鼠正常喂养,不进行特殊干预。各模型组大鼠,均将0.002%4NQO溶液试验用致癌口服溶液置避光瓶内作为饮用水自然喂养实验组大鼠。以随机数字法抽取8只SD大鼠纳入空白对照组,不做任何处理。其余为实验组,分别在第4周、8周、12周、16周、20周、24周、28周时在总实验组中随机抽取8只SD大鼠分别记录为:B组(4周)、C组(8周)、D组(12周)、E组(16周)、F组(20周)、G组(24周)、H组(28周)进行试验。
1.2 取材试验大鼠以3%戊巴比妥钠麻醉,满意后颈椎脱臼处死,肉眼观察以及切取舌标本,每个标本的1/2用4%中性福尔马林固定,常规石蜡包埋,4μm连续切片,常规HE染色,所有诊断均采用双盲法,病理学诊断参照WHO 2005年标准[7]。另一半标本迅速放入冻存管置于液氮中,置入液氮罐保存。
1.2.1 基因表达谱芯片检测TRIzol一步法提取液氮罐保存的各组SD大鼠舌组织标本总RNA,分别进行纯化、质检。以各组标本编号并分别提取总RNA,并以其为模板合成双链cDNA;体外转录生成生物素标记的cRNA,再次进行纯化和片段化处理。取10μg cRNA与Affymetrix Genechip Rat Genome 230 2.0 Array进行杂交、洗脱、染色扫描检测信号。
1.2.2 芯片图像的采集与数据分析Affymetrix扫描仪扫描并采用5.0版芯片分析软件进行分析。差异表达基因判断标准:上调基因:change为I,Ratio≥1,实验组Detection为P;下调基因:change为D,Ratio≤-1,对照组Detection为P。
1.2.3 pathway查询分析对H/A组(24周组VS对照组)差异表达基因进行分析,在www.genome.jp/kegg/通过kegg pathway database查询H/A组差异表达基因参与的信号通路情况。
2 结果
2.1 实验动物情况与A组(空白对照组大鼠)相比,实验组大鼠活跃程度、摄食量、饮水量和体重随着实验时间延长呈递减趋势。在16周时部分大鼠毛色干枯无光泽,精神萎靡,反应迟钝。实验24~28周内4只SD大鼠死于肿瘤恶病质,实际可评价大鼠总共有66只。
2.2 大体标本观察A组(空白对照组大鼠):舌体柔软,富有弹性,舌背黏膜呈粉红色,乳头分布均匀,HE染色显示为正常黏膜(图1)。H组大鼠:舌背人字沟附近可观察到菜花状黏膜新生物,局部糜烂,侵及黏膜深层,经病理证实为高分化鳞癌(图2)。
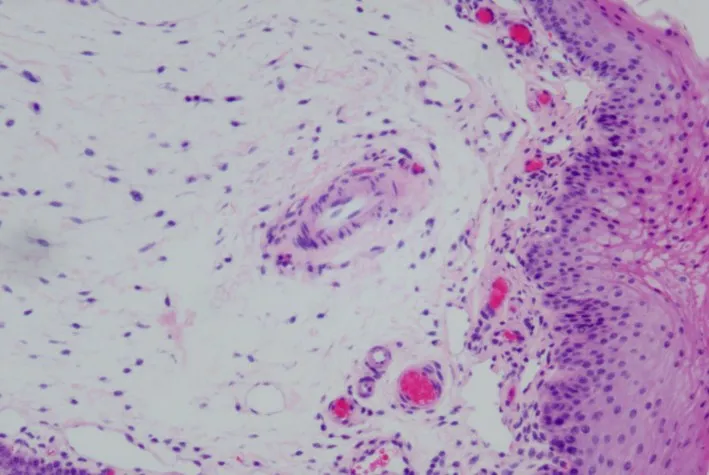
图1正常黏膜(HE 200×)
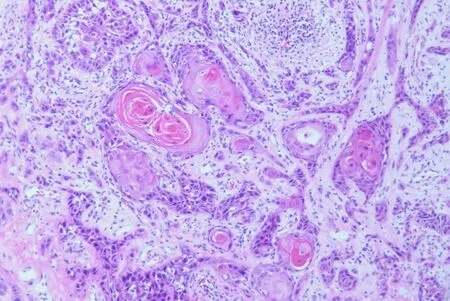
图2高分化鳞(HE 200×)
2.3 大鼠舌组织总RNA提取及电泳图各组SD大鼠舌组织中提取的总RNA OD260/OD280介于1.8~2.0之间,琼脂糖凝胶电泳显示28S RNA和18S RNA条带整齐,28S/18S吸光值之比约为2,表明各组大鼠舌组织提取制备的总RNA样品完整性好、质量高、无降解(图3)。
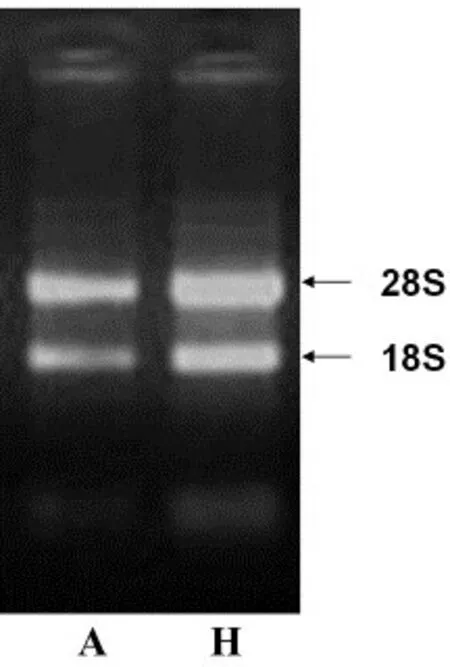
图3总RNA电泳图
2.4 大鼠舌组织差异基因表达
2.4.1 概况二组对比,表达上调基因2 577个,下调基因1 613个,差异表达基因一共有4 190个。见表1。

表1差异表达基因统计概况/个
2.4.2 pathway查询结果在舌黏膜鳞癌形成过程中,涉及Ca2+、MAPK、Wnt和凋亡等信号通路。图中是H/A对比的差异表达基因映射入Ca2+信号通路的结果,红色表示基因表达上调,蓝色表示基因表达下调(图4)。
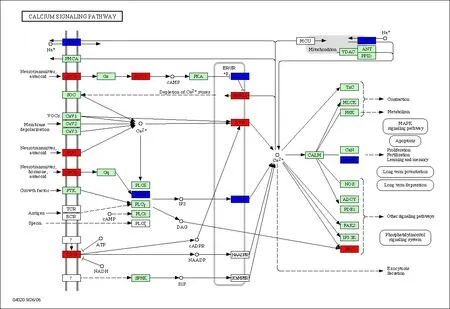
图4 Ca2+信号通路图
3 讨论
舌癌是临床常见恶性肿瘤,以鳞状细胞癌为其主要病理类型。舌癌治疗效果差,复发率高、预后差,5年生存率不足50%[8]。近年来,由于吸烟、嚼食槟榔等多种原因舌癌人群总体发病率呈逐年上升趋势,且年轻化趋势明显,预防及治疗现状不容乐观。因此,很有必要深入探讨舌癌的发病机制,这是提高舌癌临床疗效的基础和关键所在。研究表明:舌癌的形成原因复杂,是一个涉及多基因的疾病[9-11]。这些基因相互作用,关系密切,形成庞大而复杂的信号转导系统,影响着舌癌的形成。
近年来,针对Ca2+通道的分子生物学的研究方兴未艾,研究表明[12]:Ca2+作为细胞内重要的第二信使,密切参与细胞的生理病理过程,能激活介导各条信号通路,参与了分子重构,从而使细胞结构、功能、电活动发生一系列的变化,介导了肿瘤细胞的凋亡、增殖、耐药和自噬等多个过程。也有学者研究发现[13]:使用钙通道阻滞剂减少肿瘤细胞的钙离子内流,能明显增强肿瘤细胞对抗肿瘤药的敏感性。尤其值得注意的是,最近研究发现[14-15],Ca2+能够激活PI3K/AKT信号通路,而PI3K/AKT信号通路能够介导肿瘤细胞逃避细胞凋亡,能使临床疗效降低。上述研究提示Ca2+在肿瘤的发生发展变化过程中起着重要作用,也为本研究提供了参考依据。
本研究收集不同时间段的舌癌和癌旁组织进行RNA提取、RNA测序(RNA-Seq),并分析差异表达的基因。根据分析要求对测序读段进行定量和鉴定。分析了舌癌组织和癌旁癌组织的转录组,通过对基因树和通路网络的综合分析显示,大多数细胞周期基因被上调,而与细胞内应答,细胞粘附和细胞分化相关的大多数基因被下调。研究显示,差异表达之基因呈上调趋势的有GPCR、ROC、CD38、ADCY、SERCA、RYR、PKC;下调的有NCX、PLCβ、PLN、IP3R、CAMK。上述基因通过构成复杂的网络传递信息,相互协调、相互调控。NCX、GPCR、ROC、CD38等均为Wnt信号通路的上游基因,在机体受到外界的刺激后,呈现上调激活状态,调控影响着下游基因,如PLCβ、PLN、IP3R、ADCY、SERCA、RYR等,而这些基因将不同信号传导通路介导的信号加以整合,起着多种信号的交汇点或共同通路的作用。末端效应基因如PKC、CAMK、NCX等基因表达异常,最终将导致机体细胞增殖、分化、凋亡等功能发生异常。有研究提示舌癌本体与细胞外基质(ECM)组织,细胞黏附和胶原分解代谢过程相关的基因表达增加[16-17]。且差异表达的基因主要集中在粘着斑粘附途径,ECM受体相互作用途径,磷酸肌醇3激酶(PI3K)-Akt途径和细胞粘附分子中[18]。GPCR控制的相关基因与其下游Wnt信号通路彼此密切相关,并在差异信号途径中处于肿瘤发生发展的关键位置。故本研究推测,Ca2+信号通路调控异常与舌癌的形成关系密切,机体有可能通过对Ca2+信号通路的调控作用进而影响舌癌形成。
综上所述,本实验提示Ca2+信号通路有可能通过上述途径调控影响着舌癌的演变,如能调控其中的转导途径,就有可能预先中止舌癌的形成或者减轻舌癌的严重程度。但本研究仍需对相关基因进一步深入研究,如RNAi、基因敲除等,明确相关基因功能,以期为临床上舌癌的有效防治提供新的方向。
