山西省枸杞叶斑病病原鉴定及其生物学特征
2020-11-14路媛媛宋艳波李丽乔永刚刘振宇
路媛媛,宋艳波,李丽,乔永刚,刘振宇
(1.山西农业大学 生命科学学院,山西 太谷030801;2.山西农业大学 信息科学与工程学院,山西 太谷030801)
枸杞(Lyciumspp.),茄科(Solanaceae),枸杞属(LyciumL.),主要分布在宁夏、青海、甘肃、内蒙古等地区[1],其果和根皮均可入药,具有滋补、补精等作用[2],常用于食品及药品等。近些年来,随着国内外对枸杞的需求量的增加,我国枸杞的种植面积增加,枸杞的病害随之增加,严重影响枸杞的品质和产量,给当地的经济造成了巨大的损失[3]。
枸杞的病害种类较多[4]。枸杞根部病害主要由镰刀菌(Fusariumspp.)引起的枸杞根腐病,发病时根部变黑、腐烂,严重时全株枯萎死亡[5,6]。叶部病害主要为枸杞白粉病、枸杞炭疽病和枸杞灰斑病。枸杞炭疽病主要由红斑盘长孢菌(Gloeosporium rufomaculans(Berk)Thum)侵染花器引起,随着发病时间延长,进而产生黑斑,因此该病害又称为“枸杞黑果病”[7,8]。由多孢穆氏节壳菌引起的枸杞白粉病,使枸杞叶片上形成一层白色粉状霉层[9,10]。枸杞灰斑病由尾孢属(Cercospora Lyciiell.et Halst)引起,叶片上出现灰白色圆形病斑,边缘褐色,另外叶背面出现黑色霉状物[11]。迄今为止,我国关于枸杞病害的研究大多集中在病害的发现和病原菌鉴定等方面,有关病原菌菌丝生长、孢子萌发、产孢量等相关生物学特征的研究报道较少,这些制约着病害防治策略的制定及病害的防控。
2019年9月,本课题组在山西太谷县山西农业大学中药实习基地发现一种枸杞叶斑病。调查时发现,该病害的发病率约为53%,病害侵染初期,病斑形状不规则,淡黄色,随着侵染时期延长,病斑扩展为近圆形,深黄色至棕色,有褐色晕圈,病健交界处明显。严重时,病斑可破碎,穿孔,脱落,与现有枸杞叶部病害症状不一致。因此为了深入研究该病害,本研究通过症状描述,对病原菌进行形态学和分子生物学鉴定,并结合柯赫氏法则验证,明确引起该病害的病原菌,并对该病原菌菌丝生长、孢子萌发、产孢量等相关生物学特征进行了系统的研究,寻找到病原菌对环境和营养条件的要求,旨在为进一步了解病害的发病规律及防治研究提供理论依据。
1 材料和方法
1.1 试验材料
2019年9月,在山西省太谷县山西农业大学中药实习基地采集枸杞叶斑病典型症状叶片。
1.2 试验方法
1.2.1 病原菌分离与鉴定
采用组织分离法[12]对枸杞叶斑病病原菌进行分离。将叶片病健交界处剪成1 cm×0.5 cm的小块,升汞(0.1%)30 s,75%酒精消毒1 min,无菌水冲洗3遍,放置于马铃薯葡萄糖琼脂培养基(PDA)中,25℃,培养2~3 d,待病健交界处长出病原菌后,取少量菌丝,放置于新的PDA平板上继续培养。待5~7 d产孢后,进行单孢纯化,4℃保存,备用。
1.2.2 赫氏法则证病
对健康枸杞叶片表面进行消毒(75%酒精),将配置好的孢子悬浮液(浓度为1×107个·mL-1)进行喷雾接种,每10个叶片喷洒2 mL,对照组喷施无菌水[13]。25℃,6-BA保湿培养2~3 d,7 d后观察叶片发病情况。当人工接种叶片出现症状后,重新进行组织分离(方法同1.2),比对2次分离所得到的病原菌。
1.2.3 病原菌鉴定
利用光学显微镜观察病原菌分子孢子、分生孢子梗等大小和形态,结合病原菌菌落形态,依照Zhang[14]和Ellis[15]对 所 分 离 得 到 的 病 原 菌 进 行 鉴定。采用尿素法[13]提取病原菌DNA,利用通用引物ITS1(TCCGTAGGTGAACCTGCGG)和ITS4(TCCTCCGCTTATTGATATGC)[16](生工生物工程(上海)股份有限公司合成)进行PCR扩增。测序结果利用NCBI数据库进行比对分析,对病原菌进行分子鉴定,最后利用Mega5.0软件构建系统发育树。
1.2.4 不同因素对菌丝生长及孢子形成的影响
(1)营养条件对菌丝生长及孢子形成的影响
不同碳、氮源培养基的制备:以查氏培养基(NaNO32 g,K2HPO41 g,KCl 0.5 g,MgSO4·
7H2O 0.5 g,FeSO40.01 g,蔗糖30 g,琼脂粉16 g,蒸馏水1 L)为基础培养基,将KNO3,(NH4)2SO4,蛋白胨,脲,苯丙氨酸,甘氨酸等量替换培养基中的NaNO3,制备成不同氮源的培养基。将可溶淀粉、D-甘露醇、果糖、木糖、葡萄糖等量替换培养基中的蔗糖,制备成不同碳源的培养基。
菌丝生长测定方法:取菌饼(直径9 mm),移植待测培养基中央后,置于25℃恒温培养,从第2天起,采用十字交叉法测定菌落直径,每组重复3次。
产孢量测定:将培养在不同培养基上的病原菌25℃培养7 d后,用等量(10 mL)无菌水进行冲洗,擦净纸过滤,用血球计数板测产孢量,每个处理重复10次。
(2)环境条件对菌丝生长及孢子形成的影响
用HCl(1 mol·L-1和0.1 mol·L-1),NaOH(1 mol·L-1和0.1 mol·L-1)调节PDA的pH值为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0。取菌饼(直径9 mm),移植不同梯度pH的PDA培养基中央后,25℃恒温培养。
光照:取菌饼(直径9 mm),移植PDA培养基中央后,分别置于全光照,全黑暗和光暗交替(12 h/12 h)条件下,25℃恒温培养。
菌丝生长测定方法和产孢量测定方法同1.2.4(1)。
1.2.5 不同因素对病原菌孢子萌发的影响
(1)营养条件对病原菌孢子萌发的影响
将上述不同碳源或氮源配制成浓度为1%的营养液。用上述营养液配制成浓度为1×108个·mL-1的孢子悬浮液,采用悬滴法,25℃恒温培养孢子,经预备试验后,测定6 h孢子萌发率,每次观察100个,重复3次。
(2)环境条件对病原菌孢子萌发的影响
用HCl(1 mol·L-1和0.1 mol·L-1),NaOH(1 mol·L-1和0.1 mol·L-1)将 无 菌 水 调 节pH梯 度 为3.0~11.0,间隔为1。用上述梯度溶液配制成浓度为1×108个·mL-1的孢子悬浮液,孢子萌发率测定方法同1.2.5(1)。
将无菌水配制成孢子悬浮液(浓度1×108个·mL-1),利用悬滴法25℃培养孢子,玻片置于全光照、黑暗、光暗交替(12 h)条件下,孢子萌发率测定方法同1.2.5(1)。
1.3 统计分析
采用SPSS软件对测得的数据进行统计分析,并进行单因素方差分析,检验数据的差异显著性。
2 结果与分析
2.1 病害症状描述
田间调查时发现,该病害的发病率约53%,田间主要危害叶片,病害侵染初期,病斑形状不规则,淡黄色,随着侵染时期延长,病斑扩展为近圆形,深黄色至棕色,有褐色晕圈,病健交界处明显。严重时,病斑可破碎,穿孔,脱落(图1A)。
2.2 病原菌分离和致病性分析
经组织分离法获得1份病原菌分离物,命名为GQ-1。经过喷雾法接种健康的枸杞叶片,离体叶片接种2~3 d后叶片出现淡黄色病斑,4~5 d后出现典型病斑,7 d后病斑逐渐扩大,呈近圆形,褐色,有棕色晕圈,病健交界处明显,对照不发病(图1B)。人工接种出现的病斑症状与田间调查症状一致,病叶重新进行组织分离后,获得了同自然发病一致的病原菌,因此确定该病原菌为引起枸杞叶斑病致病菌。

图1 枸杞叶斑病发病症状Fig.1 Symptoms of Lycium leaf spot
2.3 原菌鉴定
2.3.1 病原菌形态学鉴定结果
经柯赫氏确定的病原菌,在PDA上的菌落起初为灰白色,菌落稀疏,随着培养时间的延长,菌落颜色变为墨绿色至黑褐色,绒毛状,致密(图2A)。显微观察(图2B)病原菌孢子倒棍棒状,褐色,有4~7个横隔膜,2~4个纵隔膜,20.0~44.5 μm×7.5~13μm。
2.3.2 病原菌分子鉴定结果
以JQ-1的DNA为模板,使用通用引物(ITS1/ITS4)进行PCR扩增,得到约512 bp大小的片段(图3),将扩增的产物进行测序,得到的序列在NCBI数据库中及进行同源性分析,结果表明GQ-1与Alternaria tenuissima(登录号:MH856117.1)的同源性为100%。利用Mage 5.0,采用NJ法构建系统发育树,结果表明,GQ-1与A.tenuissima聚为一类,亲缘关系较近(图4)。因此根据形态学和分子生物学结果表明,待测菌株GQ-1为细极链格孢A.tenuissima。

图2 枸杞叶斑病病原菌形态Fig.2 Morphological characteristics of GQ-1

图3 病原菌的ITS PCR扩增产物Fig.3 PCR product of ITS
2.4 不同因素对病原菌的生长速率和产孢量的影响
2.4.1 不同碳源对病原菌生长速率及产孢量的影响
由表1可以看出,A.tenuissima可在不同碳源的培养基上生长,但病原菌的生长速率和产孢量差异显著(P<0.05)。甘露醇作为碳源时,病原菌生长最快,平均生长速率为9.67 mm·d-1,其次为葡萄糖、蔗糖、果糖和木糖,在可溶性淀粉中生长最慢。对于产孢,葡萄糖和蔗糖为碳源时,对产孢较好,分别为2.75×106个·mL-1和2.20×106个·mL-1,其次为果糖、木糖和甘露醇,可溶性淀粉不利于病原菌产孢。以上结果表明,病原菌产孢和生长之间没有明显的相关性。

表1 不同碳源对A.tenuissima菌丝生长及产孢量的影响Table 1 Effect of different carbon sources on mycelium growth and conidiation of A.tenuissima
2.4.2 不同氮源对病原菌生长速率及产孢量的影响

图4 病原菌系统进化分析Fig.4 Phylogenetic analysis of GQ-1
A.tenuissima可在不同氮源的培养基上生长,但其生长速率和产孢量存在明显差异(P<0.05)(表2)。培养基中加入KNO3时,病原菌平均生长速率可达8.43 mm·d-1,有利于菌丝生长,其次为NaNO3、蛋白胨、脲、甘氨酸和苯丙氨酸,当添加(NH4)2SO4时,不利于病原菌菌丝生长,生长速率最慢。虽然(NH4)2SO4对A.tenuissima菌丝生长不利,但最有利于产孢,为2.05×106个·mL-1,其次为NaNO3、蛋白胨、苯丙氨酸、甘氨酸和KNO3,而在脲中不产孢,这说明病原菌无法利用脲这一氮源进行产孢。
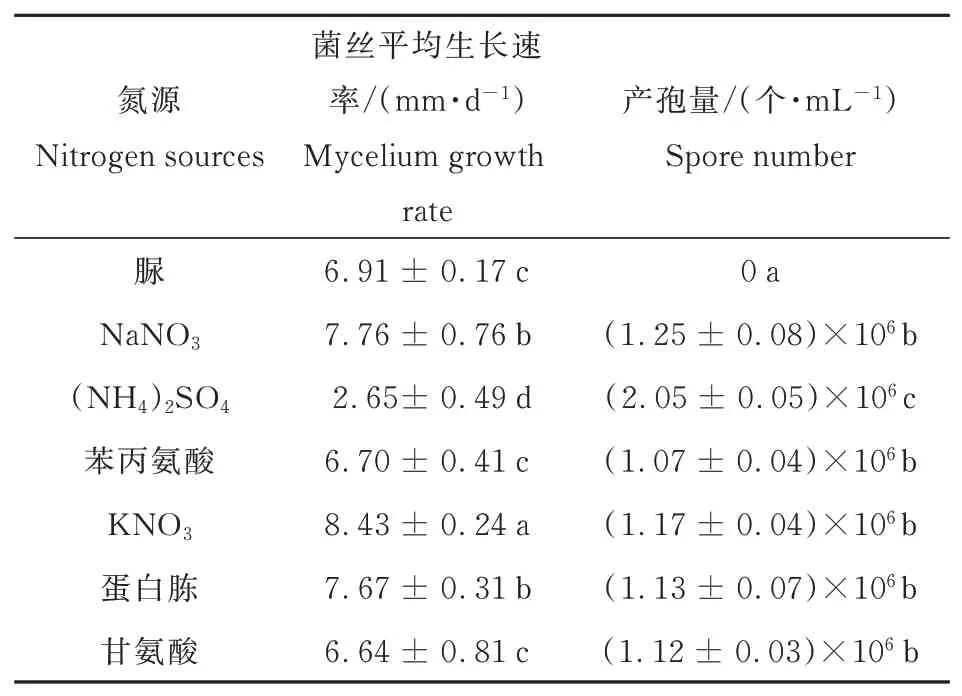
表2 不同氮源对A.tenuissima菌丝生长及产孢量的影响Table 2 Effect of different nitrogen sources on mycelium growth and conidiation of A.tenuissima
2.4.3 不同pH对病原菌生长速率以及产孢量的影响
不同pH值对A.tenuissima生长及产孢有一定的影响(表3)。当pH为3.0~11.0时,GQ-1均可生长,但GQ-1的生长速率和产孢均存在明显差异。在pH为3.0~7.0时,菌丝生长速率和产孢量随着pH的增加而增加,pH为7.0时,生长速率和产孢量达到最高值,分别为8.43 mm·d-1和2.33×106个·mL-1,为A.tenuissima生长及产孢的最适pH值。当pH为8.0~11.0时,菌丝生长速率和产孢量随着pH的增加而下降。
2.4.4 不同光照对病原菌生长速率及产孢量的影响
在光暗交替(12 h/12 h)条件下,A.tenuissima生长速率和产孢量均为最大值,分别为8.14 mm·d-1和2.42×106个·mL-1。在全光照和全黑暗条件下,对A.tenuissima生长速率和产孢量的增加促进不显著(表4)。
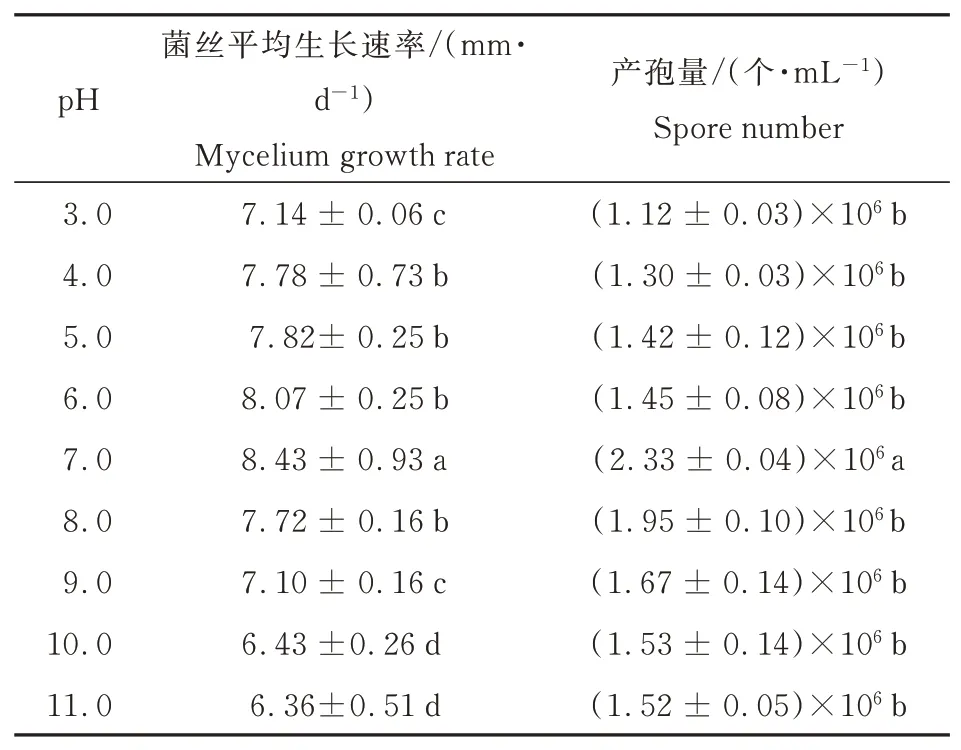
表3 不同pH对A.tenuissima菌丝生长及产孢量的影响Table 3 Effect of different pH on mycelium growth and conidiation of A.tenuissima

表4 不同光照条件对A.tenuissima菌丝生长及产孢量的影响Table 4 Effect of different light on mycelium growth and conidiation of A.tenuissima
2.5 不同因素对病原菌孢子萌发的影响
2.5.1 碳源对病原菌孢子萌发的影响
采用悬滴法对A.tenuissima孢子萌发率进行测定,结果表明,不同碳源的营养液对A.tenuissima的孢子萌发存在显著差异(图5),其中葡萄糖和蔗糖作为营养液进行孢子萌发时,孢子萌发率均能达到88%以上,为最适碳源;其次为木糖、果糖、甘露醇,孢子萌发率也在55%以上;另外使用可溶性淀粉作为培养液时,孢子萌发率最低,仅为28.67%。

图5 不同碳源对A.tenuissima分生孢子萌发的影响Fig.5 Effect of different carbon sources on conidium germination of A.tenuissima
2.5.2 氮源对病原菌孢子萌发的影响
不同氮源培养液对A.tenuissim孢子萌发测定结果见图6。由图6可以看出,不同氮源培养液对A.tenuissim孢子萌发的影响存在显著差异,其中,(NH4)2SO4和NaNO3有 利 于GQ-1的 孢 子 萌发,萌发率能达到88%以上,其次为KNO3和甘氨酸,病原菌的孢子萌发率仍能达到75%以上,然而在使用脲、苯丙氨酸作为营养液时,病原菌的孢子萌发率在35%左右。使用蛋白胨时,病原菌的萌发率最差,仅为19%,这说明蛋白胨对病原菌的孢子萌发有抑制作用。
2.5.3 pH对病原菌孢子萌发的影响
pH对A.tenuissim的孢子萌发影响结果见图7。由图7可见,pH为3.0~11.0时,随着pH的增加,A.tenuissim的孢子萌发率增加,在pH为7.0时,达到最高值,为78%。而当pH为8.0~11.0时,随着pH的增加,A.tenuissim的孢子萌发率开始下降。
2.5.4 光照条件对病原菌孢子萌发的影响
病原菌孢子萌发测定结果表明,不同光照条件对A.tenuissim的孢子萌发率存在明显差异,其中光暗交替12 h/12 h更有利于孢子的萌发,萌发率高达91%。全黑暗条件不利于孢子萌发,孢子萌发率为78%(图8)。
3 讨论与结论
本试验于2019年9月采集枸杞叶斑病病叶,分离纯化得到一株菌株JQ-1,经柯赫氏法则验证,确定其为引起枸杞叶斑病的病原菌,结合形态学和分子生物学手段,确定该病原菌为细极链格孢(A.tenuissima)。细极链格孢为链格孢属,链格孢菌虽主要为枸杞内生菌[17],但同样能引起枸杞产生病害[18]。已有研究表明,姜海燕[19]在内蒙古地区的枸杞种植区发现一种新的叶枯病,其病原菌为细链格孢菌(A.tenuis),刘伟在甘肃枸杞种植基地的“宁夏枸杞”品种上同样发现一种枸杞新叶斑病,其病原菌为(A.alternata)[11]。因此,本文将山西省发现的新病害——枸杞叶斑病的致病菌鉴定为细极链格孢A.tenuissima。

图6 不同氮源对A.tenuissima分生孢子萌发的影响Fig.6 Effect of different nitrogen sources on conidium germination of A.tenuissima
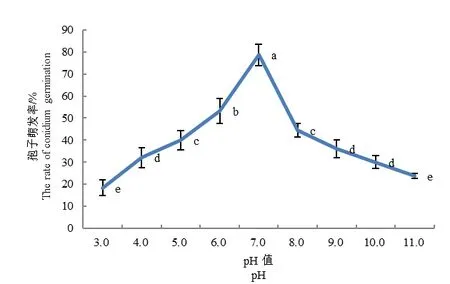
图7 不同pH对A.tenuissima分生孢子萌发的影响Fig.7 Effect of different pH values on conidium germination of A.tenuissima
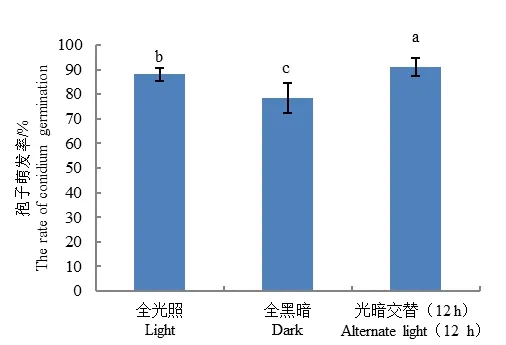
图8 不同光照对A.tenuissima分生孢子萌发的影响Fig.8 Effect of different light on conidium germination of A.tenuissima
本研究初步确定了枸杞叶斑病病原菌A.tenuissima的生物学特征,结果表明,不同营养条件及营养环境对病原菌的菌丝生长、产孢及孢子萌发有显著的差异,适于病原菌生长的最佳碳源为甘露醇,最佳氮源为KNO3,但有利于产孢的碳源为葡萄糖和蔗糖,氮源为硫酸铵。对于孢子萌发测定,最佳碳源为葡萄糖,最佳氮源为硫酸铵和KNO3,这与孟婷婷[20]、鲁海菊[21]等的研究结果有一致的情况,也有不一致的情况,导致这种差异的原因可能与病原菌的寄主不同有关。孟婷婷[20]在研究树莓茎溃疡病病原菌生长和产孢时表明,最佳氮源为硝酸铵,但本文结果为硫酸铵,这与鲁海菊[21]的研究结果一致。由于A.tenuissima可利用多种碳源和氮源进行生长和产孢,因此在田间栽培的过程中,对于氮肥的使用要慎重。
已有研究表明,细极链格孢在梨[22]、冬枣[23]、樱桃[24]等果树上均有发生,由此可以看出,细极链格孢的寄主范围较广,侵染能力强,危害程度大,在不同作物、粮食及果蔬之间相互感染等特点,因此田间处理病残体,切断病原菌初侵染源对于病原菌的防治有着重要的作用。另外,进一步开展病害的预测预报,常用药剂的田间试验等,对有效控制枸杞叶斑病的扩大具有一定的指导意义。同时开展病原菌的致病机理研究,对病害的进一步研究具有一定的意义。
