基于环境DNA技术的辽东湾真核微藻群落结构特征
2020-11-13宋广军董少杰王志松
宋 伦,吴 景,宋广军,董少杰,王志松
1 辽宁省海洋水产科学研究院,辽宁省海洋生物资源与生态学重点实验室,大连 116023 2 天津农学院水产学院 天津市水产生态及养殖重点实验室,天津 300384
辽东湾是中国渤海最大的半封闭式海湾,是海洋生物重要的索饵场、产卵场、越冬场和洄游通道,但多年来超负荷承载陆源污染,近岸海域富营养化严重,赤潮、褐潮频发[1- 2]。微微型微藻(0.22—2 μm)在海洋中多样性相当丰富,也是褐潮暴发的主要致灾种,由于个体微小、形态学鉴定困难一度研究较为迟缓[3]。辽东湾西南侧海域从2009年开始至今每年都暴发抑食金球藻(Aureococcusanophagefferens)褐潮[4],最大面积达3400 km2,褐潮期间养殖贝类滞长、部分死亡,生态系统遭到破坏,旅游业、水产养殖业经济损失巨大。高通量测序技术的发展极大地推动了微型藻类的高效检测研究[5],借助该技术,2014—2015年宋伦等在辽东湾长兴岛海域又发现了尚未报道的微拟球藻(Nannochlorissp.)和金牛微球藻(Ostreococcustauri)褐潮致灾种[6]。同时发现了褐潮致灾种抑食金球藻(Aureococcusanophagefferens)和外来有害微藻Stoeckeriaalgicida在辽东湾的扩散迹象[7- 8]。
另一方面,目前辽东湾微藻只记录了95种[9],海洋微藻多样性研究相对比较薄弱,鉴于此,该研究采用高通量测序平台,结合生物信息学方法,以18S rDNA的V4区为目标基因对辽东湾海域的真核微藻进行多样性检测,分析其群落结构特征,探寻新种类,为外来海洋微藻研究提供参考。
1 材料与方法
1.1 样品采集
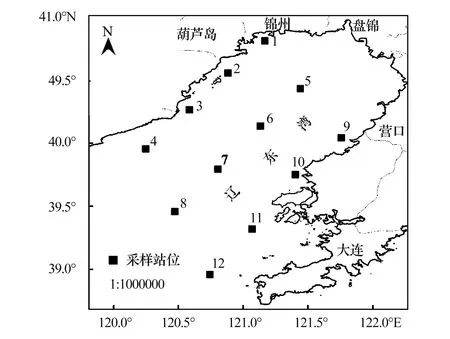
图1 辽东湾采样站位示意Fig.1 Sampling sites in Liaodong Bay
为了解真核微藻群落结构特征,在辽东湾海域网格化设置12个站位(图1),分别于2014年5月(春)、8月(夏)、10月(秋)、12月(冬)采集表层海水1L,样品首先经200 μm筛绢过滤去除大型浮游生物,然后用0.22 μm微孔滤膜过滤收集真核微藻,最后将滤膜转移至1.5 mL无菌离心管中,置于-20或-80℃冷冻保存、运输。
1.2 分析方法
1.2.1基因组 DNA 的提取
采用CTAB法提取真核微藻宏基因组,具体参考相关文献[8]。
1.2.218S rDNA可变区V4的PCR扩增
利用自行开发的真核微藻18S rDNA的V4区基因扩增引物进行PCR扩增,具体步骤参考相关文献[8]。
1.2.3数据分析
测序得到的原始数据使用FLASH软件进行拼接,参照Qiime软件质量控制流程将拼接后的序列经过截取、过滤得到有效数据。利用Uparse对有效数据进行可操作分类单元(OTUs)聚类和物种分类,采用RDP Classifier方法与SILVA数据库对OTUs代表序列进行物种注释[10]。
采用Shannon-Wiener指数(H′)统计物种多样性水平:
式中,Pi为第i种真核微藻的OTUs数与样本总OTUs数的比值;S为种类数。
物种优势度(Y)表示真核微藻群落中某一物种所占的优势程度:
式中,nx为第x种真核微藻种类的OTUs数,N为OTUs总数,fx为第x种真核微藻种类在各样品中出现的频率。
公式计算、数据分析、方差检验、图件绘制均通过Microsoft Excel 2007和SPSS 19.0、PRIMER 5.0软件完成。
2 结果
2.1 测序数据质量
测序所得有效数据每个样品平均获得77297条原始序列,经过拼接和质量过滤,每个样品平均得到70604 条序列,高质量数据占到91%以上,表明测得的数据准确可靠。各样品测序结果见表1。
2.2 OTUs聚类和物种注释
为进一步分析表层海水样品中物种组成多样性信息,使用Uparse软件对所有样品的有效序列进行聚类分析,以97%的一致性将序列聚类成为OTUs种水平,每个样品平均获得378个OTUs,春、夏、秋、冬分别注释微藻150、187、183、195。
2.3 微藻组成及相对丰度
2.3.1纲水平微藻种类组成及相对丰度
2014年春季(5月)辽东湾各个样品中甲藻纲(Dinophyceae)获得注释的物种数量约占总数的43%,高于其他纲。调查海域的微藻多样性甲藻纲为优势群体,而绿枝藻纲(Prasinophyceae)、隐藻纲(Cryptophyceae)、中心纲(Centricae)获得注释的物种数量均为10%左右,以上五个纲约占整个微藻的70%。真眼点藻纲(Eustigmatophyceae)只存在于3、9、12站位(图2)。
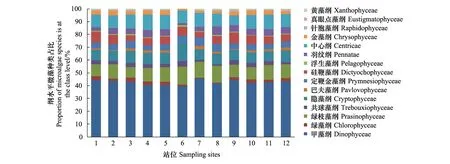
图2 春季(5月)辽东湾微藻中主要类群纲水平多样性Fig.2 Class level diversity of major taxa in microalgae in spring of Liaodong Bay
调查海域中,不同纲的相对丰度相差非常大,同一纲在不同站位的相对丰度变化很大。2014年春季,甲藻纲相对丰度最高,平均丰度为0.57。其次是绿枝藻纲、隐藻纲、浮生藻纲(Pelagophyceae),相对丰度平均值分别为0.14、0.10、0.10。应该引起注意的是4、7、8站位中浮生藻纲的相对丰度显著高于其他站位,其OTUs注释结果为抑食金球藻,是引发褐潮的一种微微型藻类(图3)。
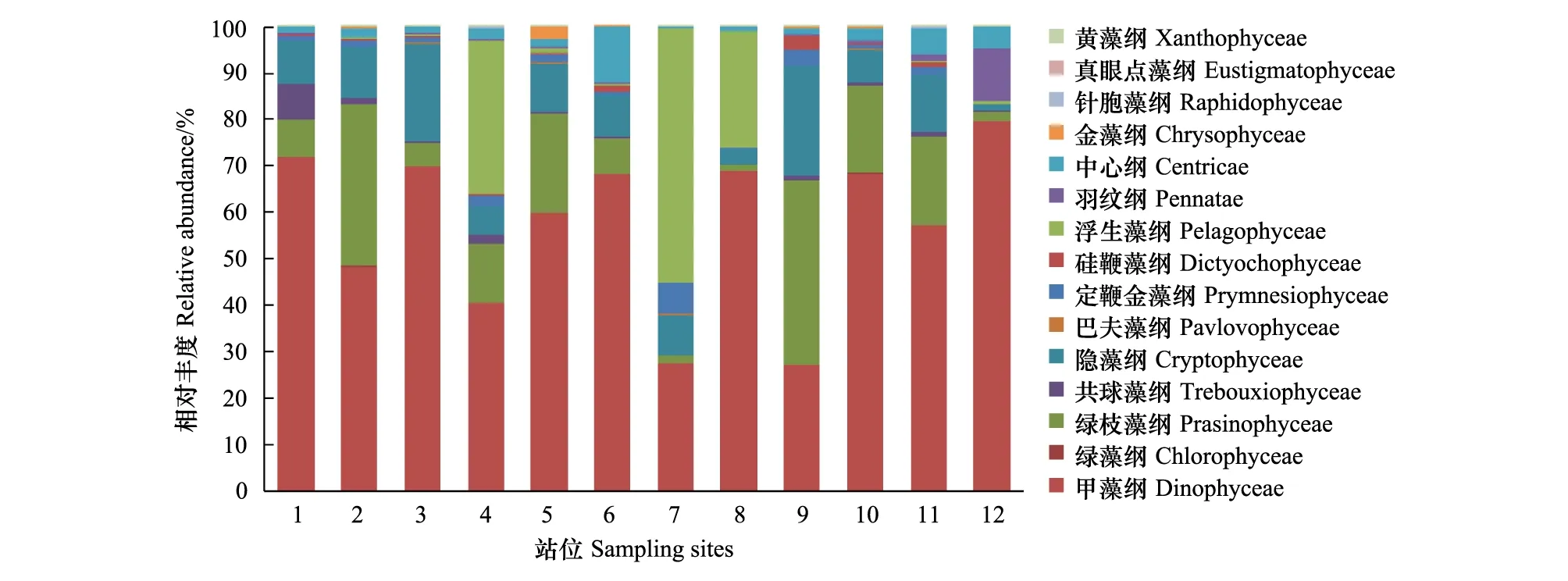
图3 春季(5月)辽东湾微藻中主要类群相对丰度Fig.3 Relative abundance of major taxa for all eukaryotic phytoplankton in spring
2014年夏季(8月)辽东湾海域各个站位的微藻在纲的分类水平上,主要类群多样性在各站位之间变化较小。各个样品中甲藻纲获得注释的物种数量约占总数的39%,高于其他纲,而绿枝藻纲、隐藻纲、中心纲获得注释的物种数量均为10%左右,以上3个纲约占整个微藻的70%。真眼点藻纲的分布相对5月份有所增加,4、8、9、10、11、12站均出现(图4)。

图4 夏季(8月)辽东湾微藻中主要类群纲水平多样性Fig.4 OTUs richness of major taxa for all eukaryotic phytoplankton in summer
2014年夏季,甲藻纲的相对丰度范围0.19—0.76,平均值为0.54;绿枝藻纲、共球藻纲、隐藻纲、中心纲相对丰度平均值分别为0.11、0.08、0.09、0.08。巴夫藻纲(Pavlovophyceae)在5、6、7的相对丰度分别为0.06、0.04、0.09,显著高于其他站位(图5)。
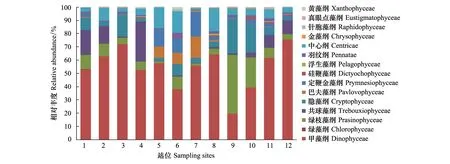
图5 夏季(8月)辽东湾微藻中主要类群相对丰度Fig.5 Relative abundance of major taxa for all eukaryotic phytoplankton in summer
2014年秋季(10月),各个样品中甲藻纲(Dinophyceae)获得注释的物种数量约占总数的44%,高于其他纲。调查海域的微藻多样性甲藻纲为优势群体,而中心纲获得注释的物种数量均为14%左右,其他纲均低于10%。真眼点藻纲在2、4、5、8、12站位出现极少量OTUs(图6)。

图6 秋季(10月)辽东湾微藻中主要类群纲水平多样性Fig.6 OTUs richness of major taxa for all eukaryotic phytoplankton in autumn
2014年秋季,其基础组成与OTUs相对应,但部分纲水平相较春季和夏季的相对丰度有所增加。甲藻纲的平均相对丰度为0.65,高于其他纲。调查海域的微藻多样性甲藻纲为优势群体,而绿枝藻纲、隐藻纲的平均相对丰度分别为0.13、0.11,以上三个纲约占整个微藻的89%(图7)。
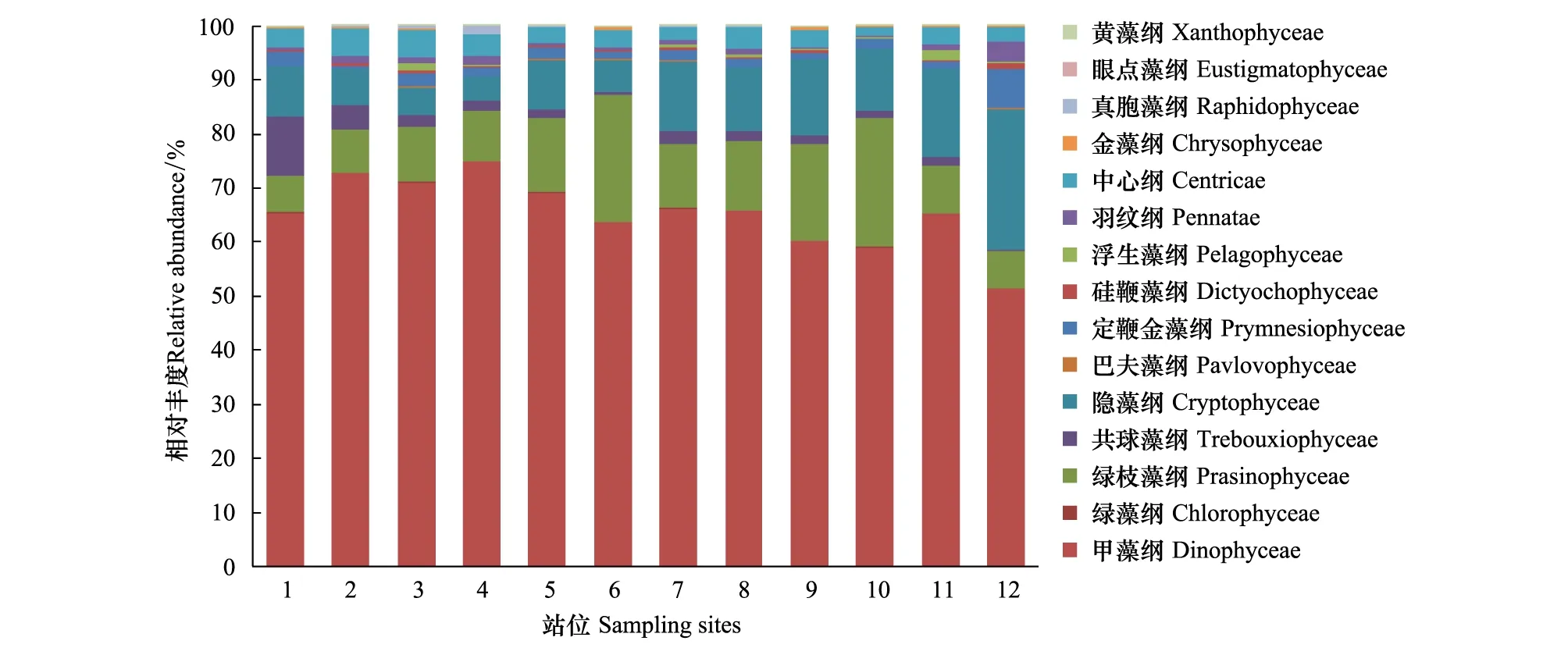
图7 秋季(10月)辽东湾微藻中主要类群相对丰度Fig.7 Relative abundance of major taxa for all eukaryotic phytoplankton in autumn
2014年冬季(12月),甲藻纲获得注释的物种数量约占总数的41%,高于其他纲。调查海域的微藻多样性甲藻纲为优势群体,而绿枝藻纲、隐藻纲、定鞭金藻纲(Prymnesiophyceae)、中心纲获得注释的物种数量均为10%左右,以上5个纲约占整个微藻的78%(图8)。
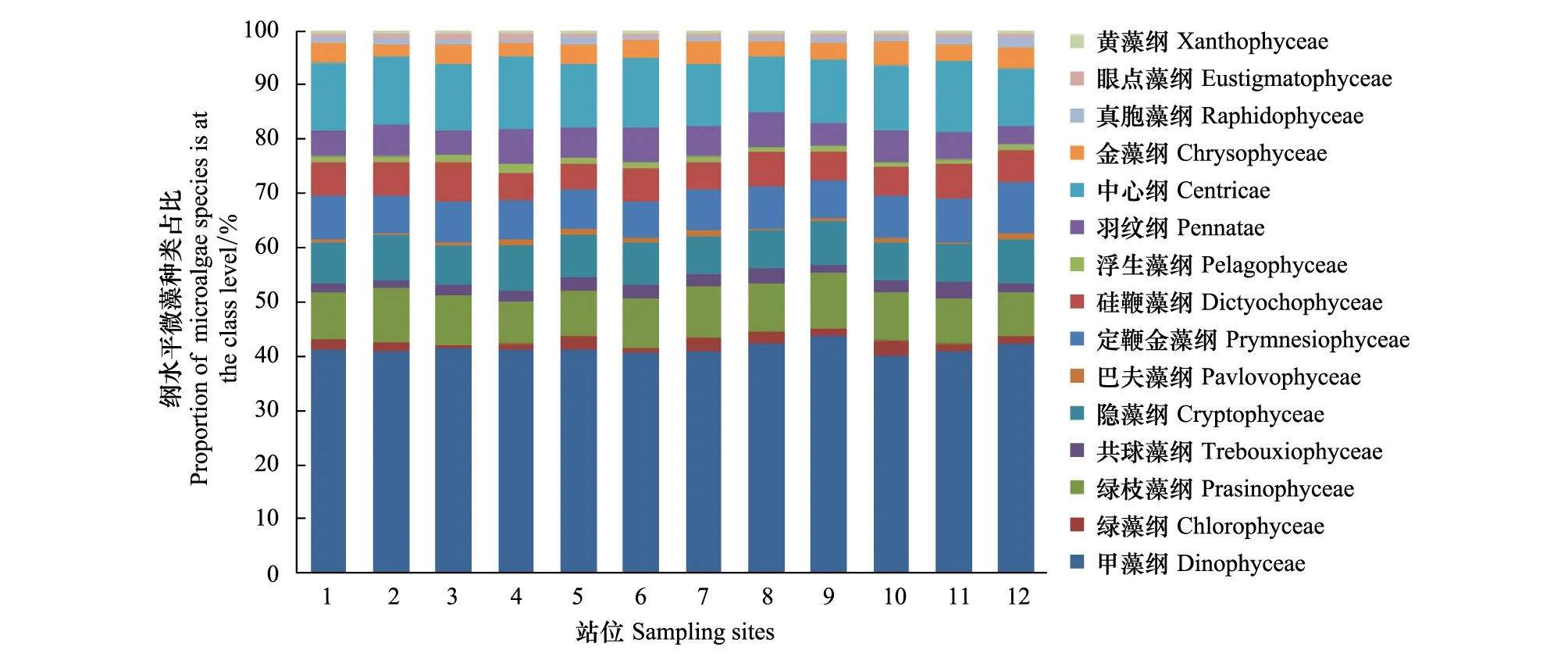
图8 冬季(12月)辽东湾微藻中主要类群纲水平多样性Fig.8 OTUs richness of major taxa for all eukaryotic phytoplankton in winter
2014年冬季,部分甲藻纲的平均相对丰度为0.55,为优势群体,而绿枝藻纲、隐藻纲的平均相对丰度分别为0.13、0.15,以上3个纲约占整个微藻的83%,明显高于其他纲。金藻纲(Chrysophyceae)在9、12站位显著高于其他站位和季节(图9)。
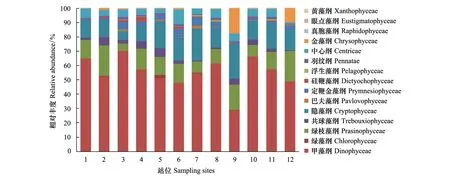
图9 冬季(12月)辽东湾微藻中主要类群相对丰度Fig.9 Relative abundance of major taxa for all eukaryotic phytoplankton in winter
2.3.2种水平微藻种类组成及相对丰度
四季共注释到种的微藻有136种(附表1),其中甲藻门(Dinoflagellata) 44种,绿藻门(Chlorophyta)17种,隐藻门(Cryptophyceae)12种,定鞭藻门(Haptophyta)18种,硅藻门(Bacillariophyceae)37种,金藻门(Chrysophyceae)6种,黄藻门(Xanthophyceae)2种。另有大部分藻类由于数据库没有序列信息而未能注释到种,主要由于部分藻类采集培养困难而无法获得鉴定信息。
2.3.3检出的藻类新种
辽东湾海域注释到种的136种真核微藻中,对比《中国海洋生物名录》[11]和《辽东湾微藻生态特征研究》[9],并查阅最新相关文献[12],发现有30种未在辽东湾海域报道过但在中国其他海域有报道,包括甲藻门11种、硅藻门9种、绿藻门4种、定鞭藻门2种、隐藻门2种、金藻门2种。另有56种在中国海域未见过报道,包括甲藻门15种、硅藻门8种、绿藻门9种、定鞭藻门12种、隐藻门8种、金藻门3种、黄藻门1种(附表1)。
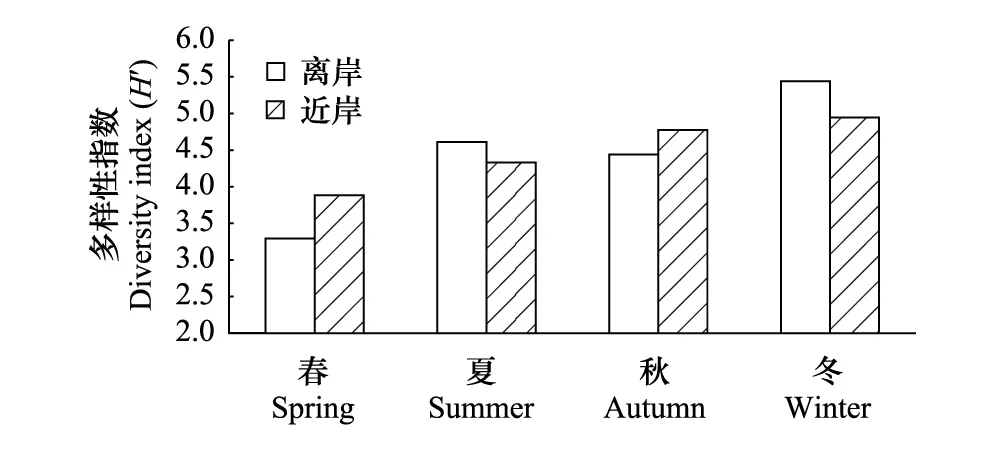
图10 辽东湾近岸、远岸多样性指数Fig.10 Inshore and far-shore diversity index of Liaodong Bay
2.3.4营养和共生模式
通过对鉴定出的藻类营养模式统计,发现81种自养型、14种异养型、41种混合营养型藻类。除以上的营养模式之外,共生生态模式也出现在调查结果中,寄生性甲藻共甲藻目的OTUs数目占总数20%,因数据库收录信息较少,绝大多数没有获得种水平的注释信息,发现的寄生性藻类杜波斯克属(Euduboscquellacachoni、Euduboscquellacrenulata)和涡轮共甲藻(Syndiniumturbo)为罕见藻类,因此辽东湾海域寄生性藻类的多样性尚需深入研究。光合共生甲藻五刺多甲藻在本次调查中也检测出其与硅藻共生,有研究表示光营养的鳍藻属起源于隐藻属的叶绿体,本次检出两种鳍藻[13]。
2.3.5多样性评价
多样性指数分析结果表明,辽东湾海域微藻多样性指数春、夏、秋、冬总体呈现上升趋势,春季(5月)和夏季(8月)波动较大,而秋季(10月)和冬季(12月)相对稳定,且多样性水平较高。多样性指数在春、秋季近岸高于离岸海域,在夏、冬季离岸高于近岸海域(图10)。全年来看,多样性指数波动较大的站位为1、3、6、7、8、12号(图11)。
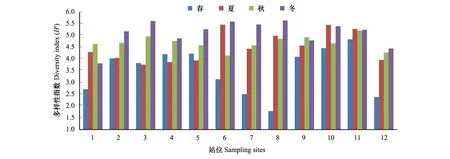
图11 辽东湾各站位多样性指数Fig.11 Diversity index of each station in Liaodong Bay
2.3.6优势种统计
本文统计了辽东湾海域不同季节优势度大于0.02的微藻(注释到目、科、属、种的全部统计,表2)。其中共甲藻目Syndiniales 2优势度最高,春季达到了0.34,秋季达到了0.13,为绝对优势种;其次为夜光藻(Noctilucascintillans),春、夏、秋、冬均为主要优势种,冬季优势度达到了0.10,成为绝对优势种,而且其细胞较大,在水体中所占体积也较大。另外在四个季节均为优势种的还有葡萄藻属(Bathycoccussp.)、细小微胞藻(Micromonaspusilla)、微拟球藻(Nannochlorissp.)、纤细全沟藻(Teleaulaxgracilis)。褐潮致灾种抑食金球藻(Aureococcusanophagefferens)在春季优势度非常明显。
春、夏季已知有毒优势种类为凯伦藻属(Kareniaceaesp.)、黄金色鞭毛藻(Poterioochromonasmalhamensis)、鱼腥棕囊藻(Phaeocystiscordata)、抑食金球藻(Aureococcusanophagefferens)(部分注释到目、科的无法查询毒性)。

表2 辽东湾海域微藻优势种统计表
3 讨论
3.1 基因测序获得的藻类新种
基因测序技术的快速发展突破了微微型微藻传统形态学鉴定局限,提高了调查灵敏度、准确度和检测效率。辽东湾海域注释到种的真核微藻有136种,有41%的种类在中国海域未见报道,甲藻门和定鞭藻门居多。不可否认,新发现的藻类也可能是本海域土著种。另外,前期网采调查发现本海域微藻共有95种[9],本次基因检测的136种并未全部涵盖前期发现的种类,主要原因可能是由于某些种类很难培养,基因序列无法获得,造成18s rDNA微藻数据库种类不全,注释到种的成功率较低。
3.2 微藻群落结构特征
早期研究认为微藻都是光合自养生物,具有类似的生态需求,按生态学竞争排斥原理,它们对水体资源,特别是对营养物质的竞争,最终应仅剩下一个或几个最能有效地利用有限资源的种类。与竞争排斥理论相悖,在自然界同一水体中,经常可以有几十种微藻共存,即浮游生物的反悖论。本研究发现,注释到种的微藻有60%自养型、10%异养型、30%混合营养型。绿藻门、隐藻门、定鞭藻门基本是自养型,甲藻门都是异养型,混合营养型除了绿藻门,其他门都有出现。四季平均每个站位获得种水平上微藻的OTUs数为178个,由于营养模式不同,才得以共存同一水体中。
甲藻具有多种营养模式,包括自养型、异养型、混合营养型,能够在低光照条件下利用微小的溶解有机物满足其生长和繁殖[14-16]。另外,一些光合自养型甲藻可与硅藻、隐藻、绿藻共生,还有一些寄生性甲藻含有叶绿体,具有混合营养型的生理模式,相对于光合营养型,混合营养型的微藻生态竞争力更强[17-19]。
异养型微藻主要利用渗透营养和吞噬营养。渗透营养可直接吸收溶解态有机物质,例如抑食金球藻通过渗透营养吸收用于生长的有机氮[20]。吞噬营养通过吞噬其他藻类或者悬浮颗粒的方式获得营养,特别是对C、N、P,甚至Fe的获得,而这种营养方式在有害藻类中比较常见,比如红色赤潮藻(Akashiwosanguinea),塔玛亚历山大藻(Alexandriumtamarense)、伊姆裸甲藻(Gymnodiniumimpudicum)、多纹膝沟藻(Gonyaulaxpolygramma)、多环旋沟藻(Cochlodiniumpolykrikoides)、赤潮异弯藻(Heterosigmaakashiwo)[21-22],与严格的自养型相比,吞噬营养作用能显著提高某些有害藻类的生长速率,例如多环旋沟藻(Cochlodiniumpolykrikoides)和多纹膝沟藻(Gonyaulaxpolygramma)。在藻华后期,营养元素消耗殆尽,一些有害藻类会通过吞噬营养方式维持种群密度。辽东湾不同季节营养盐含量的变化也会制约微藻的繁殖生长。
从多样性指数变化规律也可以了解微藻群落结构稳定性变化趋势,辽东湾海域微藻多样性指数春、夏、秋、冬总体呈现上升趋势,表明微藻群落结构日趋稳定,且在春、秋季近岸比离岸海域稳定,夏、冬季离岸比近岸海域稳定。当然,本文进行的物种多样性和优势度研究是基于注释微藻的序列数统计分析的,由于各微藻基因组中18S rDNA拷贝数不同,因此用各微藻序列数代表丰度统计可能存有偏差。
综上,环境eDNA技术突破了微微型微藻传统形态学鉴定局限,可以精准高效地检测微藻群落结构,丰富了中国海域微藻名录和外来海洋微藻背景数据库[23]。总之,未来辽东湾海域的环境eDNA技术研究需要长时间和高频率的开展,进而为赤潮、褐潮生态风险评估和区划提供科学参考[24]。
