热重分析法在高考化学试题中的考查
2020-11-13福建洪兹田新疆张新芹
福建 洪兹田 新疆 张新芹
热重分析法(简称热重法)为大学无机化学内容,但近年来高考热重分析法与中学内容相结合的定量考查方式悄然兴起。热重法常以热重(TG)曲线呈现实验数据。此类曲线表征类试题旨在考查学生分析图象、获取信息、数据处理以及文字表述的能力。通过分析热重曲线,我们可以知道样品及其可能产生的中间产物的组成、热稳定性、热分解情况及生成的产物等与质量相联系的信息。
一、热重法及TG曲线简介
1.热重法
热重法(Themogravimetry,简称TG),是指在程序控制温度下测量物质的质量与温度或时间的关系的方法。热重分析所用的仪器是热天平,它的基本原理是将样品质量变化所引起的天平位移量转化成电磁量,这个微小的电量经过放大器放大后,送入记录仪记录,而电量大小正比于样品的质量变化量。当被测物质在加热过程中有升华、汽化、分解产生气体或失去结晶水时,被测物质质量就会发生变化。
2.热重(TG)曲线
理想的TG曲线是一些直角台阶。台阶大小表示质量变化量,一个台阶表示一个热失重,两个台阶之间的水平区域代表试样稳定存在的温度范围。通常横坐标表示温度或时间,纵坐标表示试样质量或残留率。
例如,草酸钙晶体(CaC2O4·H2O)在N2氛围中的热重曲线如图1所示:

图1 草酸钙晶体在N2氛围中的热重曲线
①热重曲线中第一个平台在100℃以前,固体组成为CaC2O4·H2O。此阶段没有发生化学反应。




二、热重曲线的线段类型和表示意义
1.热重曲线中的基本线段类型(如图2)

图2 热重曲线中的基本线段类型
2.基本线段所表示的意义(见表1)
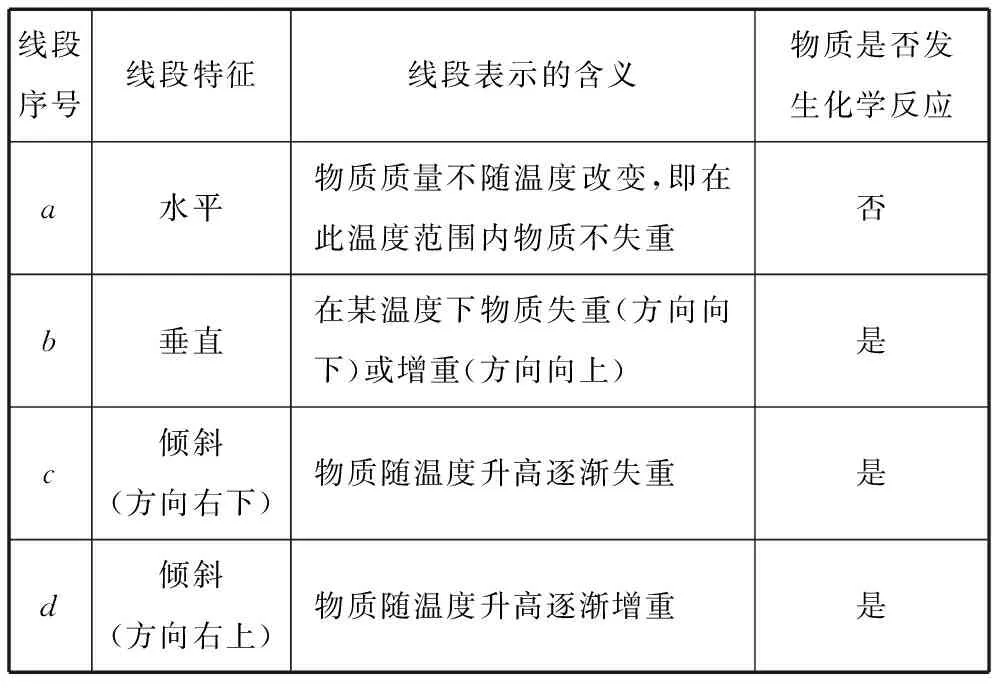
表1 线段所表示的意义
三、热重曲线试题的解题模式
热重曲线中试样变化基本集中在脱水、分解、氧化、还原等方式。不同的试样重量变化方式可能是一种或多种组合,有的热重实验仅存在一种反应类型,相对简单,较多的实验试样存在两种或两种以上的反应类型,导致热重曲线试题难度增加,需要分步解答。以水合物脱水、氢氧化物分解和氧化物氧化为例,对热重曲线试题的解题模式进行归纳(如图3)。
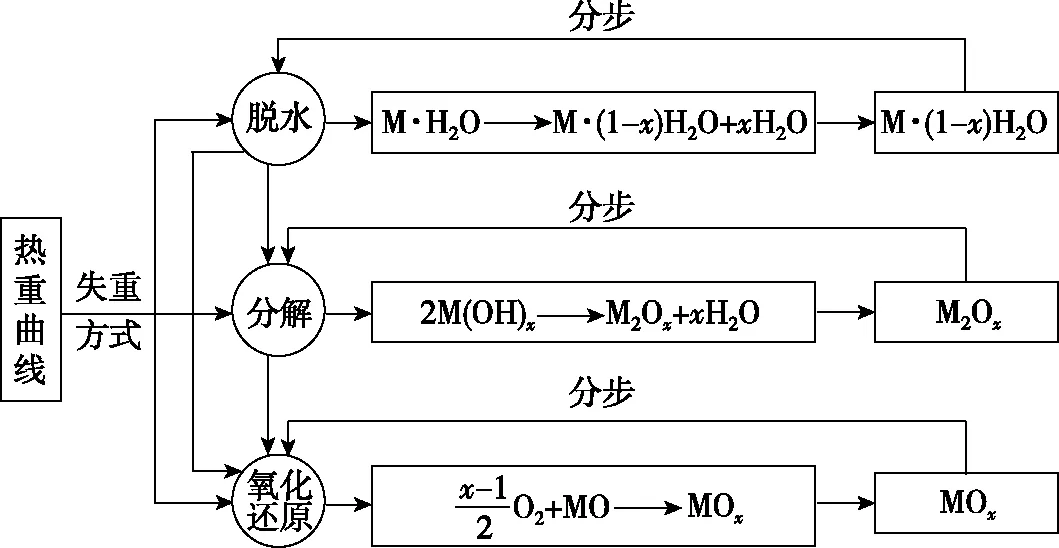
图3 热重曲线试题的解题模式
四、热重曲线问题的常用解题方法
含有结晶水的固体样品在加热过程中,首先考虑的是失去部分(或全部)结晶水。当失去全部结晶水时可能会进一步分解释放出气体物质(例如,对氢氧化物常进一步释放出水蒸气,对草酸盐常进一步释放出CO、CO2等)得到金属氧化物。若生成的金属氧化物具有较强还原性,则可能会进一步被热重实验中的空气氧化。不管是哪种情况,受热过程中,金属元素会残留在最终的固体中,即金属元素质量守恒。热重曲线试题的解题方法有差量法、元素守恒法、相对原子质量法(摩尔质量法)、假设法、公式法等。本文重点介绍最常用的差量法和元素守恒法。
1.利用差量法分析
(1)【例1】(2011·全国卷·26节选)0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图4所示。请回答下列问题:

图4 CuSO4·5H2O的热重曲线
(1)试确定200℃时固体物质的化学式________(要求写出推断过程)。
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______________________________;把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为________,其存在的最高温度是________。
【答案】(1)CuSO4·H2O
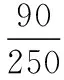
250 18n
0.80 g 0.23 g

200℃时产物为CuSO4·H2O晶体。
【解析】CuSO4·5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解。分析CuSO4·5H2O受热过程的热重曲线:
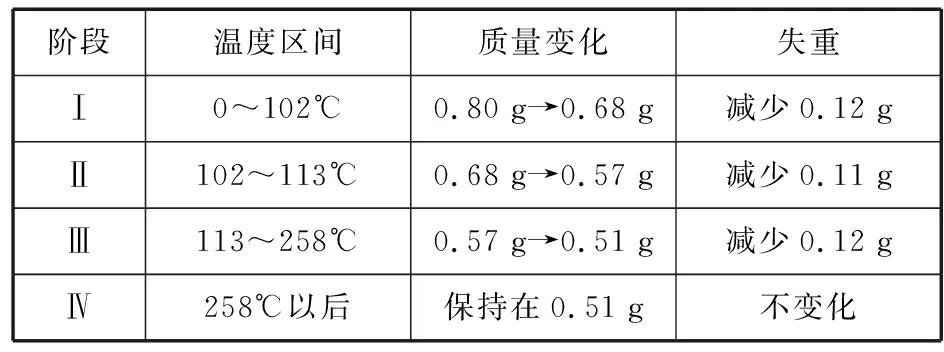
阶段温度区间质量变化失重Ⅰ0~102℃0.80 g→0.68 g减少0.12 gⅡ102~113℃0.68 g→0.57 g减少0.11 gⅢ113~258℃0.57 g→0.51 g减少0.12 gⅣ258℃以后保持在0.51 g不变化

250 18n
0.80 g 0.23 g

(2)解题关键
根据物质性质初步猜测固体受热失重的可能原因。分析热重曲线中不同温度区间内固体失重的质量,结合化学方程式运用差量法列式求算。
(3)【练习1】(2019·全国卷Ⅰ·27节选)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为________。
【答案】NH4Fe(SO4)2·12H2O
【解析】本题虽无热重曲线,但用直接描述的形式给出失去1.5个结晶水和失重率为5.6%的关键数据。取1 mol硫酸铁铵晶体样品[NH4Fe(SO4)2·xH2O],则150℃时样品失重的质量为(266+18x) g×5.6%,即为生成H2O的质量,即(455+18x)×5.6%=18×1.5,解得x=12。故硫酸铁铵晶体化学式为NH4Fe(SO4)2·12H2O。
2.利用元素守恒法分析


图5 PbO2的热重曲线
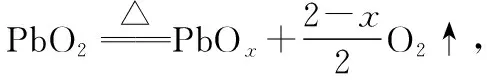


(2)解题关键
抓住受热过程中,金属元素全部会残留在最终的固体产物中。围绕反应前后,金属元素的质量守恒进行相关计算。
(3)【练习2】称取3.60 g草酸亚铁晶体(FeC2O4·2H2O,相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图6所示,请回答下列问题:

图6 草酸亚铁晶体的热重曲线
(1)过程Ⅰ发生反应的化学方程式为_________________
(2)300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式________。

(2)Fe2O3

根据Fe守恒,草酸亚铁晶体中铁元素的质量即为300℃时铁的氧化物中铁元素的质量,
铁的氧化物中,m(Fe)=1.12 g,m(O)=1.60 g-1.12 g=0.48 g。
即铁的氧化物的化学式为Fe2O3。
五、热重曲线问题命题趋势预测
随着近几年高考对信息获取与加工能力要求的逐步提高,图象分析试题已成为高考化学试卷中备受青睐的热点题型。热重分析法作为大学内容与中学定量分析方法的重要结合点,既能考查学生的曲线表征和数据处理能力,又能考查学生的证据识别与推理能力。因此,预测在2020年的全国卷高考中,以热重曲线为载体的热重分析法的考查应引起足够重视。该类题型的考查可能出现在选择题(尤其是后两题)中,也可能出现在大题(实验综合题、工业流程题、化学反应原理题)中物质成分的定量测定中。
