辅助性T细胞17与牙周炎骨免疫
2020-11-11吕辉王华孙雯
吕辉 王华 孙雯
1.江苏省口腔疾病研究重点实验室 南京 210029;2.南京医科大学口腔医学院 南京 211166
牙周炎是最为常见的口腔炎性疾病之一。最新的分类标准根据牙周炎的严重性和复杂程度,将其分为4个不同的阶段(Stage Ⅰ~Ⅳ),又根据疾病的生物学特征,分为3个不同的等级(Grade A~C)[1]。牙周炎的始动因素为菌斑微生物[2];牙石、创伤性咬合等是牙周炎的局部促进因素;吸烟、精神压力及内分泌失调等是牙周炎的全身刺激因素。牙周炎还与糖尿病、心脑血管疾病、早产、胃病等全身性疾病密切相关[3-6]。流行病学调查[7]显示,全球牙周炎的患病率高达11.2%,且在40岁左右达患病高峰。
牙周炎晚期的症状主要为牙周组织破坏严重、牙槽骨吸收、牙齿松动等[8]。研究[9]表明,牙周炎导致的骨组织丧失与炎症诱导的免疫反应有着密切联系,这一过程不仅与单核巨噬细胞、成纤维细胞等介导的固有免疫反应相关,更与T细胞、B细胞介导的适应性免疫反应紧密关联。
T细胞是淋巴细胞的重要组分,主要亚型包括辅助性T(T helper,Th)细胞、调节性T(regulatory T,Treg)细胞、抑制性T细胞和细胞毒性T细胞等,它们均在牙周炎的发展过程发挥各不相同的作用[10]。其中,Th细胞包括Th1、Th2和Th17等细胞亚型。Th17细胞是机体免疫防御中的重要一员,在牙周炎的免疫进程中发挥重要作用[11]。Th17细胞可以保护机体免受致病菌的侵害,抑制感染;同时,Th17细胞又可以影响成骨细胞骨形成,诱导破骨细胞骨吸收,造成骨组织的损伤[12]。本文对Th17细胞的分化过程和调节因素,以及其在牙周炎过程中对骨免疫的影响进行综述。
1 Th17细胞与牙周炎
1.1 Th17细胞的表达
Th17细胞作为CD4+Th亚群中的一员,可特征性地分泌白细胞介素(interleukin,IL) -17,因此被命名为Th17细胞[13]。牙周炎患者的牙周组织及龈沟液中Th17细胞的细胞因子谱(包括IL-17等)表达显著增高[14-15]。Chen等[16]证实了Th17细胞增多及IL-17表达增高与牙周炎之间存在一定的相关性。这些都说明Th17细胞确实存在于牙周炎患者的牙周支持组织。
1.2 Th17细胞的发生
在牙周炎发生过程中,Th17细胞是机体的免疫系统在受到致病菌刺激后产生的。有研究[17]表明,这一过程与单核细胞的提呈有关,一些牙周炎致病菌,如牙龈卟啉单胞菌和伴放线放线杆菌等,可通过激活单核细胞令其CD40、CD54和HLADR表达增加,从而导致肿瘤坏死因子(tumor necrosis factor,TNF)-α、IL-1β、IL-6和IL-23的释放增加,最终引起CD4+T细胞向Th17细胞分化。
1.3 Th17细胞分化的调节
Th17细胞的分化过程受多种IL的调节,例如IL-1、IL-6、IL-12和IL-23可促进Th17细胞分化;相反,IL-4与IL-35则有抑制Th17细胞分化的作用。其中,IL-6在Th17细胞分化和发挥细胞功能两方面均有重要的作用[18-19]。研究[18]表明,IL-6可通过激活Janus蛋白酪氨酸激酶(Janus protein tyrosine kinase,JAK)/信号传导子与转录激活因子(signal transducer and activator of transcription,STAT)通道来活化细胞,还可以通过稳定转录因子RORγt来促进IL-17的表达。在Th17细胞的成熟过程中,IL-1受体表达水平的上调也可促进Th17细胞的分化[20]。此外,IL-12、IL-23在Th17细胞的活化发生过程中也发挥重要作用[21];与此相反,IL-4则是起到抑制初始CD4+T细胞向Th17细胞分化的作用[22];IL-35可以抑制Th17细胞发挥其免疫调节作用[23]。
除IL外,γ干扰素和转化生长因子(transforming growth factor,TGF)-β等细胞因子也在Th17细胞的分化过程中起重要的调节作用[22,24]。研究[25]表明,TGF-β水平上升,RORγt表达增加,Th-17细胞的分化增加。TGF-β还可与IL-6联合作用,诱导Th17细胞的分化[26]。牙周炎病变微环境内的其他细胞对Th17细胞的分化也具有一定的影响。例如,在缺乏朗格汉斯细胞的牙周炎小鼠体内,原始CD4+T细胞倾向于分化为Th1细胞,而Th17细胞的分化被抑制[3]。在分化发生与控制炎症发展方面,Treg细胞与Th17细胞存在着此消彼长的关系,因此可将Treg细胞与Th17细胞的比值视作衡量炎症严重程度的重要参数之一[27]。
2 Th17细胞与牙周炎骨免疫
2000 年Arron等[28]提出“骨免疫学”的概念,描述了骨骼系统与免疫系统细胞间的相互作用、免疫失调可导致的骨代谢异常。骨代谢受到成骨细胞和破骨细胞的调节,成骨细胞生成骨质,破骨细胞吸收骨质,二者共同维持着骨组织的动态平衡。Th17细胞作为免疫细胞中的重要一员,在牙周炎骨代谢中发挥重要作用。
2.1 Th17细胞与间充质干细胞及成骨细胞
间充质干细胞可介导牙周组织的再生,但在炎症环境下,这一功能出现异常[29]。间充质干细胞与Th17细胞之间的关系较为复杂。首先,间充质干细胞可抑制Th17细胞的分化,减少IL-17的表达[30-31];间充质干细胞通过上调程序性死亡受体-1配体(programmed death receptor-1 ligand,PD-L1)的表达,从而加强了对Th17细胞分化的抑制作用[32]。因此有学者[33]认为,在治疗牙周病时,可利用间充质干细胞下调Th17细胞的分化,进而调节Treg细胞与Th17比值,以达到抑制免疫反应和骨吸收、促进骨再生的作用。但也有体外实验[34-35]证实,这种抑制Th17分化的作用受间充质干细胞与活化T细胞数目比值的影响,在特定的比例或浓度下会诱导Th17细胞的分化。其次,Th17细胞诱导巨噬细胞等产生的促炎性细胞因子(如TNF-α和IL-1等)对间充质干细胞也有影响。
TNF-α可诱发牙周间充质干细胞产生炎症反应[36]。TNF-α也对间充质干细胞的分化有调节作用,可通过Wnt信号通路、骨形态发生蛋白(bone morphogentic protein,BMP)信号通路及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路等通路,抑制间充质干细胞的成骨分化与骨形成[37]。而IL-1则对间充质干细胞有双重作用,在低浓度时通过BMP/Smad信号通路促进间充质干细胞的成骨,高浓度时通过核因子(nuclear factor,NF)-κB和MAPK信号通路抑制成骨[38]。
成骨细胞主要由间充质干细胞分化而来,能特异性分泌多种生物活性物质,参与骨形成进程。Mansoori等[39]在成骨细胞中加入IL-17,发现成骨细胞数量减少,这表明IL-17可诱导成骨细胞的凋亡。此外,TNF-α亦对成骨细胞的凋亡起到关键作用。在用3-乙酰基-11-酮基-β-乳香酸抑制TNF-α活性后,成骨细胞的分化作用增强[40],这表明TNF-α抑制成骨细胞的分化。具体来说,TNF-α可通过下调B淋巴细胞瘤-2基因(BCL-2)、活化半胱天冬酶以及促进细胞色素C的释放来介导成骨细胞的凋亡[41]。另一方面,成骨细胞表达热休克蛋白22,参与TNF-α刺激的IL-6合成,从而促进Th17细胞的分化[42]。而IL-6可在体外通过包含Src同源结构域2的蛋白酪氨酸磷酸酶(Src-homology domain 2 containing protein-tyrosine phosphatase,SHP2)/丝裂原活化蛋白激酶胞外信号调节激酶激酶(mitogen-activated protein kinase-extracellular signal-regulated kinase kinase,MEK)和SHP2/蛋白激酶B(protein kinase B,PKB,Akt)2途径抑制成骨细胞的分化[43]。上述过程是否会加剧牙周炎骨丧失的进程仍有待进一步研究。此外,Th-17细胞因子谱系的新成员IL-26亦可促进成骨细胞分化和骨形成[44]。
2.2 Th17细胞与破骨细胞
破骨细胞来源于单核巨噬细胞系统。破骨细胞的前体细胞表达核因子κB受体活化因子(receptor activator of nuclear factor κB,RANK),与核因子κB受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)结合后,在巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)刺激下得以成熟。牙周炎患者组织中的RANKL和M-CSF含量升高,为破骨细胞的成熟提供了局部环境[45-46]。
破骨细胞骨吸收主要依靠溶酶体的作用,一方面可以酸化骨陷窝;另一方面可以调节骨细胞间基质[47]。
王中秀等[48]通过对比牙周炎大鼠与正常大鼠的牙周组织IL-17含量、破骨细胞计数、骨吸收陷窝计数及牙槽骨高度,证实Th17细胞对破骨细胞骨吸收具有促进作用。而de Aquino等[49]通过对IL-17受体A基因缺失小鼠的牙周炎骨丧失模型研究发现,牙周炎骨丧失依赖于Th17细胞的扩增和IL-17信号传导。
Th17细胞要发挥对破骨细胞的作用,主要依靠其分泌的细胞因子及其诱导巨噬细胞、成纤维细胞和上皮细胞产生的促炎性细胞因子,这些细胞因子包括IL-1、IL-6、IL-17、IL-23和TNF-α等。其中,IL-1、IL-17和TNF-α促进破骨细胞的表达,加剧骨破坏;IL-6和IL-23的作用具有两面性。
1)IL-17:作为Th17细胞分泌的特征性细胞因子,在引起口腔炎症疾病中起重要作用。IL-17可在牙周炎患者的牙槽骨中大量表达[14]。IL-17上调对破骨细胞的活化具有促进作用,可增加Th17细胞表达RANKL并促进其与破骨细胞前体细胞表面的RANK结合,在M-CSF的作用下,促进破骨细胞的成熟[50]。
2)IL-1:与IL-17相似,在Th17细胞的分化与成熟过程中也呈高表达[19],且与牙周病的发生有显著的相关性[51]。IL-1可以活化组织蛋白酶K(cathepsin K)[52]。组织蛋白酶K是破骨细胞溶酶体中的关键蛋白酶,可分解骨基质中的骨胶原纤维[53]。另一方面,用激光降低患者牙周IL-1水平后,可治疗牙周炎,缓解牙槽骨损伤,亦印证了IL-1在促进破骨细胞骨吸收中的作用[54]。
3)IL-6和IL-23:在骨损伤中的作用具有两面性。首先,IL-6具有诱导Th17细胞分化[18]和缓解炎症[55]的作用。Balto等[55]发现,IL-6基因缺失的牙周炎小鼠牙槽骨吸收明显增加,这表明IL-6有缓解炎症、减弱骨吸收的作用。此外,在体外IL-6可增加RANKL mRNA的表达,说明IL-6亦对破骨细胞的分化有一定影响[56]。IL-23对破骨细胞的成熟具有促进作用,通过刺激成骨细胞高表达RANKL和促进破骨细胞前体细胞高表达RANK,从而加快破骨细胞骨吸收[57-58]。Shukla等[59]也证实,利用抗IL-23抗体治疗,可明显缓解骨丧失情况。但IL-23可诱导T细胞分泌GM-CSF来抑制破骨细胞的形成[60],这又体现了IL-23在骨损伤中的抑制作用。
Th17细胞还可通过调控骨保护素(osteoprotegerin,OPG)/RANKL/RANK系统对破骨细胞发挥作用。Th17与RANKL具有正相关性[61]。RANKL分为分泌型和膜结合型2种,可由不同的细胞产生。Tsukasaki等[12]研究发现,牙周炎中RANKL主要是由IL-17诱导产生的膜结合型RANKL。而RANKL可通过诱导破骨细胞分化以及破骨细胞特异性蛋白(如活化T细胞核因子- 1、组织蛋白酶K、抗酒石酸酸性磷酸酶等)的表达,显著提高局部破骨细胞数量,促进骨吸收[62-63]。此外,IL-17可导致RANKL与OPG的mRNA之比增加,在上调RANKL表达的同时下调OPG的表达,从而建立有利于骨破坏的环境[64-65]。
除上述途径外,机体亦可通过调节Treg细胞/Th17细胞的比例来促进或抑制破骨细胞的生成。研究[66]表明,Fms样酪氨酸激酶3配体会下调Treg细胞/Th17细胞的比例,促进破骨细胞骨吸收。
3 小结
Th17细胞作为CD4+T细胞亚群中的重要一员,在牙周炎骨免疫中发挥重要作用。随着基础和临床研究的不断深入,很多证据提示Th17细胞可以通过分泌细胞因子直接作用于牙周组织的破骨细胞、间充质干细胞和成骨细胞,直接调控牙周炎的骨损伤和骨重塑过程。Th17细胞在牙周炎骨免疫中的作用如图1所示。
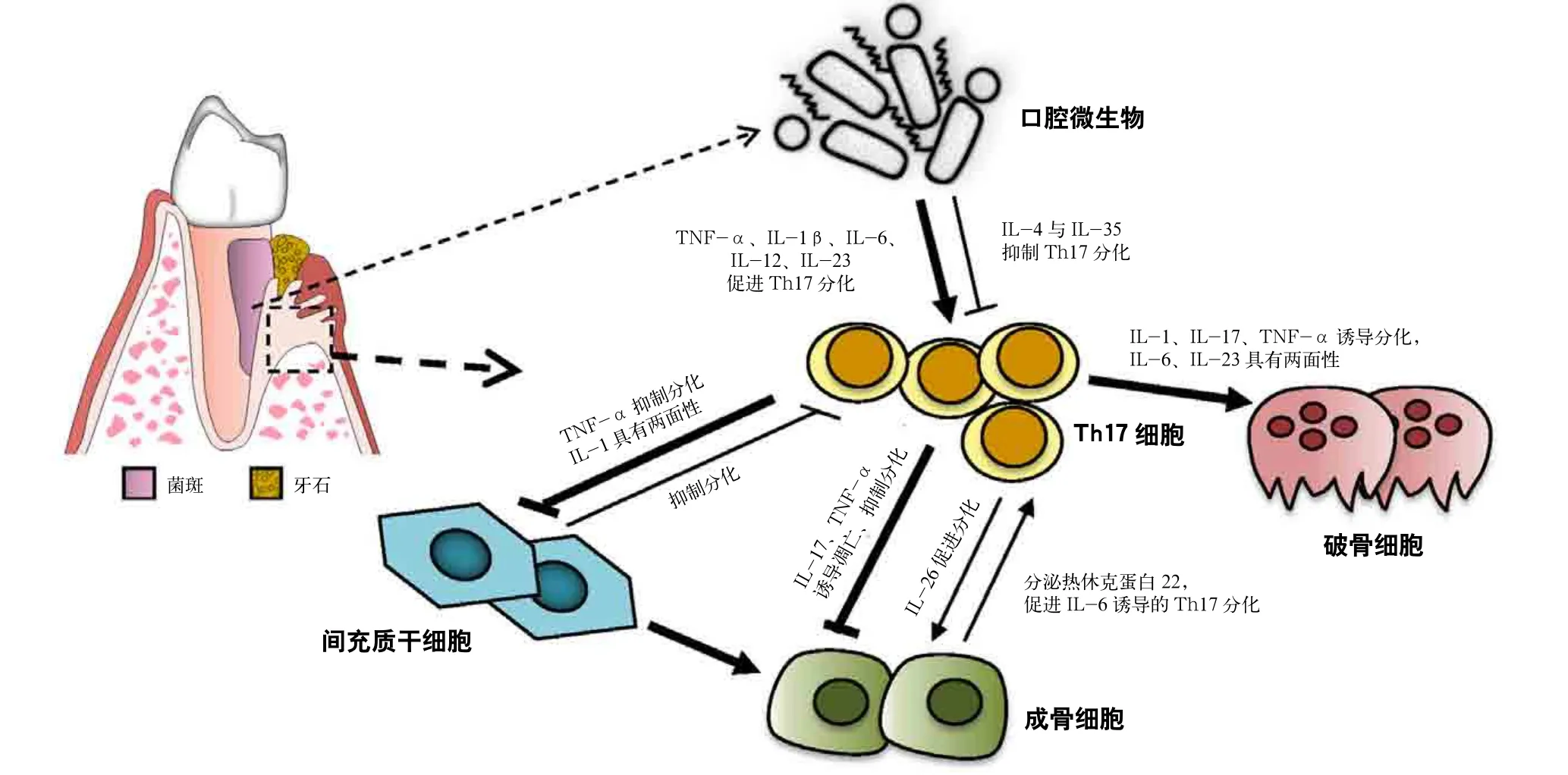
图1 Th17 细胞在牙周炎骨免疫中的作用Fig 1 Role of Th17 cells in periodontitis related osteoimmunology
在牙周炎免疫微环境内,1)口腔微生物上调TNF-α、IL-1β、IL-6、IL-12、IL-23,促进Th17细胞分化,同时又可通过上调IL-4与IL-35抑制Th17细胞分化。2)Th17细胞上调TNF-α,抑制间充质干细胞的成骨分化,而IL-1对间充质干细胞有双重作用;反之,间充质干细胞又可抑制Th17细胞的分化。3)Th17细胞通过分泌IL-17、上调TNF-α诱导成骨细胞凋亡并抑制其成骨分化,而其分泌的IL-26可以促进成骨细胞分化;反之,成骨细胞分泌的热休克蛋白22可以促进IL-6诱导的Th17细胞分化。4)Th17细胞通过分泌IL-17、上调IL-1和TNF-α诱导破骨细胞分化,而其分泌的IL-6、IL-23对破骨细胞的分化具有双重作用。
牙周炎的免疫微环境是一个复杂的整体,所有微环境内的成员都互相依存,互相影响。因此,所有治疗方案的提出都不能仅仅针对某一细胞组分或是其分泌的细胞因子,应当就牙周炎免疫微环境内所有成员进行整体的评估和考量。这提示需从整体评估治疗效果,包括评估炎症的控制、牙周新附着的形成、破骨细胞骨吸收的抑制,以及间充质干细胞的成骨向分化与骨形成等。然而,目前大部分研究仅针对某一种细胞因子在牙周炎中的致病作用进行研究。例如,IL-17免疫缺陷小鼠表现出广泛的黏膜易感染性和炎症应答障碍[67];TNF-α敲除小鼠对牙龈卟啉单胞菌诱导的牙周炎骨丧失具有抵抗能力,明确了TNF-α在实验性牙周炎中的致病作用[68]。但除了Th17细胞,巨噬细胞也分泌IL-17和TNF-α,因此上述影响不一定仅是IL-17细胞产生的作用。有研究[69]通过特异性敲除Th17细胞的关键调控基因Rorc,从而下调Th17细胞的数量,抑制了实验性牙周炎小鼠的骨丧失;同时,Th17细胞分化基因缺陷患者也表现出对牙周炎症易感性的降低。该研究明确地证实了Th17细胞在牙周炎中的整体作用是促进牙周炎相关的骨丧失,但是该研究没有进一步研究Th17细胞缺陷的情况下,牙周组织中破骨细胞、间充质干细胞和成骨细胞的变化。相信利用该模型的深入研究,可以进一步明确Th17细胞在牙周炎骨免疫微环境中的具体作用。
综上所述,骨免疫领域的快速发展揭示了骨骼系统与免疫系统之间的联系,而研究Th17细胞在牙周炎骨免疫中的作用可为牙周炎的临床治疗提供新的思路。
