循环肿瘤细胞在前列腺癌诊断中的价值
2020-11-10周旭东赵兴华许长宝郝斌李武学赵永立
周旭东 赵兴华 许长宝 郝斌 李武学 赵永立
郑州大学第二附属医院泌尿外科(郑州450000)
前列腺癌是泌尿外科最常见的恶性肿瘤之一,在美国前列腺癌的发病率已经超过肺癌成为第一位危害男性健康的肿瘤[1]。近年来,随着人们生活水平及生活方式的改变,前列腺癌的发病率和病死率呈逐年上升趋势。由于前列腺癌临床症状不明显,发病隐匿,诊断率低,发生、发展以及治疗复杂,严重危害男性健康,因此对前列腺癌患者进行进行早期筛查诊断以及干预治疗显得尤为重要[2-3]。目前的诊断方法主要包括直肠指诊(DRE),前列腺特异抗原(PSA)以及穿刺活检,但这些方法存在一定的不足,无法早期准确全面的评估患者的病情。循环肿瘤细胞(CTCs)作为一种非侵入性的新型诊断标志,有助于肿瘤微转移的早期发现和预后评估,在治疗检测以及个体化治疗中具有重要的临床意义[4-5]。目前,有研究表明CTCs 检测有助于前列腺癌的早期诊断,但尚无研究确定其最佳临界值,并且缺乏与PSA 的随机对照研究[6]。本文旨在评估CTCs 水平与前列腺癌患者临床指标、病理评分等的相关性,探讨CTCs 检测在前列腺癌初步诊断和预后判断中的价值。
1 资料与方法
1.1 一般资料选择2016年9月至2019年9月在郑州大学第二附属医院泌尿外科住院治疗的78 例前列腺癌患者作为研究组,年龄68 ~89 岁,平均年龄(73.54 ± 6.17)岁。选择同期于我院体检的健康人群35 例作为对照组,年龄67 ~87 岁,平均年龄(73.28 ± 6.12)岁。所有研究组患者均进行前列腺穿刺活检,记录Gleason评分结果,其中36例行前列腺癌根治性切除术,记录病理分期结果;所有入选者均知晓本次研究并自愿签署知情同意书。排除标准:(1)合并有其他肿瘤病史者;(2)合并严重基础疾病者;(3)合并血栓性疾病、感染性疾病者;(4)1 周内血透、输血以及使用凝血药物者;(5)有长期激素服用史或者1个月内有手术创伤病史者。
1.2 方法
1.2.1 CTCs 检测本研究应用CanPatrolTM二代CTC 检测技术对所有研究对象外周血进行CTCs检测,步骤如下:(1)样本采集:使用8 号采血针采集外周血样本7.5 mL 置于EDTA 抗凝采血管,并进行预处理;(2)CTC 富集:将预处理样本于过滤器中进行抽滤,利用CTC 和白细胞的大小差异进行分离和富集;(3)基因探针杂交:使用DAPI 核染色和CD45、上皮型和间质型mRNA 进行杂交;(4)信号标记探针杂交:使用标记有荧光免疫的标记针与扩增探针进行杂交,产生荧光信号;(5)识别:利用自动成像荧光显微镜阅读荧光信号。DAPI 阳性、CD45 阴性、间质型标志物波形蛋白和扭曲蛋白或上皮型标志物EpCAM 和细胞角蛋白8/18/19阳性则判定为CTC。根据国内外参考文献[7],定义CTCs ≥5个/7.5 mL外周血为CTCs阳性,<5个/7.5 mL外周血为CTCs 阴性。
1.2.2 资料采集所有入组对象记录年龄、体质指数(BMI)、既往病史、生活习惯(吸烟史、饮酒史)、血红蛋白(HB)、血小板(PLT)、纤维蛋白原(FIB)、D-二聚体(D-D)、白蛋白(ALB)、碱性磷酸酶(AKP)、乳酸脱氢酶(LDH)、前列腺特异抗原(PSA)、前列腺磁共振(MRI)、骨扫描、腹部CT 等结果;研究组记录前列腺穿刺活检后Gleason 评分结果并记录36 例行前列腺癌根治术后患者的病理分期结果。
1.3 统计学方法运用SPSS 22.0软件对数据进行录入和分析。计量资料以平均数±标准差表示,两组比较采用t检验,多组比较采用方差分析;计数资料以例(%)表示,比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 研究组和对照组一般资料及CTCs 阳性率比较两组年龄、BMI、高血压史、高血脂症史、糖尿病史、吸烟史、饮酒史差异无统计学意义(P>0.05),研究组CTCs 阳性率显著高于对照组(P<0.05)。研究组中41 例发生前列腺癌转移,其中CTCs 阳性者24 例(58.54%);37 例未发生前列腺癌转移,其中CTCs 阳性者8 例(21.62%),前者较后者CTCs 阳性率显著升高(χ2=10.954,P=0.001)。见表1。

表1 两组一般资料及CTCs 阳性率比较Tab.1 Comparison of general data and CTCs positive rate between the two groups 例(%)
2.2 血清CTCs、PSA 水平对前列腺癌的诊断价值以病理结果为金标准,利用四格表预测CTCs、PSA 对前列腺癌的诊断价值,结果显示,灵敏度分别为88.46%、85.89%,特异度分别为74.28%、65.71%,准确率分别为84.07%、79.64%,见表2、3。
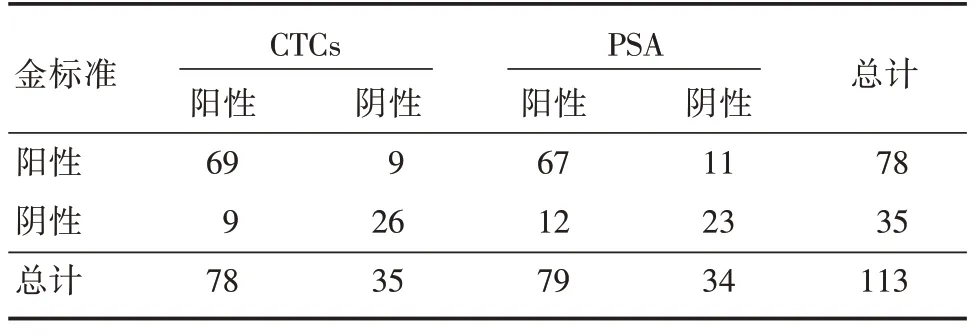
表2 CTCs 和PSA 对前列腺癌的诊断结果Tab.2 CTCs and PSA diagnosis of prostate cancer 例
2.3 前列腺癌患者CTCs 阳性组和阴性组生化指标比较前列腺癌患者CTCs 阳性组HB、ALB 水平明显低于CTCs 阴性组(P<0.05),PLT、FIB、D-D、AKP、LDH 水平明显高于CTCs 阴性组(P<0.05),差异有统计学意义,见表4。
2.4 研究组CTCs与PSA和Gleason评分的相关性分析Pearson 法分析显示,CTCs 与PSA、Gleason评分均呈正相关关系(r=0.601,P<0.05;r=0.316,P<0.05),见图1。

表3 CTCs、PSA 诊断前列腺癌的效果Tab.3 The effects of CTCs and PSA in diagnosis of prostate cancer %
表4 CTCs 阳性组和阴性组生化指标比较Tab.4 Comparison of biochemical indexes between CTCs positive group and negative group ±s

表4 CTCs 阳性组和阴性组生化指标比较Tab.4 Comparison of biochemical indexes between CTCs positive group and negative group ±s
生化指标HB(g/L)PLT(×109/L)FIB(g/L)D-D(μg/L)ALB(g/L)AKP(U/L)LDH(U/L)CTCs 阳性组(n=32)109.14±5.64 210.97±12.52 4.61±0.29 349.57±26.43 34.17±1.02 118.62±14.23 192.46±12.57 CTCs 阴性组(n=46)132.71±6.06 164.73±10.79 3.24±0.26 271.32±22.85 39.49±1.08 82.38±10.27 184.73±10.13 t 值17.377 17.426 21.830 13.947 21.887 13.072 3.001 P 值<0.001<0.001<0.001<0.001<0.001<0.001 0.004
2.5 36 例前列腺癌手术患者CTCs 与病理分期的关系根据前列腺癌根治手术标本的病理分期,将36 例手术患者分为Ⅰ期6 例、Ⅱ期12 例、Ⅲ期14 例和Ⅳ期4 例,各组患者年龄差异无统计学意义(P>0.05);PSA 水平随分期恶化程度加重而增加;CTCs 个数亦随病理分期恶化程度加重而增加,见表5。
表5 36 例手术患者CTCs 与病理分期的关系Tab.5 Relationship between CTCs and pathological stage in 36 surgical patients ±s
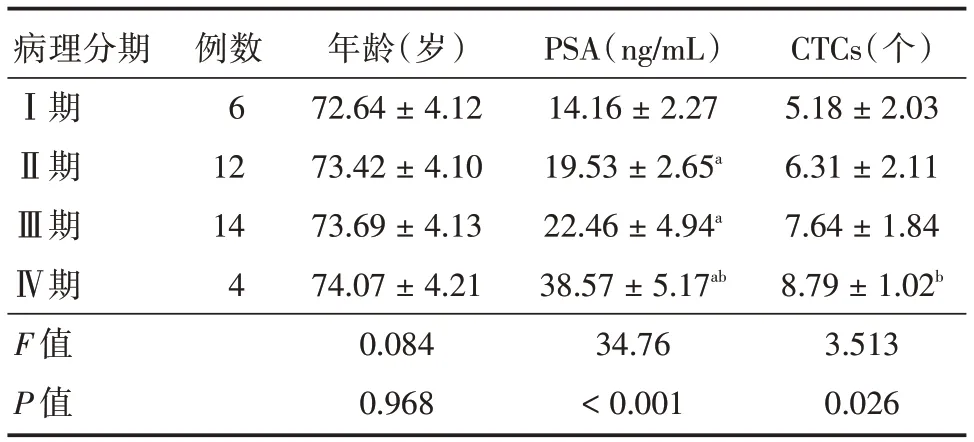
表5 36 例手术患者CTCs 与病理分期的关系Tab.5 Relationship between CTCs and pathological stage in 36 surgical patients ±s
注:与Ⅰ期相比,aP <0.05;与Ⅱ期相比,bP <0.05
病理分期Ⅰ期Ⅱ期Ⅲ期Ⅳ期F 值P 值例数6 12 14 4年龄(岁)72.64±4.12 73.42±4.10 73.69±4.13 74.07±4.21 0.084 0.968 PSA(ng/mL)14.16±2.27 19.53±2.65a 22.46±4.94a 38.57±5.17ab 34.76<0.001 CTCs(个)5.18±2.03 6.31±2.11 7.64±1.84 8.79±1.02b 3.513 0.026
3 讨论
CTCs 是指从肿瘤原发灶或者转移灶经过主动或者被动方式入血并逃过了免疫杀伤而存活下来的肿瘤细胞[8]。作为液体活检中应用较早的一种,CTCs 检测可以及时反映原发肿瘤的发展情况,辅助判断病情的进展,并且具有无创、便捷、可重复检测等优势[9]。

图1 CTCs 与PSA(A)和Gleason 评分(B)的相关性Fig.1 Correlation of CTCs with PSA(A)and Gleason score(B)
前列腺穿刺活检是前列腺癌诊断的金标准,临床上对于是否行前列腺穿刺活检主要是通过PSA 水平来界定的[10],但PSA 是组织特异性而非肿瘤特异性,并且干扰PSA 结果的因素较多,国内有研究[11]显示PSA 在10 ~20 ng/mL 之间的258 例穿刺活检患者,癌检出率仅为33.3%,并且前列腺穿刺活检作为一种侵入性的检查方法,无法监测原发肿瘤的变化。而CTCs 由于和肿瘤原发灶具有相似的基因型和表型,相较于PSA 检测具有更高的特异性,相较于前列腺癌穿刺活检,CTCs 检测更快捷,微创,并且能动态反应病情变化[12-13]。从1869年ASHWORTH[14]首次发现CTCs 至今已有150 余年,但由于检测技术不足,CTCs 在临床中的应用受到限制。近年来,随着现代检测技术的发展,CTCs 在肿瘤的早期诊断、转移监测和疗效观察以及肿瘤个体化治疗等各方面的应用均得以迅猛发展[15-16]。本研究基于CanPatrolTM二代CTC 检测技术检测CTCs,是应用免疫去除结合纳米过滤法的第二代CTCs 富集技术,不需要依靠特异抗体捕获,对肿瘤细胞的回收率超过80%。本研究结果显示,研究组患者CTCs 阳性率显著高于对照组,前列腺癌转移患者CTCs 阳性率显著高于非转移患者。以病理结果为金标准,利用四格表预测CTCs 对前列腺癌的诊断价值,结果显示CTCs、PSA对前列腺癌的诊断灵敏度分别88.46%、85.89%,特异度分别为74.28%、65.71%,准确率分别为84.07%、79.64%,提示血清PSA、CTCs 对前列腺有一定的诊断价值,且CTCs 对前列腺癌的诊断价值优于PSA。恶性肿瘤需依赖宿主生长,在增殖过程中会引起低白蛋白血症以及贫血等症状,造成患者营养不良、病情加重,而肿瘤患者约20%直接死于营养不良[17-18]。有研究[19]表明,ALB 与HB 作为评估营养状况与贫血的主要指标,与肿瘤患者术后并发症以及死亡率有关。本研究显示,前列腺癌CTCs 阳性组HB、ALB 水平明显低于CTCs 阴性组,提示CTCs 阳性组患者营养状况较差,预后不佳。有研究[20]报道,PLT 的升高在恶性肿瘤发展和转移过程中起促进作用,FIB、D-D 的升高与恶性肿瘤疾病严重程度密切相关。本研究中,CTCs 阳性组PLT、FIB、D-D 较CTCs 阴性组明显升高,说明CTCs阳性患者血液处于高凝状态,可促进肿瘤的浸润和转移。因此,通过对CTCs 计数的检测有助于早期发现前列腺癌患者血液的高凝状态,并通过CTCs 计数的变化间接的预测肿瘤的浸润与转移。有学者研究[21]发现,前列腺癌骨转移患者AKP 水平明显升高,而AKP 是预测前列腺癌骨转移的独立预测因素。LDH 是糖酵解的主要酶类,由于恶性肿瘤细胞的能量需求较正常组织细胞显著增多,细胞通透性增加,导致LDH 酶进入血循环,从而引起血清LDH 水平升高[22-23]。本研究结果显示与CTCs 阴性组相比,CTCs 阳性组AKP、LDH 水平明显升高,提示CTCs 阳性组患者肿瘤恶性程度较高,病情较CTCs 阴性组更严重,可能作为辅助判断前列腺癌进展的潜在指标。
PSA 一直以来都是作为前列腺癌诊断以及预后判断的重要指标之一,有研究[24]证实CTCs 水平与PSA水平呈正相关。本研究中,CTCs水平与PSA呈显著正相关,与上述文献报道一致,提示CTCs可以作为前列腺癌的早期诊断以及预后评估的潜在指标。本研究还发现,CTCs 水平与Gleason 评分呈现显著正相关,且CTCs 与病理分期具有明显相关性,与CIELIKOWSKI 等[25]研究结果一致。随着病理分期的增加,CTCs 个数也明显增加,但CTCs能否作为独立预测因素或者与某些预测因子联合用于前列腺癌Gleason 评分以及病理分期评估仍需要临床大样本的试验研究。
CTCs 作为一种无创、便捷、可重复检测的新型诊断指标,对前列腺癌的早期诊断、疗效观察、预后判断具有一定的临床价值。目前关于CTCs 检测在临床实际应用中最大的问题是检测技术的局限性,以及需要更大样本量对实验结果进行验证,以期得到更客观准确的结论,这也是本研究组后续研究的方向。
