马铃薯||玉米间作对土壤细菌多样性的影响*
2020-11-10伏云珍李光文崔慧珍
伏云珍, 马 琨,**,李 倩,李光文, 崔慧珍
马铃薯||玉米间作对土壤细菌多样性的影响*
伏云珍1,2, 马 琨1,2,3**,李 倩3,李光文3, 崔慧珍3
(1. 宁夏大学西北土地退化与生态恢复国家重点实验室培育基地 银川 750021; 2. 宁夏大学西北退化生态系统恢复与重建教育部重点实验室 银川 750021; 3. 宁夏大学农学院 银川 750021)
为探明连续马铃薯、玉米单作及间作种植对土壤细菌群落组成的影响, 利用IonS5TMXL高通量测序平台, 分析了单作玉米(M)、单作马铃薯(P)、马铃薯||玉米间作(PM)下, 土壤细菌群落组成以及多样性间的差异。结果表明: 与单作相比, 马铃薯||玉米间作土壤有机质含量显著升高(<0.05), 但土壤全氮、碱解氮、全磷、速效钾、土壤pH等没有显著变化。所获得的56 787个土壤细菌可操作分类单元(OTUs)共分为46门、55纲、114目、208科、455属。土壤变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)细菌占总相对丰度的57.68%~65.11%, 为优势菌门; 间作对土壤细菌群落多样性(香农指数、辛普森指数)、丰富度(ACE指数和Chao1指数)无显著影响, 但改变了基于门、属水平上的细菌群落组成。与单作马铃薯相比, 间作显著降低了土壤变形菌门(Proteobacteria)相对丰度(=0.023), 提高了浮霉菌门(Planctomycetes)的相对丰度(=0.043)。在属水平上, 相对丰度较低的芽单胞菌属()、属更易受到种植方式的影响; 间作提高了节杆菌属()、芽球菌属()和芽孢杆菌属()的相对丰度。随细菌群落结构变化, 细菌群落功能上出现差异, 通过KEGG功能预测共得到7个一级功能层, 35个二级功能层, 表现出功能上的丰富性, 土壤细菌群落在代谢、遗传信息处理和细胞过程方面功能活跃。7个一级功能层中的代谢功能组在马铃薯||玉米间作与马铃薯单作间有显著差异。利用前向选择, 经蒙特卡罗检验表明, 连续马铃薯、玉米单作及间作栽培5年后的土壤各理化性状指标与土壤细菌群落组成、多样性间的相关性均不显著。连续马铃薯||玉米间作及单作5年条件下土壤细菌群落组成的变化是由马铃薯||玉米间作作物种间互利和竞争关系而驱动的。
马铃薯||玉米间作; 细菌群落; 多样性; 功能预测; 高通量测序; 种间关系
马铃薯(L.)是宁夏南部山区主栽作物, 由于种植面积逐步扩大导致马铃薯轮作倒茬困难, 持续连作导致作物产量不断下降[1-2]。有研究认为, 较高的作物生产率、产量增长率和资源利用效率是以多样性的生物组合为特征的[3]。因此, 改变宁夏南部山区马铃薯重茬种植方式就显得至关重要。目前, 已有许多关于马铃薯||玉米(L.)间作缓解马铃薯连作障碍的报道[4-5]; Wu等[6]研究发现, 马铃薯||玉米间作的产量优势主要源于两者地下根系互利作用。因此, 研究马铃薯、玉米单作及间作种植对土壤微生物群落组成的影响, 对进一步揭示间作栽培调控马铃薯连作障碍的机制和增产效应具有重要意义。
土壤微生物在促进土壤物质循环, 维持土壤生态系统稳定性及可持续性方面发挥着重要的作用; 而土壤细菌作为微生物群落的重要组成成分, 其群落多样性也影响了农业生态系统中作物生长和产量形成[7]。目前, 对于间作系统下土壤细菌多样性及群落结构的变化已有较多报道。如玉米||花生(L.)间作可以改善土壤微生物群落组成和功能多样性, 使两种作物根际土壤微生物群落更加相似, 显著增加了土壤微生物种群和细菌多样性[8]。黄瓜(L.)||西芹(L.)间作丰富了土壤细菌Alpha多样性, 提高了细菌多样性水平[9]。豆类||谷物间作下, 随豆科作物枯落物的添加, 土壤有机质的分解速率增加, 豆科植物通过根际启动效应对细菌产生影响, 从而刺激了参与稳定有机质矿化的土壤细菌群落[10]。然而, Zhou等[11]发现, 尽管玉米||百合(var.Baker)间作下土壤细菌相对丰度在属水平上存在显著差异, 但没有影响根际土壤细菌的多样性。间作增加了以羧酸类、多聚化合物、芳香类和氨基酸类为碳源基质的细菌类群[12]。可见, 土壤细菌群落组成和多样性应该在很大程度上与间作作物的类型、作物地下根系的交互效应以及土壤细菌可利用的碳源类型有关。受作物种类、根际分泌物、间作作物种间作用影响而形成的不同土壤微环境差异, 就是影响土壤细菌群落结构及多样性的重要因素[13-15]。
作物-土壤-微生物的相互关系是当前农田生态系统研究的一个热点问题。土壤微生物群落组成的变化也是引起农作物产生连作障碍的原因之一[16]。随马铃薯连作年限的增加, 有益菌数量减少, 致使马铃薯致病的有害菌丰度增加, 影响了马铃薯产量和品质[4-5,17]。本试验结合IonS5TMXL高通量测序方法, 探究马铃薯、玉米单作及间作种植模式下土壤细菌群落结构组成、多样性及其功能的差异, 分析间作栽培对土壤细菌群落的微生态效应, 旨在为消除马铃薯连作障碍, 稳定宁南山区马铃薯生产力以及马铃薯合理种植制度选择提供理论依据。
1 研究地区概况与研究方法
1.1 试验地概况
试验地位于宁夏固原市隆德县沙塘镇和平村(106°0′37″E, 35°35′11″N), 海拔1 883 m, 年均降水量410 mm, 年均蒸发量1 370 mm, 年均气温6 ℃。供试土壤类型为黑垆土, 成土母质为黄土。试验前土壤全氮1.65 g·kg-1、全磷1.35 g·kg-1、有机质33.28 g·kg-1、碱解氮70.00 mg·kg-1、速效磷49.24 mg·kg-1、速效钾 380.00 mg·kg-1、pH 8.37(水土比5∶1)。
1.2 试验设计
试验开始于2014年4月, 前茬作物为马铃薯。采用单因素随机区组设计, 3个处理, 4次重复, 小区面积4 m×4 m=16 m2, 每小区种植4带。试验处理分别为: 单作玉米(M), 品种为‘长城706’, 采用平覆膜种植,幅宽1.0 m, 宽行行距0.6 m, 窄行行距0.4 m, 株距0.35 m; 单作马铃薯(P), 品种为‘青薯9号’, 平种, 现蕾期起垄, 马铃薯幅宽1.0 m, 行距0.5 m, 株距0.4 m; 马铃薯||玉米间作(PM), 种植方式同单作一致, 马铃薯与玉米的行比为3∶2, 间作下玉米和马铃薯的行距均为0.5 m, 马铃薯玉米间距为0.25 m。马铃薯、玉米均于当年4月中旬同期播种, 10月上旬同期收获。播种前各小区一次性基施磷酸二铵325 kg×hm–2,尿素98.44 kg×hm–2,全生育期不追肥。
1.3 土壤样品采集与处理
连续定位栽培5年后, 2018年10月在马铃薯、玉米收获期利用五点采样法, 采集各小区作物行间0~20 cm土层土壤样本。马铃薯||玉米间作在两种作物行间取土, 每小区采集2个土壤样本, 共采集24个土样, 各样本独立。低温储存带回实验室, 过1 mm筛, 一部分储存在-80℃冰箱用于微生物多样性分析, 另一部分样品用于土壤理化、生物学性状分析。
1.4 研究方法
1.4.1 土壤基本理化性质及生物学特性
土壤全氮、全磷、有机质、碱解氮、速效磷和速效钾分别采用半微量凯氏法、硫酸-高氯酸消煮-钼锑抗比色法、重铬酸钾容量法、碱解扩散法、Olsen法和NH4OAc浸提-火焰光度法测定, pH测定的水土比为5∶1, 土壤呼吸强度、微生物生物量碳分别采用室内密闭培养法、氯仿熏蒸-K2SO4提取法测定[18]。
1.4.2 土壤DNA的提取和PCR扩增
土壤细菌DNA的提取采用 Fast DNA SPIN kit 试剂盒(MP Biomedicals, 美国), 按照说明书的提取步骤进行。微量紫外分光光度计(Nanodrop, ND-1000, 德国)测定土壤总DNA浓度和纯度。采用细菌特异引物(338F/806R)对土壤细菌16S rRNA基因的V3−V4区段进行扩增, 正向引物为338F(5′-ACTCCTACGG GAGGCAGCA-3′), 反向引物为806R(5′-GGACTA CHVGGGTWTCTAAT-3′)。扩增参数: 98 ℃预变性2 min; 98 ℃变性15 s, 55 ℃退火30 s, 72 ℃延伸30 s, 最后72 ℃延伸5 min, 30个循环。扩增体系为25 µL, 5×反应缓冲液5 µL, 5×GC缓冲液5 µL, 2.5 mmol×L-1, dNTP 2 µL, 10 µmol×L-1前引物1 µL, 10 µmol×L-1后引物1 µL, DNA模板2 µL, ddH2O 8.75 µL, Q5 DNA聚合酶0.25 µL。采用IonS5TMXL测序平台对PCR扩增产物进行单端测序, 委托北京诺禾致源生物信息科技有限公司完成。
1.5 数据分析与计算
1.5.1 数据处理
基于IonS5TMXL测序平台进行单端测序, 对下机原始数据(RawData)经过剪切过滤、去除嵌合体[19],进行质量控制[20]后得到用于后续分析的有效数据(CleanData)。利用Uparse软件[21]对各样品的有效数据按97%相似度水平进行操作分类单元(Operational Taxonomic Units, OTUs)聚类分析。根据OTUs划分和分类地位鉴定结果, 使用QIIME软件获得各样本在门、纲、目、科、属、种不同分类水平的组成和丰度分布表。为比较不同样本的多样性, 首先对OTUs丰度矩阵中的全体样本在90%的最低测序深度水平, 统一进行随机重抽样, 从而校正测序深度引起的多样性差异。随后, 使用QIIME软件分别对每个样本进行多样性(Shannon和Simpson)和丰富度(ACE和Chao1)指数的计算。使用R软件对Unweighted的UniFrac距离矩阵进行NMDS分析, 通过二维排序图描述群落样本的结构分布。调用Metastats的统计学算法, 对门和属水平的各分类单元在样本(组)之间的序列量差异进行比较检验[22]。土壤细菌功能的预测是基于KEGG数据库(Kyoto encyclopedia of genes and genomes), 采用PICRUSt软件对基因序列进行功能预测, 根据功能基因丰度进行热图绘制。原始序列数据已上传至NCBI序列读取档案(SRA)中, 编号为PRJNA616158。
1.5.2 土地当量比和种间竞争力的计算[23]
LER=(im/sm)+(ip/sp) (1)
式中: LER为土地当量比,im和ip分别代表间作总面积上玉米和马铃薯的产量(kg×hm–2),sm和sp分别表示单作模式下玉米和马铃薯的产量。当LER>1时, 表现出间作优势, 当LER<1时, 为间作劣势。
mp=im/(sm×m)-ip/(sp×p) (2)
式中:mp表示玉米相对于马铃薯的种间竞争能力,m和p分别为间作下玉米和马铃薯所占面积比例。若mp>0, 表示玉米的种间竞争力强于马铃薯; 反之, 当mp<0则说明马铃薯的竞争能力强于玉米。
1.5.3 数据统计
采用Excel 2010进行数据整理, DPS 7.05软件进行单因素方差分析的Duncan多重比较(0.05), Canoco 5.0软件进行细菌群落结构、多样性与土壤理化性状指标间的冗余(RDA)分析, 蒙特卡罗(999个随机无限排列)检验进行统计显著性分析。
2 结果与分析
2.1 马铃薯||玉米间作作物产量以及土地当量关系
由表1可见, 除2017年间作玉米、2018年间作马铃薯产量外, 连续马铃薯||玉米间作下各年度的间作玉米产量均高于单作玉米、间作马铃薯产量均低于单作马铃薯。马铃薯||玉米间作下的土地当量比整体大于1, 说明马铃薯||玉米间作相对于单作具有产量优势。
2014—2016年, 玉米相对于马铃薯的种间竞争力大于0, 说明间作初期玉米对资源的竞争力强于马铃薯, 其种间竞争力大于其互利作用; 但随栽培时间的延长(2017—2018年), 马铃薯的竞争力强于玉米, 但竞争优势较弱。可见, 随栽培时间的延长, 马铃薯||玉米间作种间关系会发生变化, 作物种间竞争力逐步减弱, 说明马铃薯||玉米间作下种间促进作用逐步增强, 种间互惠的促进作用逐渐占主导地位。
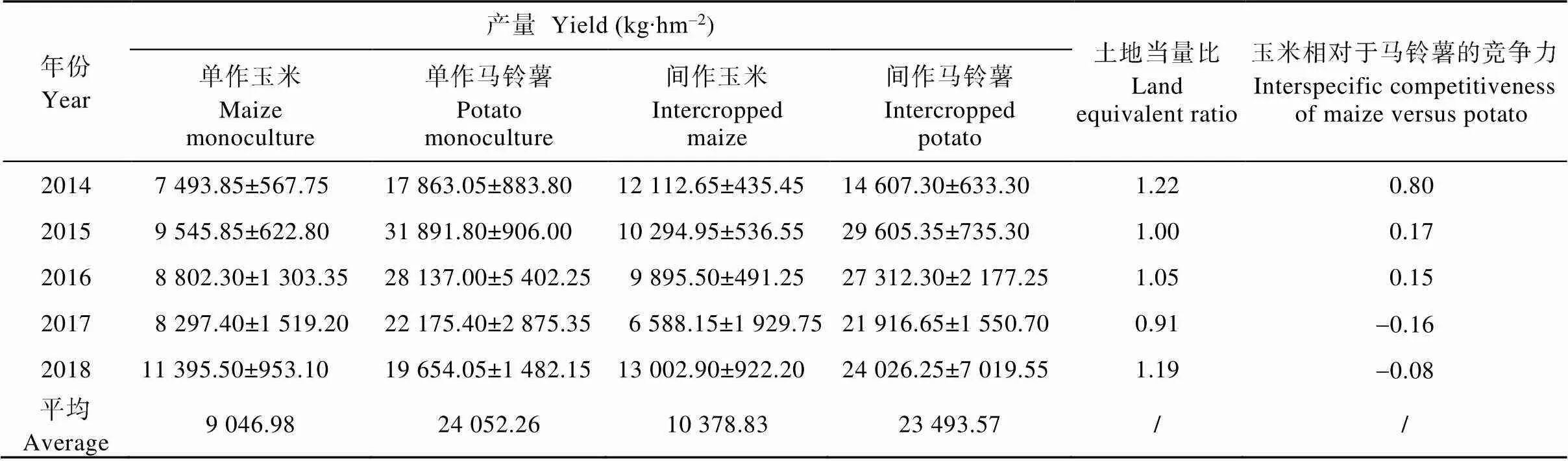
表1 连续马铃薯||玉米间作对作物产量及土地当量比的影响(2014—2018年)
2.2 马铃薯||玉米间作对土壤理化及生物学性状的影响
由表2可见, 连续马铃薯、玉米单作及间作5年后, 土壤主要理化性状指标较试验前均显著下降(<0.05)。马铃薯单作下土壤速效磷含量比单作玉米高18.25%(<0.05), 与马铃薯||玉米间作处理无显著差异。间作土壤有机质含量比单作马铃薯、玉米高4.63%~4.80%(<0.05); 其余土壤理化及生物学性状指标在各处理间均没有显著差异。可见, 连续单作及间作栽培均引起了土壤养分的持续消耗, 但间作栽培有利于减缓土壤有机质的持续耗竭。
2.3 马铃薯||玉米间作对土壤细菌Alpha多样性及群落组成的影响
由表3可见, 马铃薯和玉米在单作和间作条件下的土壤细菌测序覆盖度均大于98%, 说明本试验测序深度已基本覆盖到样品中所有物种, 测序结果能较全面反映土壤细菌群落的种类和结构。尽管各处理下土壤细菌群落丰富度指数由高到低排序为单作马铃薯>马铃薯||玉米间作>单作玉米, 单作马铃薯的Chao1、ACE丰富度指数较马铃薯||玉米间作、单作玉米分别增加了9.01~10.26%、3.43~4.94%, 但各处理间均无显著差异。土壤细菌群落的多样性(Shannon、Simpson)指数、物种数在不同处理间也无显著差异。
高通量测序结果表明, 不同处理共鉴定出56 787个OTUs。单作玉米土壤细菌有45门、53纲、107目、193科、392属, 单作马铃薯土壤细菌有41门、52纲、107目、191科、409属, 马铃薯||玉米间作土壤细菌有45门、53纲、110目、202科、420属。马铃薯、玉米单作及间作下的土壤细菌共有45个门组成, 相对丰度大于1%的变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、奇古菌门(Thaumarchaeota)、硝化螺旋菌门(Nitrospirae)、疣微菌门(Verrucomicrobia)、厚壁菌门(Firmicutes)占总丰度的93.91%~94.42%, 门水平上将相对丰度小于1%的细菌归类为Others(图1a)。不同处理下, 土壤变形菌门、酸杆菌门、放线菌门细菌是单作及间作下的优势菌门。变形菌门的相对丰度最高, 为27.79%~32.42%; 酸杆菌门的相对丰度次之, 为18.97%~20.39%; 放线菌门的相对丰度最低, 为10.92%~12.13%。这3个优势菌门占土壤细菌群落总相对丰度的61.06%。

表2 马铃薯和玉米单作及间作5年后土壤基础理化及生物学性状
表中数据为平均值±标准差, 同行不同小写字母表示差异显著(<0.05)。Data are means ± standard deviation. Different lowercase letters in the same row mean significant differences (<0.05).

表3 马铃薯、玉米单作及间作栽培对土壤细菌群落Alpha多样性的影响
表中数据为平均值±标准差, 同行不同小写字母表示差异显著(<0.05)。Data are means ± standard deviation. Different lowercase letters in the same row mean significant differences (<0.05).
变形菌门相对丰度在马铃薯单作中最高, 单作玉米、马铃薯||玉米间作下其相对丰度较单作马铃薯分别降低9.62%和14.56%。Metastats检验表明, 单作马铃薯和马铃薯||玉米间作之间的土壤变形菌门、浮霉菌门(Planctomycetes)细菌的相对丰度有显著差异(=0.023、=0.043), 间作显著降低了变形菌门的相对丰度, 提高了浮霉菌门的相对丰度。相对丰度较高的其他前10个门细菌在两者间无显著差异。
相对丰度较高的前20属细菌中, 各细菌类群的平均相对丰度均小于5.0%, 将未能在97%相似度上分类的归类为Unidentified。由图1b可见, 鞘氨醇单胞菌属()、寡养单胞菌属()、未鉴定的酸杆菌门属(UnidentifiedAcidobacteria)是优势菌属。单作玉米、单作马铃薯及马铃薯||玉米间作下鞘氨醇单胞菌属的相对丰度分别为2.95%、3.60%、2.67%, 寡养单胞菌属的相对丰度为1.91%、4.46%、2.97%, 未鉴定的酸杆菌门属相对丰度为3.53%、3.51%、3.43%; 与单作马铃薯相比, 单作玉米、马铃薯||玉米间作下的鞘氨醇单胞菌属和寡养单胞菌属的相对丰度分别降低18.06%、25.83%和57.17%、33.41%。Metastats检验表明, 优势菌属中的寡养单胞菌属相对丰度在单作玉米和单作马铃薯间有极显著差异(=0.004)。相对丰度较低的芽单胞菌属()和属在单作玉米和马铃薯玉米间作(=0.006、=0.030)、单作马铃薯和马铃薯||玉米间作(=0.001、=0.037)之间的相对丰度达显著或极显著差异; 较单作而言, 芽单胞菌属和属的丰度在间作下均显著提高。前20属中相对丰度较低的、假节杆菌属(r)、节杆菌属()、红色杆菌属()、芽球菌属()、芽孢杆菌属()、属的相对丰度均表现为单作玉米、马铃薯||玉米间作高于单作马铃薯, 但三者间均无显著差异。

图1 马铃薯||玉米间作对土壤细菌相对丰度的影响(a:门水平; b: 属水平)
M: 单作玉米; P: 单作马铃薯; PM: 马铃薯||玉米间作。M: maize monoculture; P: potato monoculture; PM: potato||maize intercropping.
然而, 除相对丰度较高的前20属外, 在单作马铃薯与马铃薯||玉米间作下, 相对丰度更低的、鞘脂菌属()等8属土壤细菌间存在显著(<0.05)或极显著差异(<0.01); 单作玉米与马铃薯||玉米间作下, 有6属细菌相对丰度间存在显著差异; 单作玉米、单作马铃薯间有鞘脂菌属、地杆菌属()等17属细菌相对丰度存在显著或极显著差异。可见, 马铃薯、玉米单作及间作模式的差别, 引起了对应土壤细菌群落结构组成在门、属水平上的变化, 相对丰度较低或极低的土壤细菌类群更容易受到栽培方式的影响, 对栽培方式的变化更敏感。
2.4 马铃薯||玉米间作对土壤细菌Beta多样性及功能的影响
马铃薯、玉米单作及间作下的24个土壤样本NMDS分析展示, 不同处理土壤样本主要聚集在图的左侧(图2)。尽管不同处理内各自样本的组内差异略大, 但单作马铃薯与单作玉米、单作马铃薯与马铃薯||玉米间作下各处理在空间位置上有明显分离, 说明单作马铃薯与单作玉米、马铃薯单作与马铃薯||玉米间作下土壤基于门水平上细菌群落组成有差别。相似性分析(ANOSIM)表明, 基于门水平的两个单作种植方式间土壤细菌群落组成有极显著性差异(Stress=0.145,=0.006)。玉米单作和马铃薯||玉米间作下土壤样本的空间距离较近, 两者间的土壤细菌群落组成相似性较单作马铃薯处理更接近。
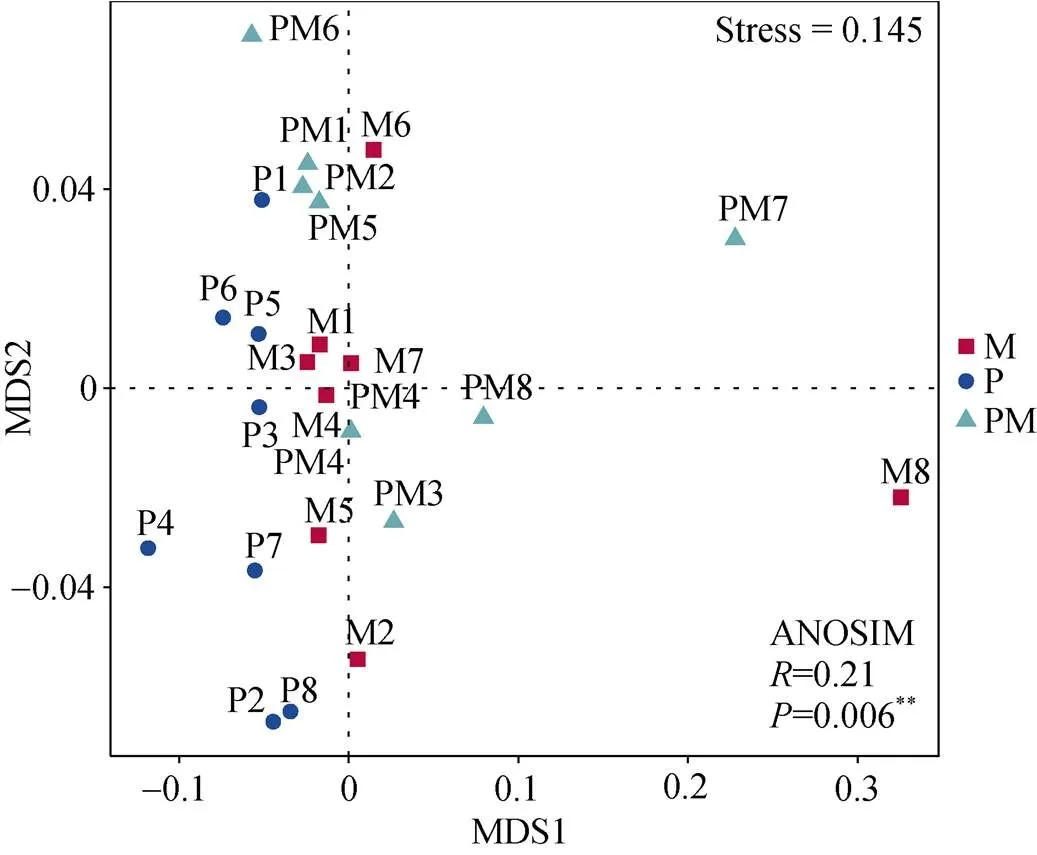
图2 基于门水平的马铃薯、玉米单作及间作下土壤细菌群落结构的NMDS分析
M: 单作玉米; P: 单作马铃薯; PM: 马铃薯||玉米间作。M: maize monoculture; P: potato monoculture; PM: potato||maize intercropping.
利用KEGG代谢途径预测差异分析发现(图3a), 马铃薯、玉米单作及间作下土壤细菌群落的一级功能层中主要包含7类生物代谢功能, 其中代谢(metabolism)、遗传信息处理(genetic information processing)和细胞过程(cellular processes)为其主要组成, 占比分别为45.38%~45.59%、22.60%~22.62%和19.61%~19.84%; 有机系统(organismal system)所占比例最小, 仅为1.12%~1.13%。土壤微生物群落一级功能层在代谢途径上的差异分析表明, 单作玉米与马铃薯||玉米间作下土壤细菌群落的生物代谢功能组中有机系统间存在显著差异(=0.046), 单作马铃薯及马铃薯||玉米间作下生物代谢功能组中代谢存在显著差异(=0.046)。二级功能层分析发现(图3b), 共有35个子功能组; 碳水化合物代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)、膜运输(membrane transport)、翻译(translation)、复制和修复(replication and repair)子功能组所占比例分别为10.39%~10.42%、10.10%~10.20%、8.86%~9.06%、8.85%~8.86%和7.59%~7.65%, 在所有子功能组中所占比例较高。除有机系统(organismal systems)下的二级功能层老化(aging)和有机系统(organismal systems)下的免疫系统(immune system)在单作马铃薯、马铃薯||玉米间作栽培下有显著差异外(=0.049、=0.012), 其他子功能组间均无差异。

图3 马铃薯||玉米间作下预测的细菌功能分组一级(a)、二级(b)功能层热图
M: 单作玉米; P: 单作马铃薯; PM: 马铃薯||玉米间作。M: maize monoculture; P: potato monoculture; PM: potato||maize intercropping.
2.5 马铃薯||玉米间作下土壤细菌群落组成、多样性与土壤理化生物学性状间的冗余分析
为揭示土壤细菌群落与土壤理化生物学性状指标间的相互关系, 利用RDA分析结果可知, 第一、二排序轴仅分别能够在累积变量26.68%(图4a)、41.43%(图4b)上揭示不同种植方式下土壤基本理化、生物学性状指标对土壤细菌门水平分类学组成及其多样性差异的影响。利用前向选择, 经蒙特卡罗检验表明, 连续马铃薯、玉米单作及间作栽培5年后的土壤各理化、生物学性状指标与土壤细菌群落组成、多样性间的相关性均不显著。可见, 本试验条件下, 土壤主要理化、生物学指标间的差异并不是驱动土壤细菌群落变化的主要因素。
3 讨论
3.1 马铃薯||玉米间作对土壤细菌群落多样性的影响
通常认为, 植物多样性的增加会促进土壤微生物多样性的提升[24]。但本研究中, 马铃薯、玉米单作及间作没有影响土壤细菌群落多样性、丰富度; 土壤理化及生物学性状指标与土壤细菌群落多样性及组成间也无显著关系。这与相关研究认为间作能提高细菌群落多样性的结果不一致[4-5,8]。相关研究认为, 间作对土壤细菌群落多样性的影响与种植方式转变引起土壤养分有效性的变化有关[25]。如, 玉米||大豆(L.)间作地下互作增加了作物对氮、磷养分的吸收, 土壤pH、速效磷、有机质、全氮、酶活性的变化是影响细菌群落结构和提高多样性的重要因素[26]。桑树(L.)||紫花苜蓿(L.)间作显著提高了苜蓿根际有效氮、磷、钾、全碳含量, 改变了土壤变形菌门、拟杆菌门、放线菌门及芽单胞菌门的相对丰度, 提高了土壤细菌丰富度和多样性; 土壤环境因子对细菌群落变异的贡献率高达56.5%, 种植方式仅为26.7%[15]。但Zhang等[27]在玉米||蚕豆(L.)间作根际土壤细菌多样性的研究中发现, 间作明显改变了细菌群落组成, 但不会对多样性产生影响。本研究中, 不同种植方式间土壤环境因子并没有显著差异。因此, 微生物与环境的相互适应过程中, 相对稳定的土壤环境因子有利于保持细菌群落多样性、丰富度的稳定; 而种植方式变化所导致的作物地下种间互利与竞争关系的变化应该是驱动土壤细菌群落组成发生改变的主要原因。可见, 间作种植对土壤细菌多样性及其组成的影响受作物种类、土壤环境因子以及作物间的相互作用等因素共同制约。

图4 马铃薯||玉米间作下基于门水平上土壤细菌的相对丰度(a)和多样性及丰富度(b)与土壤环境因子间的RDA分析
M: 单作玉米; P: 单作马铃薯; PM: 马铃薯||玉米间作。OM: 有机质; TP: 全磷; AP: 速效磷; TN: 全氮; AN: 碱解氮; AK: 速效钾; RI: 呼吸强度; SMBC: 微生物生物量碳; C/N: 碳氮比; Pro: 变形菌门; Aci: 酸杆菌门; Act: 放线菌门; Bac: 拟杆菌门; Gem: 芽单胞菌门; Chl: 绿弯菌门; Tha: 奇古菌门; Nit: 硝化螺旋菌门; Ver: 疣微菌门; Fir: 厚壁菌门。M: maize monoculture; P: potato monoculture; PM: potato||maize intercropping. OM: organic matter; TP: total phosphorus; AP: available phosphorus; TN: total nitrogen; AN: available nitrogen; AK: available potassium; RI: respiration intensity; SMBC: soil microbial biomass carbon; C/N: carbon to nitrogen ratio; Pro: Proteobacteria; Aci: Acidobacteria; Act: Actinobacteria; Bac: Bacteroidetes; Gem: Gemmatimonadetes; Chl: Chloroflexi; Tha: Thaumarchaeota; Nit: Nitrospirae; Ver: Verrucomicrobia; Fir: Firmicutes.
3.2 马铃薯||玉米间作对土壤细菌群落组成、功能的影响
土壤细菌是土壤变化的敏感指标[28]。土壤细菌优势菌群与作物种类、土壤养分条件密切相关[15]。本研究中, 基于门、属水平的细菌分类结果表明, 土壤变形菌门、酸杆菌门和放线菌门是优势菌门, 这与黄瓜间作西芹土壤细菌优势菌门的结果基本一致[9]。本研究中, 较单作马铃薯处理, 马铃薯||玉米间作下土壤放线菌门和酸杆菌门丰度增加。分析认为, 由于酸杆菌门细菌能降解土壤中的植物凋落物、放线菌门细菌在分解纤维素和几丁质等方面起关键作用[29]。因此, 本试验条件下马铃薯||玉米间作中较高的土壤有机质和植物枯落物就能为放线菌门、酸杆菌门细菌提供丰富的土壤碳源, 有利于该类群微生物的繁殖, 进而提高其丰度, 这同Tkacz等[30]发现在有机质含量丰富的土壤中有更多放线菌门细菌的研究结果一致。此外, 间作地下根系交互作用保证了各作物之间土壤养分、根际分泌物和可溶性物质等的交换[31]。试验中, 持续马铃薯||玉米间作, 作物种间竞争作用减弱、互惠逐步增强, 可能意味着作物地下根际间物质的频繁交换, 受根际分泌物及碳源类型等的变化而导致土壤细菌群落组成发生改变。
在属分类水平上, 隶属于变形菌门的鞘氨醇单胞菌属、寡养单胞菌属是优势属; 而Metastats检验表明, 马铃薯||玉米间作仅显著提高了非优势属属和芽单胞菌属的丰度, 优势属的相对丰度无明显差异。由于属和芽单胞菌属分别隶属于酸杆菌门和芽单胞菌门, 具有固氮、分解有机质功能, 且多存在于有机质含量较高的土壤中[32-33], 这与试验中马铃薯||玉米间作条件下具有较高的土壤有机质是对应的。此外, 试验中相对丰度较低的节杆菌属、芽孢杆菌属等有益菌也表现为马铃薯||玉米间作高于单作马铃薯, 这与李倩[23]利用T-RFLP技术对马铃薯||玉米间作栽培下土壤细菌群落分析结果一致。这说明受马铃薯||玉米间作作物种间关系影响, 土壤中相对丰度较低的细菌菌属比优势菌属对种间关系导致的土壤环境因子的微小变化更敏感, 也更容易发生改变。虽然鞘氨醇单胞菌属、寡养单胞菌属细菌受间作影响相对丰度也出现了波动, 但因其丰度较高, 微小变化并不会打破其在群落结构组成中的优势地位而破坏平衡状态。有研究指出, 玉米||马铃薯间作两者根系互作会改变根际土壤氨基酸、糖类和有机酸等碳源组成, 使土壤细菌对某些碳源的利用能力产生抑制作用[34]。可见, 在间作模式下, 间作作物通过种间关系的互利与竞争, 逐渐改变土壤细菌碳源基质, 引起土壤环境因子的微小变化, 而导致细菌类群发生改变, 具体原因还需要通过探究马铃薯||玉米间作后根系分泌物的成分及土壤细菌对碳源的利用方式来揭示。
试验中, 属水平上相对丰度极低的细菌类群是各种植方式下差异显著性较明显的物种; 而门水平上相对丰度较高的细菌类群有显著性差异的物种类群较少。这说明土壤细菌群落组成中低丰度物种对马铃薯||玉米间作地下种间相互关系较敏感; 相对丰度较高的物种对二者间作地下种间关系变化的适应性较强, 能够维持较好的群落稳定性。马铃薯||玉米间作作物地下种间相互作用对土壤细菌群落的影响应该是一个选择性的适应过程。有研究发现, 土壤细菌群落结构变化与种植年限有关, 随种植年限的增加, 土壤细菌结构会恢复到最初未种植之前的状态[35]。由于本试验只进行了5年, 连续种植年限较短, 马铃薯||玉米间作与单作种植对土壤细菌群落多样性、组成的影响差异, 并没有因细菌群落结构组成的微小变化而打破其初始群落的平衡状态; 随时间的延长及其共生关系的稳定建立, 细菌群落间的差异才可能完全表现出来。
微生物群落结构的变化能引起其功能改变[36]。本试验中, 利用KEGG代谢途径对不同栽培下土壤细菌功能进行预测, 在一级功能层中, 代谢、遗传信息处理和细胞过程3类生物代谢功能所占比例较高, 一级功能层的有机系统、代谢功能在单作与间作之间存在差异性, 这与林耀奔等[37]对土壤细菌功能的预测结果相似。分析认为, 由于功能基因中代谢功能的主要作用是通过分解氨基酸、碳水化合物等获取营养物质来保证细菌的存活, 当马铃薯||玉米间作栽培后, 两者根系交互在一起, 随植物枯落物和根际沉积物中的复杂化合物增加, 土壤细菌需要复杂的酶系来降解这些大分子, 相应促使细菌代谢功能得以加强, 从而导致细菌群落功能出现差异。
4 结论
相对马铃薯、玉米单作而言, 马铃薯||玉米间作种植提高了土地当量比, 存在明显的产量优势, 随栽培时间的延长, 作物种间互惠作用逐渐占主导地位。马铃薯||玉米间作种植改变了土壤细菌群落组成, 但未对土壤中细菌群落多样性和丰富度产生显著影响。土壤中相对丰度较低的芽单胞菌属、属对种植方式的改变较为敏感; 间作提高了节杆菌属、芽球菌属和芽孢杆菌属等有益菌的相对丰度。土壤细菌主要涉及代谢、遗传信息处理和细胞过程等7个一级功能层, 碳水化合物代谢、氨基酸代谢、膜运输、翻译、复制和修复等35个二级功能层, 表现出功能上的丰富性。马铃薯||玉米间作下作物种间相互作用的变化是驱动土壤细菌群落组成发生变化的主要原因。本研究结果对消除宁南山区马铃薯连作障碍具有一定的理论指导意义。
[1] 沈宝云, 刘星, 王蒂, 等. 甘肃省中部沿黄灌区连作对马铃薯植株生理生态特性的影响[J]. 中国生态农业学报, 2013, 21(6): 689–699 SHEN B Y, LIU X, WANG D, et al. Effects of continuous cropping on potato eco-physiological characteristics in the Yellow River irrigation area of the central Gansu Province[J]. Chinese Journal of Eco-Agriculture, 2013, 21(6): 689–699
[2] 刘星, 张书乐, 刘国锋, 等. 连作对甘肃中部沿黄灌区马铃薯干物质积累和分配的影响[J]. 作物学报, 2014, 40(7): 1274–1285 LIU X, ZHANG S L, LIU G F, et al. Effects of continuous cropping on dry matter accumulation and distribution of potato plants in the Yellow River irrigation areas of Middle Gansu Province[J]. Acta Agronomica Sinica, 2014, 40(7): 1274–1285
[3] BRACKEN M E S. Monocultures versus polycultures[M]// JORGENSEN S E. Encyclopedia of Ecology. Amsterdam: Elsevier Press, 2008: 2446–2449
[4] 王娜, 陆姗姗, 马琨, 等. 宁夏南部山区马铃薯不同间作模式对根际土壤细菌多样性的影响[J]. 干旱区资源与环境, 2016, 30(12): 193–198 WANG N, LU S S, MA K, et al. The genetic diversity of rhizosphere soil bacteria under different intercropping patterns for potato in southern mountainous area of Ningxia[J]. Journal of Arid Land Resources and Environment, 2016, 30(12): 193–198
[5] 汪春明, 马琨, 代晓华, 等. 间作栽培对连作马铃薯根际土壤微生物区系的影响[J]. 生态与农村环境学报, 2013, 29(6): 711–716 WANG C M, MA K, DAI X H, et al. Effect of intercropping on soil microflora in rhizosphere soil of potato under continuous cropping[J]. Journal of Ecology and Rural Environment, 2013, 29(6): 711–716
[6] WU K X, FULLEN M A, AN T X, et al. Above- and below-ground interspecific interaction in intercropped maize and potato: A field study using the ‘target’ technique[J]. Field Crops Research2012, 139: 63–70
[7] YANG Y, DOU Y X, AN S S. Testing association between soil bacterial diversity and soil carbon storage on the Loess Plateau[J]. Science of the Total Environment, 2018, 626: 48–58
[8] LI Q S, WU L K, CHEN J, et al. Biochemical and microbial properties of rhizospheres under maize/peanut intercropping[J]. Journal of Integrative Agriculture, 2016, 15(1): 101–110
[9] 秦立金, 徐峰, 刘永胜, 等. 黄瓜与西芹间作土壤细菌多样性及其对黄瓜枯萎病发生的影响[J]. 中国生态农业学报, 2018, 26(8): 1180–1189 QIN L J, XU F, LIU Y S, et al. Analysis of soil bacterial diversity under cucumber-celery intercropping and its influence on cucumberwilt[J]. Chinese Journal of Eco-Agriculture, 2018, 26(8): 1180–1189
[10] DUCHENE O, VIAN J F, CELETTE F. Intercropping with legume for agroecological cropping systems: Complementarity and facilitation processes and the importance of soil microorganisms. A review[J]. Agriculture, Ecosystems & Environment, 2017, 240: 148–161
[11] ZHOU L J, WANG Y J, XIE Z K, et al. Effects of lily/maize intercropping on rhizosphere microbial community and yield ofvar.[J]. Journal of Basic Microbiology, 2018, 58(10): 892–901
[12] 马琨, 杨桂丽, 马玲, 等. 间作栽培对连作马铃薯根际土壤微生物群落的影响[J]. 生态学报, 2016, 36(10): 2987–2995MA K, YANG G L, MA L, et al. Effects of intercropping on soil microbial communities after long-term potato monoculture[J]. Acta Ecologica Sinica, 2016, 36(10): 2987–2995
[13] MARSCHNER P, YANG C H, LIEBEREI R, et al. Soil and plant specific effects on bacterial community composition in the rhizosphere[J]. Soil Biology and Biochemistry, 2001, 33(11): 1437–1445
[14] BAUDOIN E, BENIZRI E, GUCKERT A. Impact of artificial root exudates on the bacterial community structure in bulk soil and maize rhizosphere[J]. Soil Biology and Biochemistry, 2003, 35(9): 1183–1192
[15] ZHANG M M, WANG N, HU Y B, et al. Changes in soil physicochemical properties and soil bacterial community in mulberry (L.)/alfalfa (L.) intercropping system[J]. Microbiologyopen, 2018, 7(2): e00555
[16] LIU W X, WANG Q L, WANG B Z, et al. Changes in the abundance and structure of bacterial communities under long-term fertilization treatments in a peanut monocropping system[J]. Plant and Soil, 2015, 395(1): 415–427
[17] ATKINSON D, THORNTON M K, MILLER J S. Development ofon stems, stolons and tubers of potatoes I. effect of inoculum source[J]. American Journal of Potato Research, 2010, 87(4): 374–381
[18] 鲍士旦. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社, 2000: 1–329 BAO S D. Soil and Agricultural Chemistry Analysis[M]. 3rd edition. Beijing: China Agriculture Press, 2000: 1–329
[19] MAGOČ T, SALZBERG S L. FLASH: Fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957–2963
[20] HASS B J, GEVERS D, EARL A M, et al. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J]. Genome Research, 2011, 21(3): 494–504
[21] EDGAR R C. UPARSE: Highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996–998
[22] WHITE J R, NAGARAJAN N, POP M. Statistical methods for detecting differentially abundant features in clinical metagenomic samples[J]. PLoS Computational Biology, 2009, 5(4): e1000352
[23] 李倩. 马铃薯玉米间作的种间作用效应研究[D]. 银川: 宁夏大学, 2019 LI Q. Study on the interspecific effect of potato intercropping with maize[D]. Yinchuan: Ningxia University, 2019
[24] SPEHN E M, JOSHI J, SCHMID B, et al. Plant diversity effects on soil heterotrophic activity in experimental grassland ecosystems[J]. Plant and Soil, 2000, 224(2): 217–230
[25] 付学鹏, 吴凤芝, 吴瑕, 等. 间套作改善作物矿质营养的机理研究进展[J]. 植物营养与肥料学报, 2016, 22(2): 525–535 FU X P, WU F Z, WU X, et al. Advances in the mechanism of improving crop mineral nutrients in intercropping and relay intercropping systems[J]. Plant Nutrition and Fertilizer Science, 2016, 22(2): 525–535
[26] FU Z D, ZHOU L, CHEN P, et al. Effects of maize-soybean relay intercropping on crop nutrient uptake and soil bacterial community[J]. Journal of Integrative Agriculture, 2019, 18(9): 2006–2018
[27] ZHANG N N, SUN Y M, LI L, et al. Effects of intercropping and Rhizobium inoculation on yield and rhizosphere bacterial community of faba bean (L.)[J]. Biology and Fertility of Soils, 2010, 46(6): 625–639
[28] 雍太文, 杨文钰, 向达兵, 等. 小麦/玉米/大豆和小麦/玉米/甘薯套作对根际土壤细菌群落多样性及植株氮素吸收的影响[J]. 作物学报, 2012, 38(2): 333–343YONG T W, YANG W Y, XIANG D B, et al. Effect of wheat/maize/soybean and wheat/maize/sweet potato relay strip intercropping on bacterial community diversity of rhizosphere soil and nitrogen uptake of crops[J]. Acta Agronomica Sinica, 2012, 38(2): 333–343
[29] LI X, SUN M L, ZHANG H H, et al. Use of mulberry-soybean intercropping in salt-alkali soil impacts the diversity of the soil bacterial community[J]. Microbial Biotechnology, 2016, 9(3): 293–304
[30] TKACZ A, CHEEMA J, CHANDRA G, et al. Stability and succession of the rhizosphere microbiota depends upon plant type and soil composition[J]. The ISME Journal, 2015, 9(11): 2349–2359
[31] LI Q S, CHEN J, WU L K, et al. Belowground Interactions impact the soil bacterial community, soil fertility, and crop yield in maize/peanut intercropping systems[J]. International Journal of Molecular Sciences, 2018, 19(2): 622–634
[32] 丁传雨, 郑远, 任学敏, 等. 能源植物修复土壤镉污染过程中细菌群落分析[J]. 环境科学学报, 2016, 36(8): 3009–3016 DING C Y, ZHENG Y, REN X M, et al. Changes in bacterial community composition during the remediation of Cd-contaminated soils of bioenergy crops[J]. Acta Scientiae Circumstantiae, 2016, 36(8): 3009–3016
[33] 杜思瑶, 于淼, 刘芳华, 等. 设施种植模式对土壤细菌多样性及群落结构的影响[J]. 中国生态农业学报, 2017, 25(11): 1615–1625 DU S Y, YU M, LIU F H, et al. Effect of facility management regimes on soil bacterial diversity and community structure[J]. Chinese Journal of Eco-Agriculture, 2017, 25(11): 1615–1625
[34] 覃潇敏, 郑毅, 汤利, 等. 玉米与马铃薯间作对根际微生物群落结构和多样性的影响[J]. 作物学报, 2015, 41(6): 919–928QIN X M, ZHENG Y, TANG L, et al. Effects of maize and potato intercropping on rhizosphere microbial community structure and diversity[J]. Acta Agronomica Sinica, 2015, 41(6): 919–928
[35] 赵天心, 毛新伟, 程敏, 等. 毛竹种植对土壤细菌和真菌群落结构及多样性的影响[J]. 应用生态学报, 2017, 28(11): 3740–3750 ZHAO T X, MAO X W, CHENG M, et al. Effects of phyllostachys edulis cultivation on soil bacterial and fungal community structure and diversity[J]. Chinese Journal of Applied Ecology, 2017, 28(11): 3740–3750
[36] PRESTON-MAFHAM J, BODDY L, RANDERSON P F. Analysis of microbial community functional diversity using sole-carbon-source utilisation profiles — a critique[J]. FEMS Microbiology Ecology, 2002, 42(1): 1–14
[37] 林耀奔, 叶艳妹, 刘书畅, 等. 不同农地整治措施对土壤细菌多样性的影响[J]. 长江流域资源与环境, 2019, 28(11): 2632–2640 LIN Y B, YE Y M, LIU S C, et al. Analysis of soil microbial diversity affected by different agricultural land consolidation practices[J]. Resources and Environment in the Yangtze Basin, 2019, 28(11): 2632–2640
Effects of potato intercropped with maize on soil bacterial diversity*
FU Yunzhen1,2, MA Kun1,2,3**, LI Qian3, LI Guangwen3, CUI Huizhen3
(1. National Key Laboratory Breeding Base of Northwest Land Degradation and Ecological Restoration, Ningxia University, Yinchuan 750021, China; 2. Key Laboratory for Restoration and Reconstruction of Degraded Ecosystem in Northwestern China of Ministry of Education, Ningxia University, Yinchuan 750021, China; 3. College of Agriculture, Ningxia University, Yinchuan 750021, China)
One of the reasons for the replanting problem in continuous potato cropping is the change in the soil microbial community structure. Many studies have shown that reasonable intercropping can alleviate replant disease, and the relationships of crop-soil-microorganisms are a hot topic in current agricultural ecosystem research. Therefore, the objective of this study was to examine the difference in the soil bacterial community composition after continuous potato and maize monoculture and intercropping. The IonS5TMXL high-throughput sequencing platform was used to analyze the soil bacterial community composition and diversity under maize monoculture (M), potato monoculture (P), and potato intercropped with maize (PM). The results revealed that soil organic matter significantly increased in the treatment of potato intercropped with maize (<0.05), when compared with the monocultures. However, there were no significant changes in the soiltotalnitrogen, available nitrogen, total phosphorus, available potassium, and pH among different treatments. Moreover, the total 56 787 Operational Taxonomic Units (OTUs) of bacteria were classified as 46 phyla, 55 classes, 114 orders, 208 families, and 455 genera. Proteobacteria, Acidobacteria, and Actinobacteria were the dominant phyla and accounted for 57.68%–65.11% of the total relative abundance of bacteria. The diversity index (Shannon-Wiener and Simpson) and the richness index (ACE and Chao1) of soil bacterial communities did not change; however, the relative abundance of the soil bacterial communities changed at the phylum and genus levels. Compared to the potato monoculture, the relative abundance of Proteobacteria decreased significantly after potato was intercropped with maize (=0.023), while the relative abundance of Planctomycetes increased (=0.043). Furthermore,and, with lower relative abundance, were found to be more easily influenced by the planting patterns. Moreover, intercropping increased the relative abundance of,, and. With the change in the bacterial community, the soil bacterial functions were separately classified into 7 and 35 functional categories at hierarchy level 1 and 2, respectively, using the KEGG function prediction, which implied abundant soil bacteria functions. From this, we garnered that soil bacteria were active in metabolic processes, genetic information processing, and cellular processes. Furthermore, the metabolic functional groups in the 7 primary functional layers had significant differences between potato intercropped with maize and potato monoculture (=0.046). Additionally, forward selection of the soil environmental factors was used, and the result of the Monte Carlo test showed that there was no significant correlation between soil physicochemical and biological properties and the soil bacterial community composition and diversity after the five-year experiment. In conclusion, the relationship between the interspecific mutualism and competition in potato intercropped with maize was the driving factor of the change in the soil bacterial community.
Potato intercropped with maize; Bacterial community; Diversity; Function prediction; High-throughput sequencing; Interspecific relationship
, E-mail: makun0411@nxu.edu.cn
Mar. 31, 2020;
S154.37
马琨, 主要从事农田生态学和土壤微生物生态学研究。E-mail: makun0411@nxu.edu.cn
伏云珍, 主要从事农业生态学研究。E-mail: 2398525469@qq.com
2020-03-31
2020-06-03
* This study was supported by the National Natural Science Foundation of China (31660132), and the Key Research and DevelopmentPlan of Ningxia Hui Autonomous Region (2018BBF03002, 2019BBF03011).
* 国家自然科学基金项目(31660132)和宁夏回族自治区重点研发计划项目(2018BBF03002, 2019BBF03011)资助
10.13930/j.cnki.cjea.200240
伏云珍, 马琨, 李倩, 李光文, 崔慧珍. 马铃薯||玉米间作对土壤细菌多样性的影响[J]. 中国生态农业学报(中英文), 2020, 28(11): 1715-1725
FU Y Z, MA K, LI Q, LI G W, CUI H Z. Effects of potato intercropped with maize on soil bacterial diversity[J]. Chinese Journal of Eco-Agriculture, 2020, 28(11): 1715-1725
Jun. 3, 2020
