基于“甾酮类化学成分-抗氧化生物活性”关联分析评价牛膝药材商品等级
2020-11-10常爱冰刘妍如唐志书宋忠兴史鑫波陈彦斌
常爱冰,刘妍如*,王 梅,唐志书,宋忠兴,史鑫波,刘 峰,陈彦斌
1陕西中医药大学 陕西省中药资源产业化协同中心 省部共建协同秦药特色资源研究与开发重点实验室(培育)陕西省创新药物研究中心;2陕西中医药大学附属医院,咸阳 712083; 3陕西步长制药有限公司,西安 710075
牛膝来源于苋科植物牛膝(怀牛膝)AchyranthesbidentataBl.的干燥根。具有补肝肾、强筋骨和活血祛瘀等功效[1],临床上常用于血滞经闭、胞衣不下和跌打损伤等症。现代药理研究表明牛膝具有增强免疫、抗氧化和抗炎镇痛等功能,其机理为抑制自由基的产生[2-7]。
作为中医临床常用药物之一,其质量优劣直接关系到临床用药的安全性[8]。目前牛膝药材的质量控制主要参考2015版药典对于蜕皮甾酮含量的规定。中药有别于化学药和生物制品,单一的感官评价、化学评价或生物评价均无法全面反映中药的整体质量和临床功效[9],多元化的交叉综合评价模式将会成为中药质量评价的趋势[10]。因此本研究以抗氧化活性作为生物活性指标,同时结合牛膝甾酮类化学成分的含量测定结果。建立一种基于“甾酮类化学成分-抗氧化生物活性”关联研究思路的Logistic回归模型,为牛膝药材的质量控制提供参考。
1 仪器与材料
1.1 仪器
ACQUITYH_ClASS型超高效液相色谱仪(美国沃世特公司):包括二元超高压溶剂系统、FTN自动进样管理器、PDA检测器和Empower3 色谱工作站;1510型全波长酶标仪(美国赛默飞世尔公司);Sartorius CPA225D十万分之一电子分析天平(德国赛多利斯科学仪器有限公司)。
1.2 试药
对照品25R-牛膝甾酮(批号HS94175W2)、25S-牛膝甾酮(批号H1098998198)均购于宝鸡辰光生物科技有限公司,纯度≥98%;对照品β-蜕皮甾酮(批号MUST-18120209)购于成都曼思特生物科技有限公司,纯度≥99%;ABTS自由基试剂盒和羟自由基试剂盒均购于南京建成生物工程研究所;1,1-二苯基-2-三硝基苯肼购于上海源叶生物科技有限公司;醋酸(色谱纯)购于西格玛奥德里奇上海贸易有限公司;乙腈(色谱纯)购于德国默克公司;水为超纯水,其余试剂为分析纯。
1.3 材料
牛膝药材主要收集于河南、河北、内蒙等地,经陕西中医药大学刘世军副教授鉴定为苋科植物牛膝(怀牛膝)A.bidentataBl.的干燥根,凭证标本存放于陕西中药资源产业化协同创新中心,具体信息见表1。

表1 21批牛膝药材信息Table 1 Collection information for 21 batches of A.bidentata

续表1(Continued Tab.1)
2 方法
2.1 牛膝甾酮类成分含量测定
2.1.1 色谱条件
色谱柱为ACQUITY UPLC®BEHC18(50 mm×2.1 mm,1.7 μm),流动相为0.2%乙酸水溶液(A)-乙腈溶液(B)。梯度洗脱程序为0~1 min,2% B;1~21 min,2%→22% B;21~25 min,22%→2% B;25~28 min,2% B。体积流量0.3 mL/min,柱温30 ℃,进样2 μL,检测波长为250 nm。
2.1.2 溶液制备
2.1.2.1 对照品制备
精密称取β-蜕皮甾酮、25S-牛膝甾酮、25R-牛膝甾酮对照品,加甲醇溶解,制成质量浓度分别为0.1、0.8、0.1 mg/mL对照品溶液,备用。
2.1.2.2 供试品制备
精密称取本品粉末(过三号筛)1 g,置具塞锥形瓶中,加水饱和正丁醇30 mL。浸泡过夜后超声处理30分钟,过滤,用甲醇10 mL分数次洗涤容器及残渣。合并滤液和洗液,蒸干,残渣加甲醇使溶解,转移至5 mL量瓶中,加甲醇至刻度即得。
2.1.3 含量测定
将“2.1.2.1”项下对照品溶液及“2.1.2.2”项下的供试品溶液,按照“2.1.1”项下的色谱条件,分别进样2 μL进行含量测定。
2.2 抗氧化生物活性指标测定
2.2.1 ABTS自由基清除能力的测定
具体操作参照ABTS自由基试剂盒说明书,首先进行标准曲线的绘制得到线性方程为Y=-1.666 4x+2.285,决定系数r=0.999 2。将各批次牛膝的吸光值带入方程即得清除能力(A1),同理得出对照溶液的清除能力(A0)。每个样品设三个复孔,按公式(1)计算清除率。
ABTS自由基清除率=(A0-A1)/A0×100%
(1)
2.2.2 DPPH自由基清除能力的测定
参考文献[11]稍作修改,用无水乙醇将DPPH配成2 mmol/L的溶液。实验设空白组、样品组与对照组,每个样品设三个复孔。样品组中加入150 μL的DPPH溶液和150 μL牛膝各批次提取液(A1);空白组中加入150 μL的无水乙醇溶液和150 μL牛膝各批次提取液(A2);对照组中加入150 μL的DPPH溶液和150 μL的无水乙醇溶液(A0)。混匀,室温下避光静置30 min,用酶标仪测定517 nm处吸光值。按公式(2)计算清除率。
DPPH自由基清除率=
[1-(A1-A2)/A0]×100%
(2)
2.2.3 羟基自由基(·OH)清除能力的测定
具体操作参考南京建成生物工程研究所提供的羟基自由基试剂盒说明书。分别测定对照品溶液(A0)与各批次牛膝样品(A1)吸光度值,按照公式(3)计算清除率。
羟自由基清除率=(A0-A1)/A0×100%
(3)
2.3 牛膝药材等级分类
2.3.1 Logistic回归模型建立
采用SPSS 22.0软件建立回归模型。首先通过主成分分析方法找到牛膝药材等级相关的主要影响因素,该影响因素即为自变量。其次对模型进行拟合,拟合过程如下:将21批实验数据集分成训练集和测试集两部分,对训练集样品的自变量数据进行 Logistic回归分析。最后建立回归模型pi=exp(βi0+β1X1+...βχn)/[1+exp(βi0+β1X1+...βχn)],其中p为概率值,x1,…xn为自变量。然后根据该模型对测试集样品进行分类预测,预测结果P≥ 0.8则判定为该等级。药材等级赋予响应值4、3、2、1,分别代表优(I)、良(II)、中(III)、差(IV))4个等级。
3 结果
3.3 方法学考察
3.1.1 系统适用性考察
将供试品溶液和对照品溶液分别进样2 μL,记录250 nm波长下的色谱图。通过比较保留时间和峰面积,可以看出甾酮类各成分的分离度均符合测定要求,结果见图1。

图1 牛膝药材及混合对照品UPLC图谱Fig.1 UPLC map of A.bidentata and its control注:1.β-蜕皮甾酮;2.25R-牛膝甾酮;3.25S-牛膝甾酮。Note:1.β-Ecdysterone;2.25R-Inokosterone;3.25S-Inokosterone.
3.1.2 线性关系考察
精密吸取混合对照品溶液,用甲醇逐级稀释。分别按“2.1.1”项下色谱条件分析,进样量为2 μL测定峰面积。以峰面积为纵坐标(Y),质量浓度为横坐标(X),绘制各标准曲线。结果见表2,3个甾酮类成分在各浓度范围内的线性关系良好。

表2 3个甾酮类成分的线性回归方程、相关系数和线性范围Table 2 Regressive equations,correlation coefficients,linear ranges between three phytoecdysones
3.1.3 精密度试验
取混合对照品溶液,按“2.1.1”项下色谱条件,重复进样6次,考察精密度。结果显示,各甾酮类成分峰面积的RSD在0.69%~1.27%之间,表明仪器精密度良好。
3.1.4 稳定性试验
按“2.1.2.2”项下方法制备供试品溶液,按“2.1.1”项下色谱条件,每隔4小时进样一次,连续进样24小时,考察供试品稳定性。结果显示,各甾酮类成分峰面积的RSD在0.86%~1.05%之间,表明样品在24 h内稳定性良好。
3.1.5 重复性试验
按“2.1.2.2”项下的方法平行制备6份供试品溶液。按“2.1.1”项下色谱条件,进行重复性试验。结果显示,各甾酮类成分峰面积的RSD在0.54%~0.87%之间,表明方法重复性良好。
3.1.6 回收率实验
精密称定已知含量样品约1 g,共6份,分别加入一定量的对照品溶液。按“2.1.2.2”项下的方法制备供试品溶液,按“2.1.1”项下色谱条件进行测定,计算加样回收率。结果显示,各甾酮类成分的平均加样回收率在98.56%~101.38%之间,RSD小于1%(n=6),表明方法的准确度良好。结果见表3。
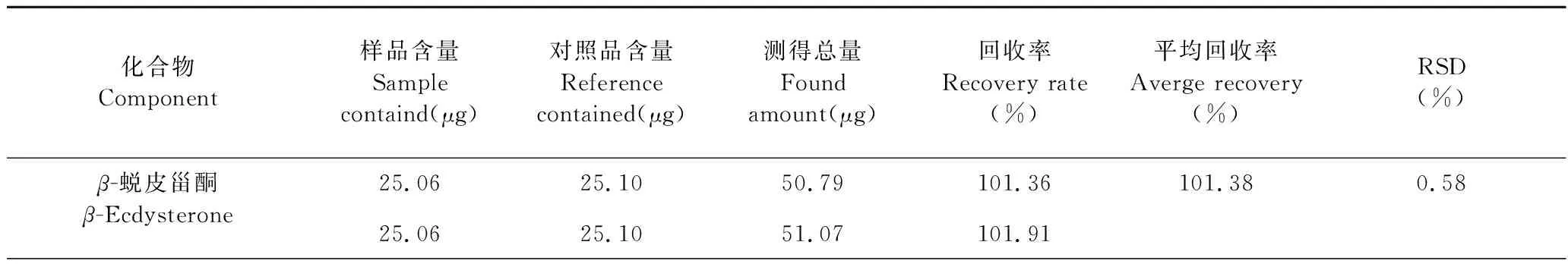
表3 牛膝加样回收率Table 3 Results of recovery test
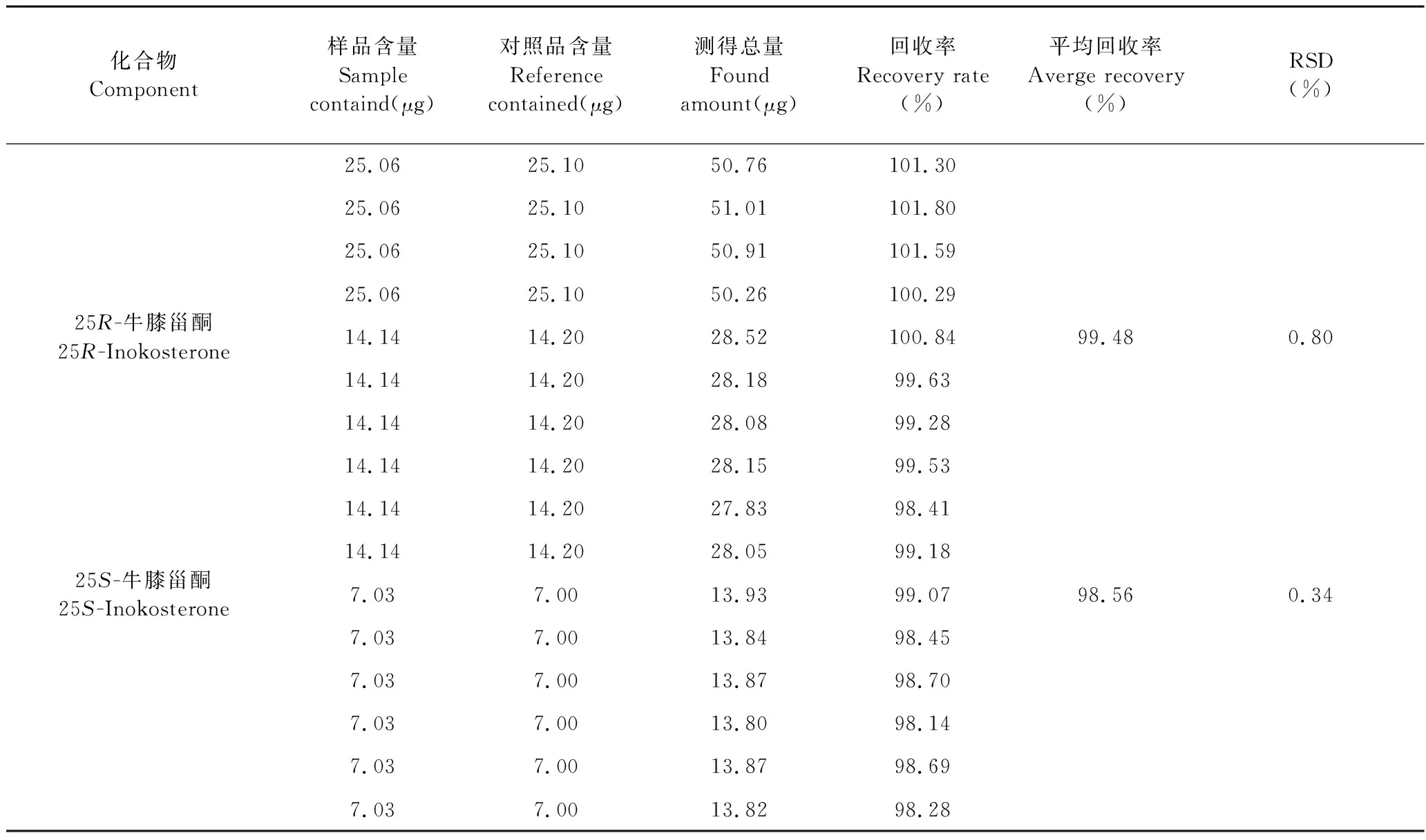
续表3(Continued Tab.3)
3.2 甾酮类化学成分含量测定
21批牛膝甾酮类成分含量测定结果见表4,分析结果可知,甾酮类成分含量均符合药典规定。但不同产地牛膝药材的甾酮类含量有明显的区别,且同一产地不同等级牛膝药材含量也有略微不同。与市面上的商品等级分类有明显区别,说明单靠形色来划分牛膝等级存在一定的不足之处。
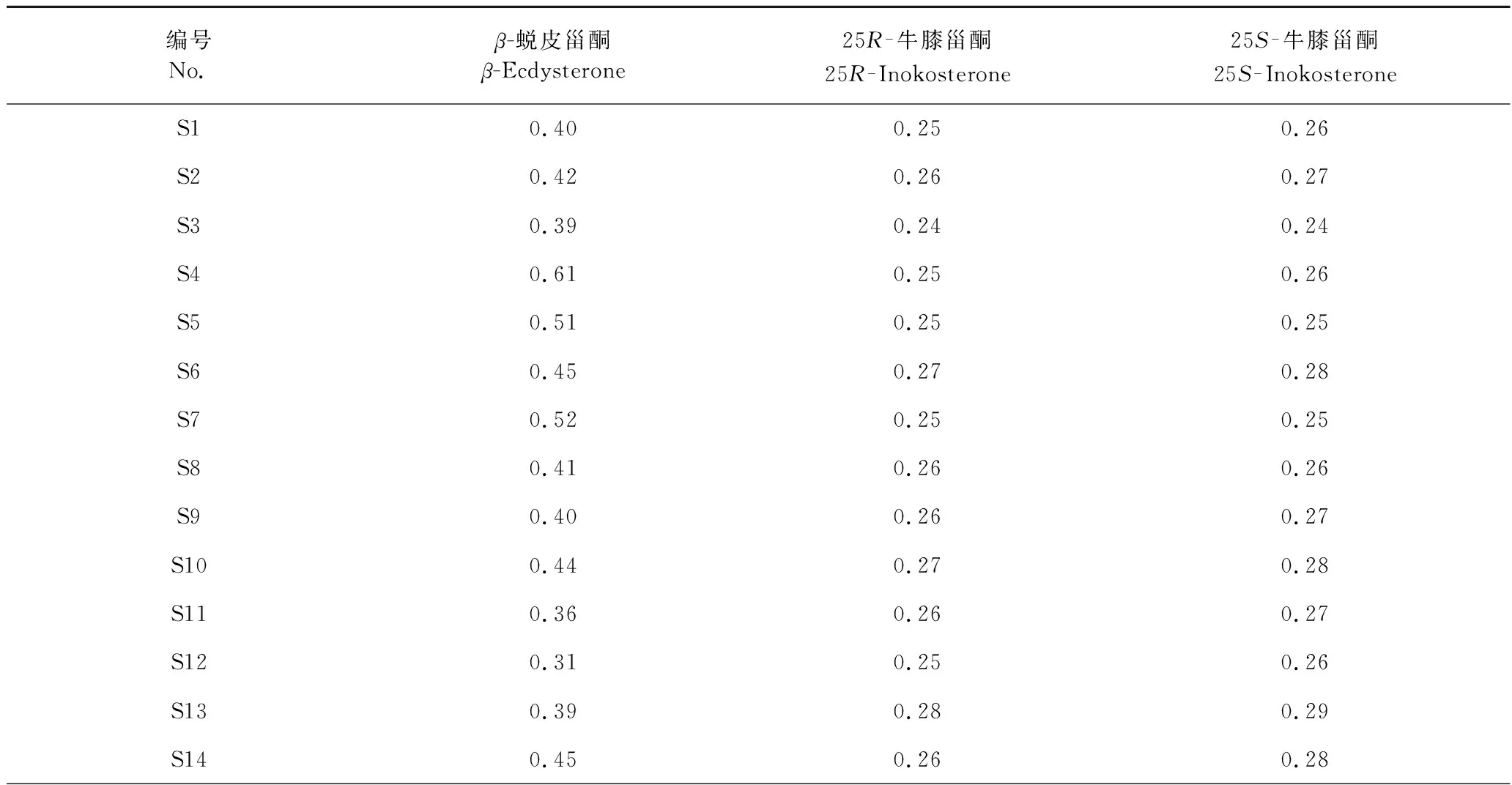
表4 21批牛膝的甾酮类成分的含量测定结果(n=3)Table 4 Phytoecdysones content determination for 21 batches of A.bidentata (n=3)(%)
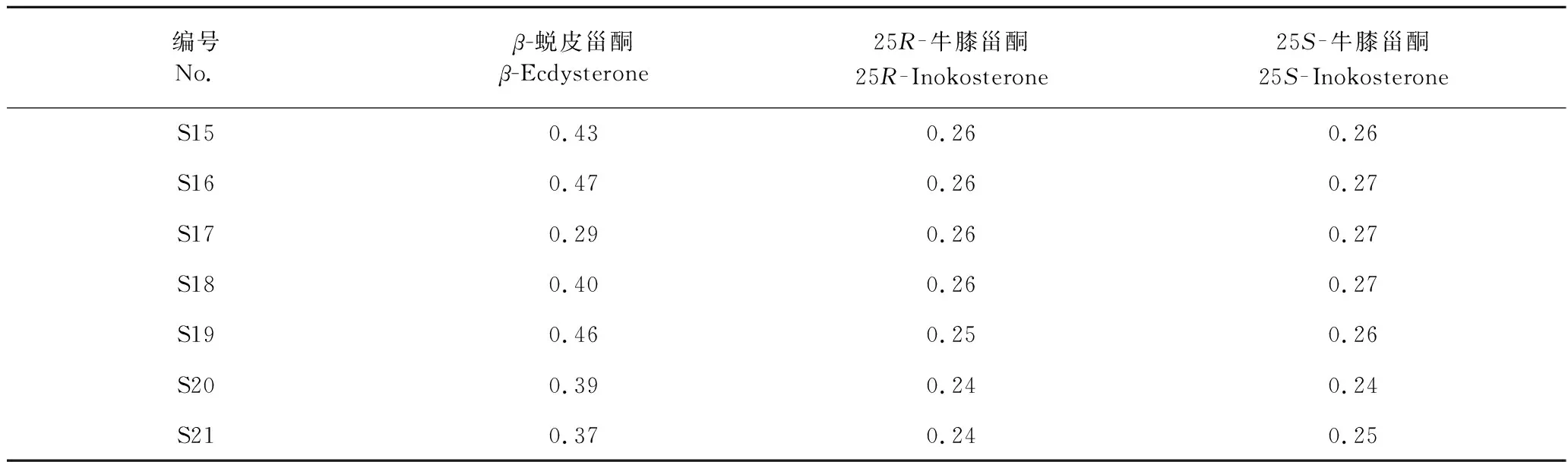
续表4(Continued Tab.4)
3.3 抗氧化生物活性指标测定结果
21批牛膝药材抗氧化生物活性指标测定结果见表5。分析结果可知,不同批次样品生物活性均有不同程度的差异。以每批样品中所测抗氧化指标的总和作为牛膝的总生物活性,同理得出总甾酮类成分含量。由图2可知,甾酮类成分含量高的一级河北、统河北、河南差(S10、S9、S13),在抗氧化性测定结果中均是较差的批次。这就表明牛膝药材抗氧化能力与甾酮类成分含量不呈单纯的线性关系。所以仅靠甾酮类成分难以全面反映牛膝整体质量。
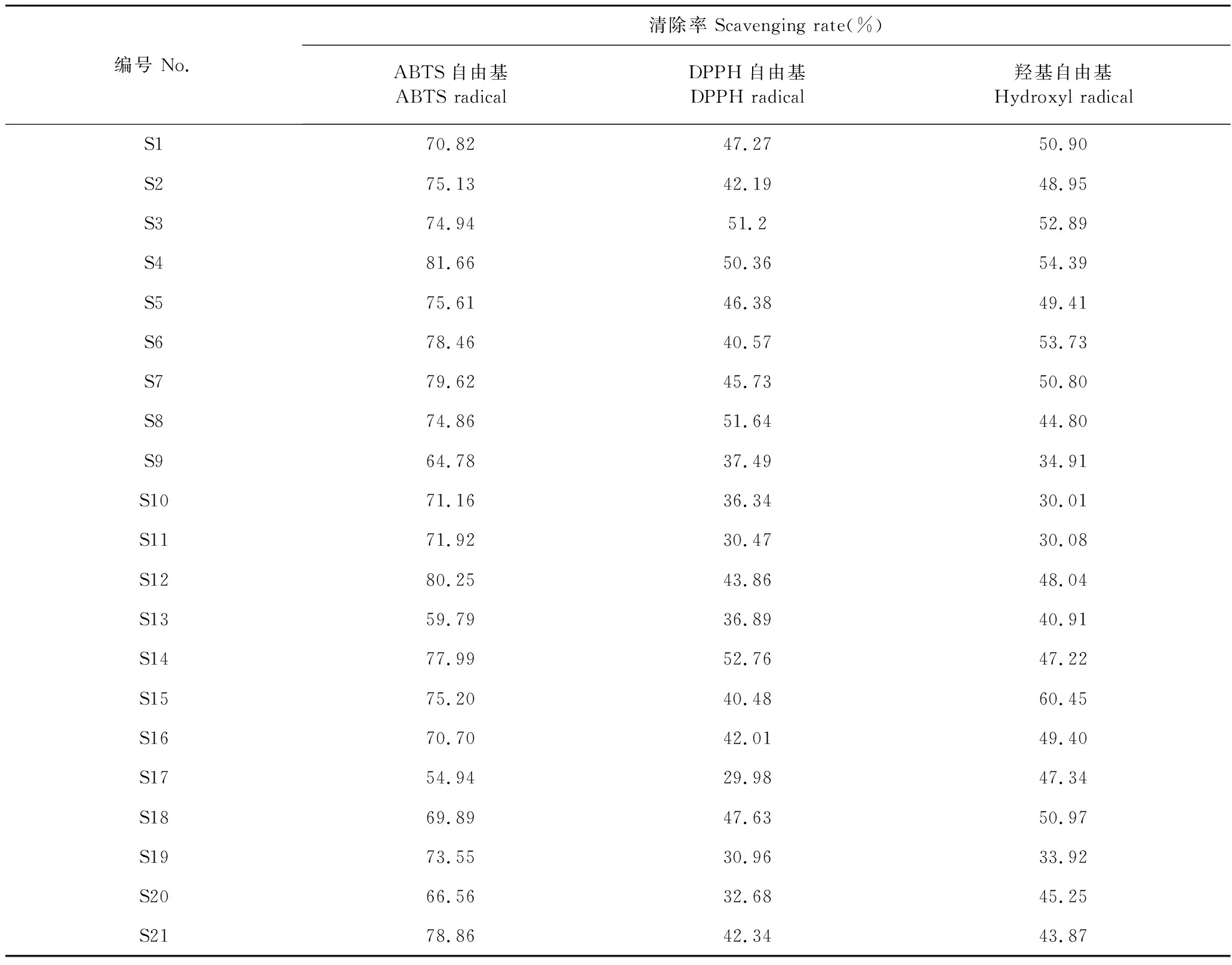
表5 21批牛膝抗氧化生物活性测定结果(n=3)Table 5 Antioxidant biological activity for 21 batches of A.bidentata (n=3)
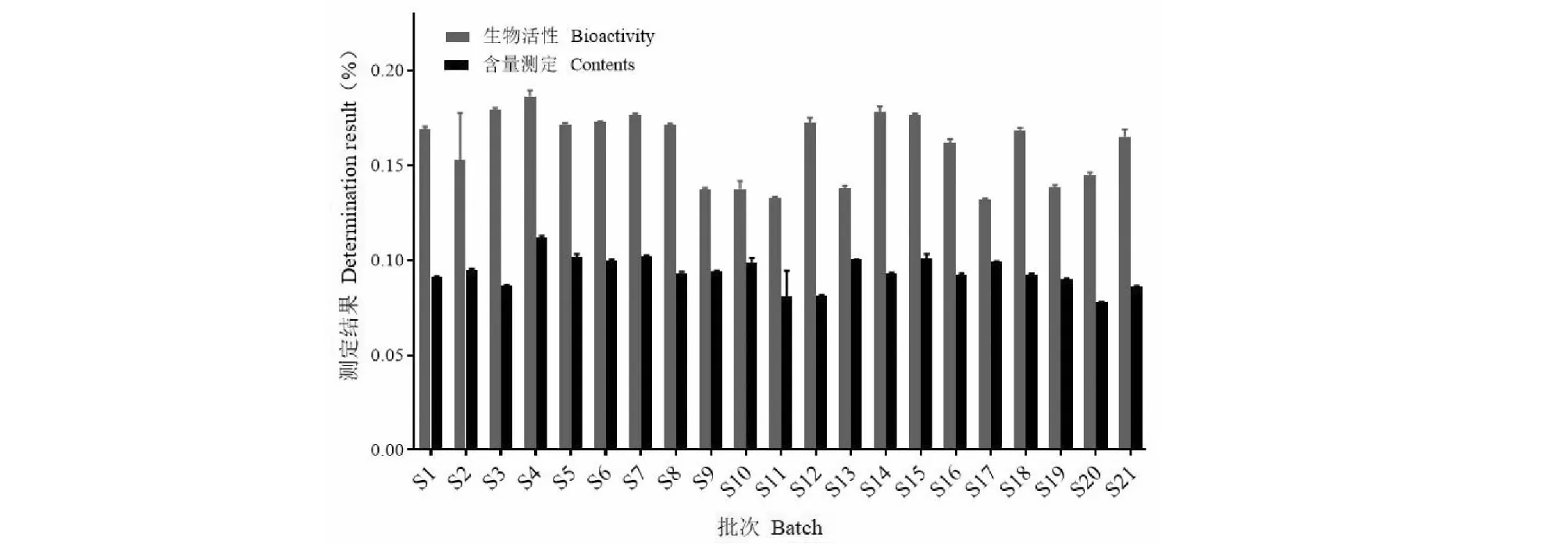
图2 21批牛膝药材的生物活性和含量测定结果Fig.2 Contents and biological activity for 21 batches of A.bidentata
3.4 牛膝等级划分
3.4.1 主成分分析
PCA可对多变量的复杂信息进行快速的整合[12]。本研究将提取的数据(n=3)标准化处理后,导入Simca-p14.1软件,得到散点图(图A)。由图可以看出牛膝各批次样品有明显分类,且分类结果与原等级不相符。进而采用HCA聚类分析方法对各批数据进行分析,可见等级间有明显的分类距离,结果见(图B)。由成分载荷图(图C)可以看出,甾酮类成分和各抗氧化因子是影响牛膝药材等级的主要因素。
3.4.2 等级预测结果
拟合选用的训练集结果如下:优级为河南牛膝(S4)和中牛膝(S7);良级为一级河南(S14)和河北牛膝(S3);中级为一级河北(S10)和二级内蒙(S19);差级为三级内蒙(S20)和河南差级(S9);利用SPSS 22.0软件得到模型表达式(见公式4~7),将测试集实测值代入下式中计算各等级的概率,结果见表5。
P优=exp (-109.517-2.429*ABTS+0.029*DPPH+1.734*·OH+4 686.863*β-蜕皮甾酮含量+571.806*25R-甾酮含量-587.029*25S-甾酮含量)/[1+ exp (-109.517-2.429*ABTS+ 0.029*DPPH+1.734*·OH+4 686.863*β-蜕皮甾酮含量+571.806*25R-甾酮含量-587.029*25S-甾酮含量)]
(4)
P良=exp (-82.132+0.148*ABTS+6.211*DPPH-0.218*·OH-5 294.954*β-蜕皮甾酮含量-547.849*25R-甾酮含量+719.112*25S-甾酮含量)/[1+exp(-82.132+0.148*ABTS +6.211*DPPH-0.218*·OH-5 294.954*β-蜕皮甾酮含量-547.849*25R-甾酮含量+719.112*25S-甾酮含量)]
(5)
P中=exp (-246.277+2.325*ABTS-7.996*DPPH+0.086*·OH+1 896.384*β-蜕皮甾酮含量+638.24*25R-甾酮含量+480.29*25S-甾酮含量)/[1+exp (-246.277+2.325*ABTS-7.996*DPPH+ 0.086*·OH+1 896.384*β-蜕皮甾酮含量+638.24*25R-甾酮含量+480.29*25S-甾酮含量)]
(6)
P差=exp (286.408-3.501*ABTS-1.775*DPPH+1.739*·OH-2 470.817*β-蜕皮甾酮含量+146.848*25R-甾酮含量+53.502*25S-甾酮含量)/[1+exp (286.408-3.501*ABTS-1.775*DPPH+ 1.739*·OH-2 470.817*β-蜕皮甾酮含量+146.848*25R-甾酮含量+53.502*25S-甾酮含量)]
(7)
4 讨论
4.1 制备方法考察
本研究对制备方法进行了考察,主要考察溶剂种类(正丁醇、乙醇、甲醇)、溶剂浓度(90%甲醇、80%甲醇、70%甲醇)和提取方式(超声提取、回流提取)三个方面。结果表明在提取充分的条件下,“2.1.2.2”项下制备方法便捷且效率高,故选用该制备方法。
4.2 色谱条件的选择
本研究比较了乙腈-0.1%甲酸水溶液、乙腈-0.1%乙酸水溶液和乙腈-0.2%乙酸水溶液三种洗脱系统的分离效果。结果表明,选择0.2%乙酸-乙腈洗脱系统时,各峰分离度较好且基线平稳,故选择此流动相。考察了美国沃世特公司的ACQUITY UPLC®BEH C18(50 mm×2.1 mm,1.7 μm)和ACQUITY UPLC®BEH C18(100 mm×2.1 mm,1.7 μm)两种色谱柱,两种色谱柱出峰灵敏度均较好,但ACQUITY UPLC®BEH C18(50 mm×2.1 mm,1.7 μm)色谱柱峰形更好,故选择此色谱柱进行色谱分析。在波长方面,PDA检测器分析结果显示在250 nm波长下,各参照峰色谱图信息较为完全。因此,选用250 nm作为检测波长。
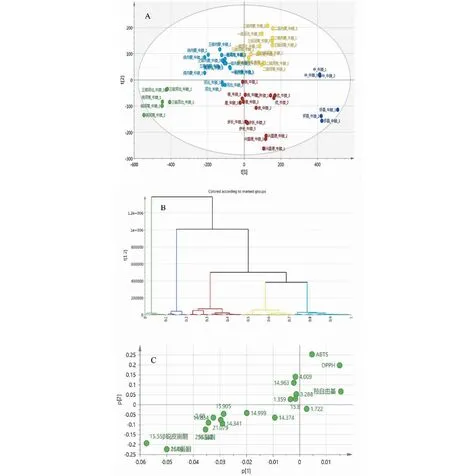
图3 牛膝药材聚类结果Fig.3 Clustering results of A.bidentata注:A.PCA散点图;B.2HCA-聚类图;C.成分载荷图。Note:A.PCA scatter diagram;B.HCA-clustering diagram;C.Loading plot.
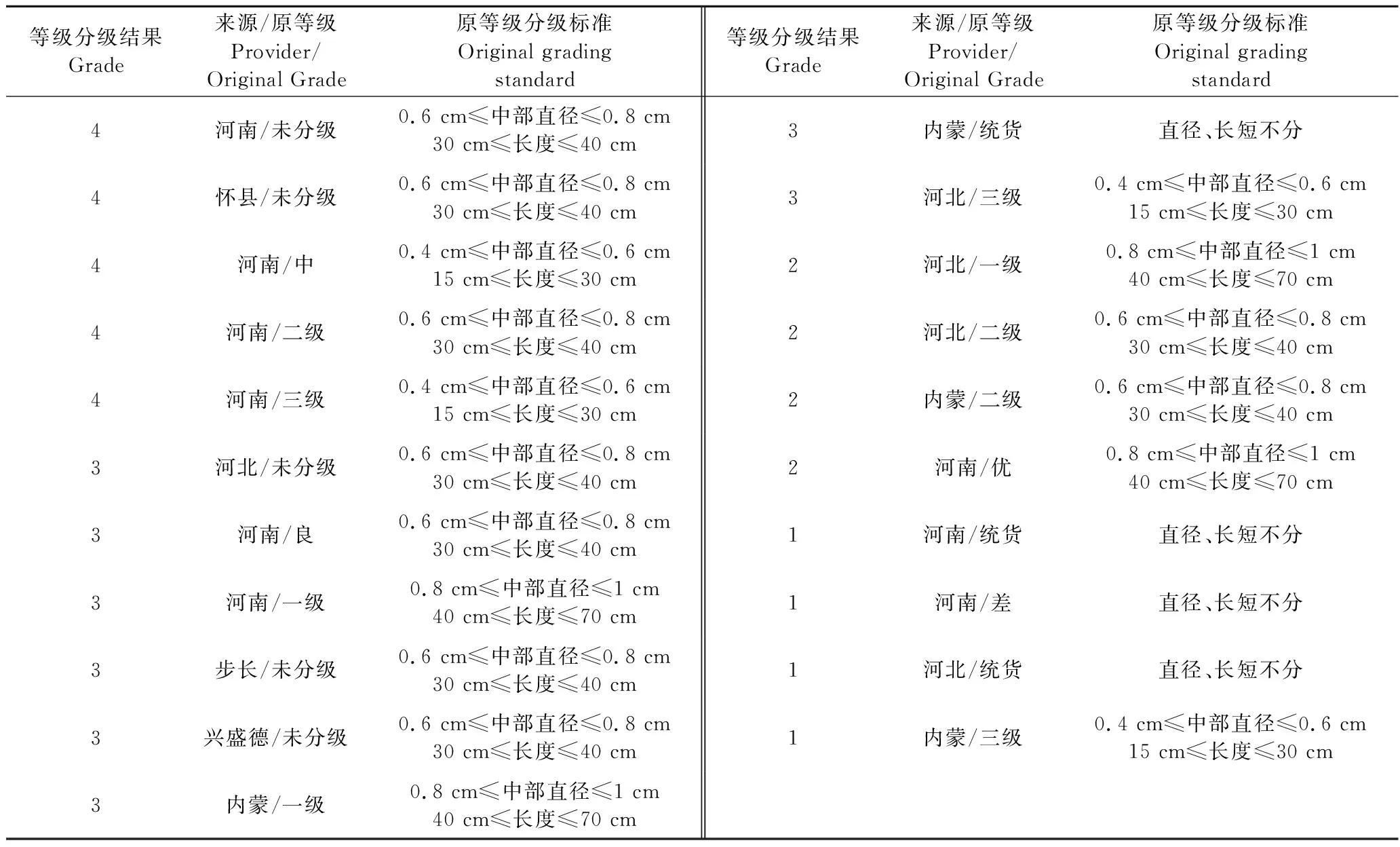
表6 牛膝药材等级评价结果Table 6 Grade evaluation results of A.bidentata
4.3 牛膝药材等级评价
2015版《中国药典》规定牛膝中β-蜕皮甾酮的含量不得低于0.03%。由表3可知,所有药材质量均达标。进一步的主成分分析结果表明,21批牛膝药材质量存在明显差异,且影响因素主要表现在甾酮类成分含量与各抗氧化因子上。在此基础上建立一种基于“甾酮类化学成分-抗氧化生物活性”关联研究的回归模型。通过该模型,21批牛膝药材被分成了优良中差四个等级。其中优级含有二级、三级河南等批次,良级含有一级河南、一级内蒙、三级河北等批次,中级含有一级河北、二级内蒙等批次,差级含有三级内蒙、统货河北与河南等批次,分级结果与商品等级不全一致。目前市场上牛膝的等级主要依靠感官评价和传统经验,主观性较强,难以标准化界定其质量。所以本研究认为基于Logistic回归模型能够更好地划分牛膝药材等级。
化学定性鉴别与指标成分检测是现行中药质量控制主要内容,而中药是个复杂的体系,仅以化学成分描述其质量优劣显然不够全面。虽然已有学者建议将生物活性与化学成分关联并用,从而更科学地评价中药的内在质量[13]。但是目前仍缺乏合理的关联方案,本研究通过Logistic回归模型将“化学成分-生物活性”进行了有效的关联,为牛膝的质量控制与评价提供了新的研究思路。
