野生建兰根际与根内共生细菌种群结构差异分析
2020-11-09谢泰祥张清华周杰陈娟马山虎艾叶
谢泰祥 张清华 周杰 陈娟 马山虎 艾叶
摘要:[目的]比较野生建兰根际和根内细菌的种群结构差异,为研究根共生细菌与建兰的营养关系奠定理论基础。[方法]采用高通量测序技术鉴定福州鼓山野生建兰根际和根内共生细菌,分析其种类多样性和种群结构。[结果]建兰根际、根内拥有种类多样的细菌,辛普森指数分别为0.99、0.95;香农指数比较显示建兰根际细菌种类多样性显著高于根内。建兰根际拥有10门细菌,优势门为变形菌门(60。5%)、酸杆菌门(20.5%)、放线菌门(15.3%),根内优势细菌门分别为变形菌门(75.3%)、酸杆菌门(7.3%)、放线菌门(14.6%)。根际与根内丰度最高的10个细菌属中,Solibacter、Acidipila仅在根际中,戴氏菌、新鞘氨醇菌和Granulicella仅存在于根内。根际中酸杆菌门酸杆菌纲的丰度显著高于根内,11个差异显著的目,仅肠杆菌目在根内的丰度大于根际,根际有12个属的丰度显著高于根内。[结论]建兰根际与根内细菌种类丰富度存在显著性差异,其原因可能是不同生态位的细菌对建兰的生物学功能存在较大差异。
关键词:建兰;根际细菌;根内生细菌;种群结构;种类多样性
中图分类号:Q93;S682.31文献标志码:A 文章编号:1008-0384(2020)05-0560-09
0 引言
(研究意义)建兰(Cymbidium ens沁Bum)隶属于兰科兰属,为多年生草本植物。建兰具有极高的观赏与文化价值,被誉为国兰七大类之一。现有研究表明,兰科植物共生菌根真菌在兰花种子萌发、植株生长发育过程中起着重要的作用。兰科植物的菌根属于内生菌根类,其最大的特征就是菌根真菌在兰科植物原球茎细胞内或成年植物根部皮层细胞内形成特殊的菌丝团结构,为兰科植物生长提供必要的营养元素。因此,在现代菌根类型中,兰科植物的共生菌根真菌被独立地划分为:兰科菌根。除此之外,兰科植物还存在丰富的共生细菌,本试验研究建兰根共生细菌的种类多样性和种群结构对于揭示共生细菌与建兰的营养关系,指导人工繁育技术满足建兰市场需求以及保护野生建兰资源具有重要的意义。(前人研究进展)兰科共生细菌在兰花的生长发育过程中也起到重要的作用,它们可以通过产生生长素类物质、促进矿物质吸收、光合作用等机制促进兰科植物的生长。已有的研究发现,从春兰Cvrubidium goeringii根部分离获得多个根瘤菌属(Rhizobium)的细菌种类,能直接产生IAA生长激素刺激植物生长。吴庆珊等利用不同培养基对金钗石斛Dendrobium nobile不同部位进行分离培养,获得芽孢杆菌属(Bacillus)和短芽孢杆菌属(Brevibacillus)为优势属,Bacillussubtilissubsp.sub~lis和Brevibacillus invocatus为优势种,且根内生细菌丰富度明显高于其他部位。同时研究者在对石斛属(Dendrobium)种子进行体外共生萌发实验,蓝细菌门(Cyanobacteria)、根际细菌(Rhizobacteria)在不添加菌根真菌的条件下能刺激種子体外共生发芽。同时从建兰根内分离出来的真菌有镰刀菌属Fusarium、肉座菌属Hypocrea、小球腔菌属Leptosphaeria、曲霉属Aspergillus等真菌。(本研究切入点)目前从兰科植物中发现的细菌已经超过60个属,分布最为广泛的主要种类有革兰氏阳性菌的芽孢杆菌(Bacillus)和革兰氏阴性菌的假单胞菌(Pseudomonas);另外,链霉菌属(streptomyces)、肠杆菌(Erwinia)、黄杆菌属(Flavobacterium)也是常见的兰科植物共生细菌。但是建兰根际以及根内共生细菌的群落结构尚未见相关研究报道。(拟解决的关键问题)本研究以福州市鼓岭山脉的3丛野生建兰为材料,基于高通量测序技术分析了建兰根际土壤(Rhizosphere,Rhiz)及根内(Endosphere,Endo)细菌的种类多样性、种群结构,同时比较了3丛野生建兰根共生细菌种类的异同,筛选出共有细菌种类。研究结果将丰富人们对建兰根际与根内细菌的认知,为建兰人工快速繁育技术的开发提供相关理论基础。
1材料与方法
1.1 样品采集
样品于2018年5月在福建省福州市鼓岭山脉采集。随机选择不同位置的3丛野生建兰居群,轻轻地将土壤表面植物残体,以及建兰根周围的土壤移除,仅保留根周围0.5cm厚度的土壤。将除去残体和根围土壤的建兰根剪下,用软毛刷刷掉附着在根表面土壤颗粒,放人50ml无菌离心管,标记为根际土壤(Rhizosphere,Rhiz),放人液氮罐中保存。
1.2 DNA提取野生建兰根际与根内共生细菌种群结构差异分析
样品的处理参照Edwards等人的样品处理方法将刷掉根表面土壤颗粒的根样品放人无菌三角瓶中,加入100ml无菌PBS缓冲液,大力将根表面的残余土壤洗涤下来;洗涤过后的根样品继续加入100ml无菌PBS缓冲液,在50~60Hz(输出频率42kHz,功率90w,Branson Unltrasonics)上超声波处理30s,随后大力摇晃并重复超声波操作处理30s;重新加入100ml无菌PBS缓冲液,重复上述超声波洗涤工作,以确保从根表面去除所有的微生物,清洗后的根标记为根内细菌(Endosphere,Endo)。使用离心柱型土壤DNA提取试剂盒(MoBio公司)提取建兰根际土壤总DNA;根部总DNA的提取使用天根生活科技有限公司的DP305型DNA提取试剂盒。提取的DNA经凝胶电泳检测,合格DNA存入-80℃备用。
1.3 细菌16S区域扩增及测序
将合格的DAN样品稀释到1ng·uL-1,以稀释的DNA为模板,使用引物515F(5.-GTGCC AGCMGCCGCG GTAA-3.)和806R(5-GGACT ACHVGGGTWT CTAAT-3′)扩增细菌16S rDNA的V4区域,PCR条件为98℃30s预变性,接下来98℃变性10s,65℃退火30s,72℃延伸30s,72℃延伸5min.将PCR产物纯化以后送至北京诺禾致源科技股份有限公司,使用Ion Plus Fragment Library Kit 48ixns试剂盒(Thermofisher)构建测序文库,并根据所扩增区域的特点,基于IonS5TMXL测序平台,利用单端测序(Single-End)的方法,构建小片段文库进行单端测序。
1.4 数据分析
1.4.1OTU聚类和物种注释 使用Uparse软件对所测序样品的全部Clean Reads进行聚类分析,以一致性达到97%的序列聚为相同的可操作分类单位(Operational/axonomic Units,OTUs)。筛选OTUs中出现频数最高的序列作为OTUs的代表序列。用Mothur方法与SILVA(http://www.arb-silva.de/)的SSUrRNA数据库对OTUs代表序列进行物种注释(设定阈值为0.8~1.0),获得序列指代的细菌分类地位,并在界、门、纲、目、科、属、种水平统计样品细菌的群落组成。
1.4.2种类多样性分析使用Qiime 1.9.1对均一化处理后的数据进行计算,获得各个样品的种类数量(Observed-species)、香农指数(Shannon index)、Chaol指数、辛普森指数(Simpson index);使用R软件(Version2.15.3)绘制稀释曲线,物种累积曲线。
1.4.3种群结构比较分析 对3个不同居群建兰根际、根内细菌种群结构进行比较,筛选3个不同地点样品的共有根际、根内细菌OTUs.根际(Rhiz)和根内(Endo)差异显著的物种分析利用R软件做组间T-test检验并作图。
2 结果与分析
2.1测序结果评价
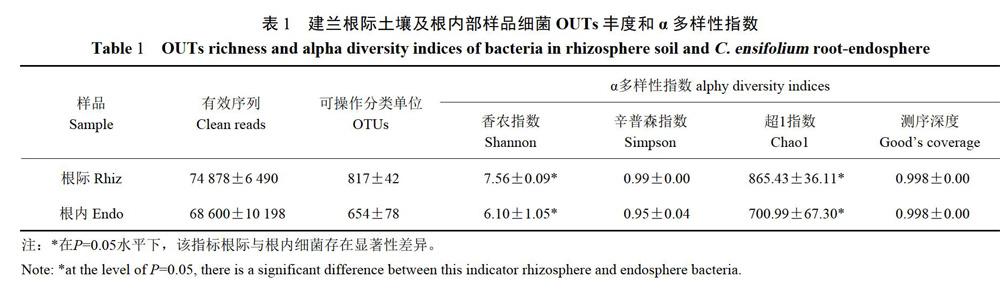
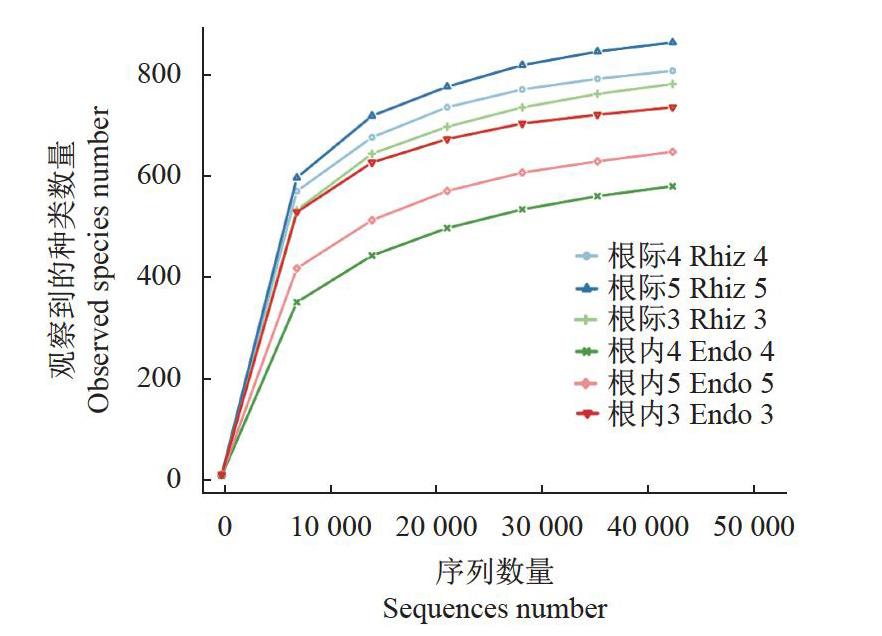
通过对6个样品16S rDNA V4区域进行高通量测序共获得430434条Clean reads,根际土壤样品的平 均Clean reads数量为74848,根内样品的平均Cleanreads为68599(表1),所有样品中最低的Cleanreads为57117.通过绘制建兰3个样品的根际及根内细菌高通量测序结果的稀释曲线(RarefactionCurve)检测样品的测序深度是否达到要求。稀释曲线显示,测序数据量达到50000条时,各样品中呈现出的物种数量趋于平坦(图1);各样品测序深度指数good'scoverage均等于0.998(表1);表明该测序已经获得足量的测序数据,能够有效覆盖样品中物种数量,测序数据量合理。
2.2 建兰根际与根内细菌种类多样性分析
基于≥97%的相似度水平,通过聚类分析共获得4412个有效OTU,根际土壤获得(817±42)个OTU,多于根内共的654-4-78个OTU(表1),二者不存在显著性差异,但是香农指数显示根际土壤细菌的种类数量显著高于根内细菌种类(P=0.05)。建兰的6个测序样品中,End04的辛普森指数(Simpson)最低为0.90,另外2个根内样品辛普森指数分别为0.96与0.98,根际土壤的则为0.99,证明建兰根际与根内细菌种类多样性高(辛普森指数的范围是0~1,越趋近于l表明种类多样性越高)。Chaol用来判断群落的物种丰富度,数值越大,表示物种种类越多。3个根际样品的平均细菌Chaol指数865.43大于根内细菌的Cha01指数700.99,T-test检验结果显示根际与根内细菌种群丰富度存在显著差异(P=0.05)。
2.3 建兰根际与根内细菌种群结构
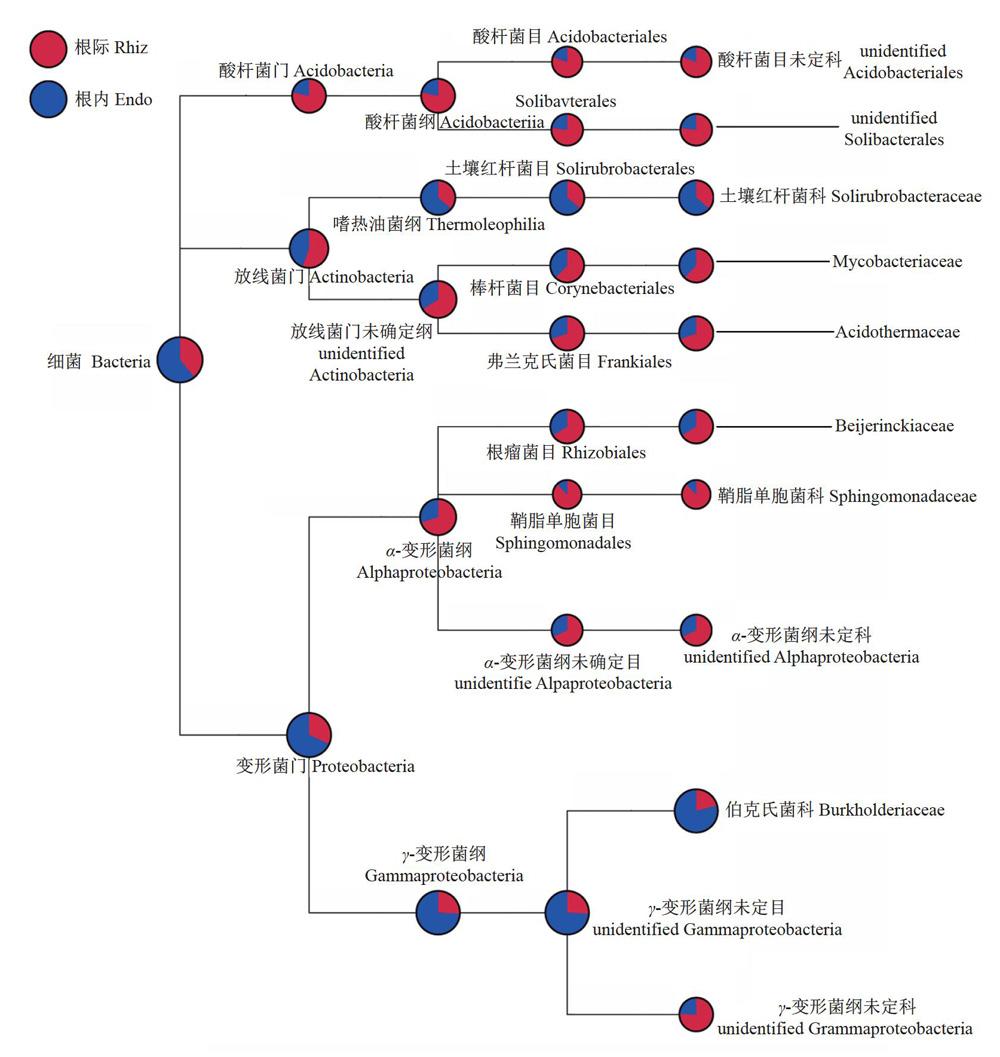
对3丛野生建兰根际细菌高通量测序获得的224635条clear reads进行种类注释,发现建兰根际细菌主要分布在变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、装甲菌门(Armatimonadetes)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、绿弯菌门(Chlorotlexi)10个门,根际细菌的10个门含有17纲(+8个未鉴定纲),39目(+5个未鉴定目)和113个确定的属;根内细菌有13纲(+7个未鉴定纲),37目(+2个未鉴定目)和107个确定的属。根际细菌中变形菌门占种群数量的60.5%,为优势门类,酸杆菌门占20.5%,放线菌门占15.3%,其余7个门类仅占3.7%。根内细菌同样分布在上述10个门,其中变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)分别占种群数量的75.3%、7.3%和14.6%。优势种群的纲有酸杆菌纲(Acidobacteriia)、嗜热油菌纲(Thermoleophilia)、α-变形菌纲(Alpha-proteobacteria)、γ-变形菌纲(Gammaproteobacteria)和一个放线菌门(Actinobacteria)未确定纲(图2)。
根际与根内细菌群落中丰富度最高的lO个目是一致的,有一个γ-变形菌纲未定目(unidentifiedGammaproteobacteria),根瘤菌目(Rhizobiales),酸杆菌目(Acidobacteriales),土壤红杆菌目(Solirubro-bacterales),棒杆菌目(Corynebacteriales),α-变形菌纲未定目(unidentified Alphaproteobacteria),柄杆菌目(Caulobacterales),弗兰克氏菌目(Frankiales),Solibacterales,Micropepsales(图3)。根据与根内细菌豐富度最高的属存在明显差别。根际细菌群落丰富度最高的10个属分别是一个伯克氏科菌未定属(unidentified Burkholderiaceae)、热酸菌属(Acidothermus)、醋酸杆菌属(Acidibacter)、Roseiarcus、分支杆菌属(Mycobacterium)、SoBbacter、慢生根瘤菌属(Bradyrhizobium)、Conexibacter、Acidipila、和α-变形菌未鉴定属(unidentified Alpha-proteobacteria);根内细菌丰富度最高的10个属分别是一个伯克氏科菌未定属(unidentified Burkholderiaceae)、Conexibacter、分支杆菌属(Mycobacterium)、热酸菌属(Acidothermus)、Roseiarcus、戴氏菌属(Dyella)、醋酸杆菌属(Acidibacter)、新鞘氨醇菌属(Novosphingobium)、GranuBcella、慢生根瘤菌属(Bradyrhizobium)(图4)。
2.4 建兰根际与根内细菌差异分析
通过T-test检验,在门、纲、目、属分类单元下找出根际与根内组间的差异物种。在P=0.05差異水平下,建兰根际与根内仅有酸杆菌门(Acidobacteria)数量存在显著差异;在纲分类单元下有酸杆菌纲(Acidobacteriia)差异显著;根际与根内细菌种群存在显著差异的目有:根瘤菌目(Rhizobiales)、酸杆菌目(Acidobacteriales)、柄杆菌目(Caulobacterales)、弗兰克氏菌目(Frankiales)、粘球菌目(Myxococcales)、肠杆菌目(Enterobacteriales)、咸水球形菌目(Salinisphaerales)、Catenulisporales和噬纤维菌目(Cytophagales),还包括一个酸杆菌门未定目(unidentified Acidobacteriia)和一个疣微杆菌门未定目(unidentified Verrucomicrobiae)。有12个属:热酸菌属(Acidothermus)、醋酸杆菌属(Acidibacter)、SoBbacter、慢生根瘤菌属(Bradyrhizobium)、酸杆菌门未鉴定属(unidentifiedAcidobacteriia)、不粘柄菌属(Asticcacaulis)、柄细菌属(Caulobacter)、Pedosphaera、Pajaroellobacter、嗜盐囊菌属(Haliangium)、Actinospica、游鱼孢菌属(Jporichthya)在建兰根际与根内中的种群数量存在显著差异(图5)。
分别分析3丛不同居群建兰的根际、根内细菌的共有种类,共筛选到根际共有OTUs 588个,根内共有OTUs 379个(图6),其中根内共有的379个细菌OTUs中的339个同时分布在根际土壤中,仅有40个OTUs是根内特有的。分别对共有OTUs进行鉴定,根际的588个OTUs涉及到16纲39目93属,根内的379个共有OTUs鉴定出13纲,36目,64属;根际与根内共有的OTUs包含8门,13纲,32目60属;根际与根内共有的40个OTUs分布在6门,7纲,14目,能确定的属有10个,分别是双歧杆菌属(Bifidobacterium)、Protochlamydia、类芽孢杆菌属(Paenibacillus)、链球菌属(Streptococcus)、Bauldia、红游动菌属(Rhodoplanes)、新鞘氨醇杆菌(Novosphingobium)、嗜酸菌属(Acidiphilium)、蛭弧菌属(Bdellovibrio)、沙雷氏菌属(Serratia)。
3 讨论与结论
应用16S rDNA高通量测序鉴定3丛野生建兰根际土壤(Rhiz)和根内(Endo)共生细菌的种类,结果表明建兰根际土壤和根内都存在丰富的细菌,种类多样性高,根际土壤细菌种类多样性显著高于根内细菌(P=0.05)。对其种群结构进行分析,发现根际和根内细菌种群结构中变形菌门细菌数量占绝对优势。分析3丛不同居群建兰的根际与根内细菌的共有OTUs,发现根内绝大多数OTUs同样存在于根际土壤中,仅有10个属的细菌是根内特有的。但是,差异性分析发现,根际与根内细菌种类丰富度存在显著性差异,这可能与土壤环境较植物组织内部系统更为复杂有关。根内特有细菌主要与根内特定真菌结合形成真菌内共生细菌(EndofungalBacteriun,EFB)。EFB主要为真菌宿主提供生物能力、糖化合物和维生素等必需因子,促进真菌宿主降解有毒性氧化物质的功能,从而提高植株菌根的形成量。因建兰种子萌发需要依靠特定的菌根真菌的侵染为其提供所需的营养,推测真菌在完成侵染后,需要特定的细菌进入根内,为真菌宿主的代谢、繁殖和抗逆性提供辅助作用,从而出现不同生态位的细菌的生物学功能出现较大差异现象。因此,研究建兰根际和根内细菌的生物学功能对揭示根部共生细菌对建兰生长的影响具有重要意义。
兰科植物依其所属生态类型可分为地生兰、附生兰和腐生兰3类,建兰属于地生兰,现有研究已经证实菌根真菌在促进建兰种子萌发和植株生长方面起着重要的作用,而兰科植物根际细菌,尤其是根内生细菌的作用也逐渐被挖掘,比如石斛属(Dendrobium)。但是关于建兰根共生内细菌及其与建兰之间营养关系的研究尚未有报道。本文发现建兰根际、根内细菌中种群数量最高的前10个属有中分别有8、9个确定的属。其中,短根瘤菌属(Bradyrhizobium)在根际和根内都有检测到。该属细菌地域分布范围很广,能够与多种豆科植物形成共生关系,促进宿主N素的吸收。短根瘤菌属在建兰根际土壤和根内部丰富度较高,推断该细菌在与建兰的生长发育存在密切的联系,短根瘤菌是否与建兰形成共生关系,需要获得纯培养菌株并进一步接种建兰加以验证。很少有证据表明柄细菌属(Caulobacter)细菌对植物有益,最新的研究发现Caulobacter sp RHGl菌株可以定殖拟南芥的根和芽,促进根中的侧根形成,并增加枝条中的叶数和叶大小,该属细菌是否促进建兰生长根系发育需要进一步研究。明确此类细菌与建兰的营养关系能够为建兰人工繁育提供有效的促生因子,但是,建兰根际和根内存在多个目前不能培养的细菌,如Solibacter属细菌,对于此类细菌功能的研究可利用宏基因组技术进行研究。
比较建兰根际土壤与根内细菌种类的异同,相对丰度最高的10个属,根际与根内细菌存在多个相同的属,但是Solibacter和Acidipila属仅在根际中检测到,而戴氏菌(Dyella)、新鞘氨醇菌(Novosphingobium)和GranuBcella属仅存在建兰根内。在不同分类单元上,均存在丰度差异显著的细菌类群;而且除了根内特有的细菌种类,其余显著性差异的细菌类群都是根际细菌含量高于根内同类细菌,OTUs数量同样显示根际细菌的细菌数量大于根内细菌,这与土壤环境更为复杂,微生物类群更为丰富的普遍认知相一致。
综述所述,建兰根际土壤和根内存在种类丰富的细菌,具有极高的生物多样性,而且根际与根内细菌种群结构存在差异,部分种类差异显著。本研究为从建兰根际和根内细菌中挖掘促生因子奠定了理论基础,具有一定的指导意义。
