一种快速脱盐制备大肠杆菌电转化感受态细胞的方法
2020-11-09蔡松杨东成唐梅
蔡松 杨东成 唐梅
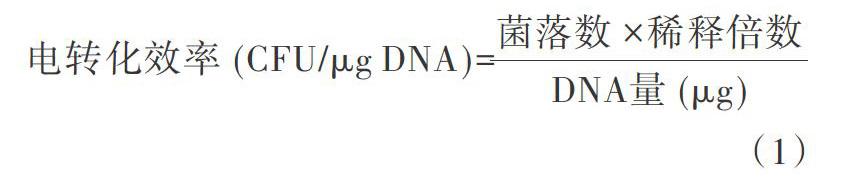

摘要:为了建立一种高效快捷的大肠杆菌(Escherichia coli)电转化方案,采用类似密度梯度离心的方法,使用角转子离心机达到快速除盐的目的。研究发现,以20%甘油(V/V)/1.5%甘露醇(m/V)溶液作為梯度介质,采用菌悬液与梯度介质比例为1∶5 (V/V)时形成的密度梯度可有效地进行离心除盐,离心后的细胞以20%甘油(V/V)/1.5%甘露醇(m/V)溶液重悬,随后在电场强度为15 kV/cm的条件下进行电转化能得到较高的转化效率,而在室温条件下进行电转化试验不能提高转化效率。本研究仅通过2次离心,电转化效率可达到4.2×109 CFU/μg DNA,大大简化了试验流程。
关键词:电转化;感受态细胞;脱盐;大肠杆菌(Escherichia coli)
中图分类号:Q812 文献标识码:A
文章编号:0439-8114(2020)17-0170-05
Abstract: A similar density gradient centrifuge method was adopted to establish an efficient and fast protocol for Escherichia coli electrotransformation. Angle rotor centrifuge was used to achieve the goal of rapid desalination of cells using 20% glycerol (V/V) /1.5% mannitol (m/V) solution as gradient medium. The ratio of bacteria suspension to gradient medium was 1∶5 (V/V) to form a density gradient, which led to effectively centrifugal desalination. After centrifugation the cells were resuspended in a mixture of 20% glycerol (V/V)/1.5% mannitol (m/V), sequentially electroporated at 15 kV/cm. This procedure was suitable for effective desalination. Electroporation at room temperature did not improve transformation efficiency. In this study, the electransformation efficiency can reach 4.2×109 CFU/μg DNA only by two centrifugation, which greatly simplifies the experimental procedure.
Key words: electrotransformation; competent cells; desalting; Escherichia coli
电转化方法相比化学转化方法,具有转化效率极高的特点[1],传统的RED基因敲除技术[2]和最新的crispr/cas9-基因敲除/置换技术[3]高度依赖于电转化方法。相比较而言,传统化学转化一般不能胜任基因敲除中转化大量核酸片段的工作,虽然一些高效的化学转化方法如Hananan[4]法以及Inoue[5]法理论转化效率能达到1.0×108~1.0×109 CFU/μg DNA,也能满足电转化需要——构建高质量的基因文库、抗体库和突变库等工作,但从很多研究来看,自制的化学感受态细胞转化效率仅为1.0×107 CFU/μg DNA甚至更低[6],很多时候只能购买价格昂贵的商业化感受态细胞来进行相关试验,这无疑增加了科研成本。制备高效的电转化细胞方法一直是研究关注的热点,优化培养基、细胞培养时添加组分、寻找适宜菌龄的感受态细胞及细胞浓度等[7],都可以进一步提高电转化方法的实用性和高效性。
虽然电转化具有转化效率高的特点,但在制备感受态细胞时也面临制备时间长、相关步骤繁琐等问题。由于电转化的试验原理要求细胞悬浮液中导电离子尽可能少,且常规电转化需要低温离心多次去盐[8],因此增加了整个转化过程的操作时间,反复离心和重悬细胞还会影响感受态细胞的转化效率。有研究提出了类似密度梯度离心的方式[9],以达到快速除盐的目的,这种方法大大减少了离心次数,但需要使用具有水平转子的离心机,且要求离心机转速变化缓慢且平稳,这对普通科研实验室的离心机设备提出了一定要求。
基于以上思路,本研究提出在具有角转子的任意离心机上制备高感受态细胞的方法。不同于上述方法在离心管中菌液底部加入梯度介质,本研究提出先加入梯度介质形成密度梯度,再加入浓缩好的菌液。两种方法都基于密度梯度离心,但后者能调整菌液与脱盐介质体积以及菌液的添加方式,从而达到更好的离心去盐效果。
此外,目前有不少研究认为,在室温乃至更高温度下进行电转化细胞制备,转化效率更高[10],为了进一步简化电转化细胞制备,本研究也尝试在室温下进行电转化细胞的制备,并评估了温度对电转化效率的影响。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒 本研究采用大肠杆菌(Escherichia coli)菌株DH5α以及质粒pUC19,均由实验室-18 ℃保存。
1.1.2 主要试剂 蔗糖(AR)、甘油(AR)、甘露醇(AR)室温保存,氨苄青霉素(>95%)4 ℃保存,均购自国药集团化学试剂有限公司。
1.1.3 培养基 LB固体培养基:1%(m/V)蛋白胨,0.5%(m/V)氯化钠,0.5%(m/V)酵母粉,2%(m/V)葡萄糖,2%(m/V)琼脂粉;抗性筛选培养基:LB固体培养基,氨苄青霉素50 mg/L;SOC培养基:2%(m/V)蛋白胨,0.5%(m/V)酵母粉,0.05%(m/V)氯化鈉,0.018 6%(m/V)氯化钾,0.095%(m/V)氯化镁,0.36%(m/V)葡萄糖。
1.1.4 主要仪器与设备 电击杯和MicroPulser电穿孔仪(美国 Eppendorf公司),Centrifuge 5417R和Centrifuge 5804R离心机(美国 Eppendorf公司)。
1.2 方法
1.2.1 电转化感受态细胞的制备
1)从甘油管取大肠杆菌 DH5α于无抗性的新鲜LB琼脂平板上划线,37 ℃恒温培养箱过夜培养。
2)从活化 LB 平板上挑取单菌落接种于50 mL SOC培养基中,37 ℃、200 r/min振荡培养至菌液OD600 nm为0.3~0.6作为种子液,按种子液1%的接种量接种于100 mL SOC培养基中,后置于37℃摇床,200 r/min,培养至菌液OD600 nm为0.3~0.6。
3)将培养物转移至2支50 mL的无菌离心管冰浴15 min,后4 ℃、5 000 r/min离心10 min,弃除上清液,各加入1 mL预冷的20%甘油(V/V)/1.5%甘露醇(m/V)溶液重悬细胞,将其中1支离心管重悬后的菌液转移至另1支共2 mL,后置于冰水浴中。
4)向15 mL无菌离心管中加入10 mL预冷的无菌梯度介质含20%甘油(V/V)/1.5%甘露醇(m/V),后使用1 mL移液枪沿着离心管内壁缓慢倾斜注入2 mL菌悬液,使其水平铺展至甘油/甘露醇层表面。
5)随后4 ℃、4 000 r/min离心15 min,先用移液枪将上层水层去除,再将下层甘油/甘露醇层去除,尽量去除离心管内的残余液体。
6)向离心管内部加入100 μL预冷的20%甘油(V/V)/1.5%甘露醇(m/V)溶液重悬细胞,取80 μL重悬液于1.5 mL EP管用于后续电转化试验。
1.2.2 电转化 取感受态细胞80 μL和1 ng/μL的pUC19质粒于冰水浴中解冻,迅速向感受态细胞中加入5 μL pUC19质粒,用移液枪轻柔地混匀,再置于冰水浴中2 min,然后立即将细胞转移至已预冷的电击杯中,按照预设电击条件进行电击,电击结束后立即加入915 μL已在37 ℃摇床预热的SOC培养基中,于37 ℃、200 r/min培养1 h,后取100 μL菌液稀释103~104倍后,再取100 μL稀释后的菌液涂布于Amp抗性平板,放于37 ℃的恒温培养箱培养14~16 h,待平板长出菌落后,开始计算抗性平板上的菌落数,并计算电转化效率,具体公式如下:
[电转化效率(CFU/μg DNA)=][菌落数×稀释倍数DNA量(μg)] (1)
2 结果与分析
2.1 密度梯度离心技术的探索
2.1.1 离心方式的改进 有研究提出了类似密度梯度离心的方法[9],可以达到快速除盐的目的,大大减少了离心次数,其操作方式如图1a所示,主要利用了密度梯度离心的原理,在一个固定的离心力和液体黏度条件下,颗粒沉降速率主要与其自身密度ρ与溶液介质密度L之间的差值成比例,见公式(2)。
一般水作为介质时,密度ρ为1.00 g/mL(室温),用20%的甘油调整溶液介质密度ρ约为1.05 g/mL[11],而盐水的密度ρ约为1.01 g/mL[12],因此,以20%甘油作为离心时的介质,大肠杆菌沉降,而盐水溶液难以沉降,从而达到细胞和盐分的分离。该方法步骤简单,但以角转子的离心机离心时,往往难获得高效率的电转化感受态细胞。
[v=d2(ρ-L)18μ×g] (2)
式中,v为细胞的沉降速度(m/s),d为颗粒直径(m),[ρ]为颗粒密度(kg/m3),L为介质密度(kg/m3),μ为介质黏度(mPa·s),g为离心力(kg·m/s2)。
鉴于此,本研究对该方法进行了改进,如图1b所示,借鉴传统的用于细胞或细胞器分离的密度梯度离心方法[13],将菌液浓缩后铺展至梯度介质层进行梯度离心,采用横截面积更小的15 mL离心管,以此提高梯度层的稳定性,改变大肠杆菌的脱盐效率。
2.1.2 密度梯度介质的选择 密度梯度离心常用的梯度介质为甘露醇、山梨醇、甘油、蔗糖、多聚糖和中性硅胶油等[14],对于活性细胞的分离常选用蔗糖、甘油或中性硅胶油等为梯度介质,但同样密度的甘油相比于蔗糖来说,其渗透压更小、黏度更大,在离心分离过程中有利于维持细胞内外渗透压,同时黏度的增加有利于维持样品层与梯度层的稳定。其次,甘油相比于中性硅胶油价格也更便宜。因此,以甘油作为梯度介质较为经济合理。
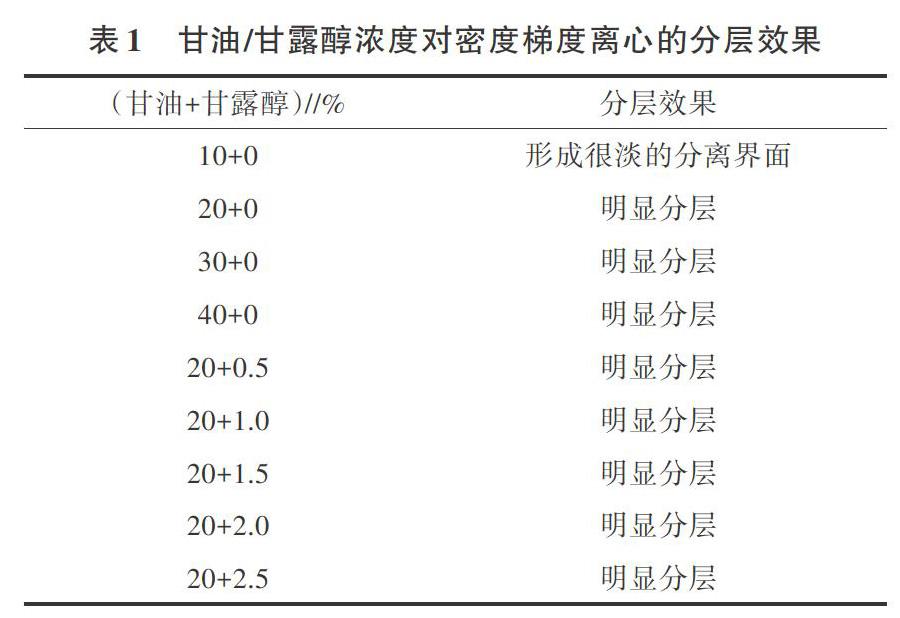
2.1.3 梯度介质浓度对密度梯度离心的影响 分别以不同浓度的甘油水溶液作为梯度介质,经4 ℃、4 000 r/min离心15 min后,如表1所示,当甘油水溶液比重达到20%(V/V)及以上时,即ρ≥1.05 g/mL,水层与甘油层实现明显的分层,即以20%甘油水溶液作为密度梯度介质。为了探究20%甘油水溶液中加入不同质量分数的甘露醇是否会影响离心前后的分层情况,经4 ℃、4 000 r/min离心15 min后,均明显分层。因此,20%甘油水溶液加入不同质量分数的甘露醇对于离心前后的分层情况没有影响(表1)。
2.2 不同浓度的甘油/甘露醇溶液对电转化效率的影响
电击结束后,往复苏培养基中添加一定浓度的渗透溶液[15]能够有效地提高电转化效率;也有研究认为,使用一定浓度的渗透溶液重悬细胞再进行电转化,对于效率的提高也有帮助[16]。为了进一步探究感受态细胞中渗透溶液对其电转化效率的影响,经密度梯度离心后(图1b),分别以预冷去离子水(即甘油与甘露醇浓度均为0)、20%甘油水溶液以及20%甘油水溶液加入不同质量分数的甘露醇(m/V)重悬细胞,辅助维持细胞在离心过程中的渗透压平衡[11]。经3次重复试验,由表2可知,以去离子水重悬细胞进行电转化试验,电转化效率为1.3×109 CFU/μg DNA;以20%甘油(V/V)水溶液重悬细胞,电转化效率最高达到2.1×109 CFU/μg DNA;而当往20%甘油(V/V)水溶液加入不同质量分数的甘露醇重悬细胞,相较于仅使用甘油水溶液重悬细胞,其效率均有一定程度提高,且以20%甘油(V/V)/1.5%甘露醇(m/V)溶液重悬细胞时,电转化效率最高达到3.3×109 CFU/μg DNA。
在电击过程中瞬时的高压使细胞形成空隙,细胞在一定时间内慢慢吸收外界物质如核酸片段,但由于胞内与胞外渗透压的差异,使得细胞内液大量外流,导致细胞大量死亡,同时也不利于外源DNA进入细胞。而通过使用20%甘油/1.5%甘露醇溶液重悬细胞,使得电转的感受态细胞处于一定浓度的渗透溶液中,能够维持细胞内外的渗透压平衡,从而有效防止细胞内容物外流,提高了细胞的存活率,使最终的电转化效率进一步得到提高。
2.3 梯度介质体积对电转化效率的影响
密度梯度离心法的优点在于仅离心1次就获得较纯的样品颗粒,减少离心步骤。但使用密度梯度离心法分离样品时,样品的添加体积是试验成败的关键因素之一[17]。为此,将菌悬液体积固定为2 mL,通过改变梯度介质的体积,以探索梯度介质体积对分离效果的影响,进而找到最适合的菌悬液/梯度介质体积比。经过3次重复试验,由图2可知,随着梯度介质体积的提高,电转化效率不断提高,当两者体积比为1∶5时,电转化效率达到3.6×109 CFU/μg DNA,而后再增加梯度介质体积,电转化效率趋于平缓。
电转化效率的高低关键在于是否制备出低盐浓度的感受态细胞和DNA片段,一般所制备的DNA片段经纯化后盐浓度都很低,所以电转化效率主要取决于感受态细胞中盐离子的含量。感受态细胞中盐成分去除不净,在电击时瞬时的高压会产生电弧导致细胞大量死亡[12]。通过减少菌液的体积增加梯度介质体积,梯度离心结束后实现了细胞与盐分的有效分离,进而降低了感受态细胞中盐离子的含量,从而减弱盐离子对电转化试验的干扰。
2.4 电场强度对电转化效率的影响
电场强度一直被认为是影响电转化效率的重要因素[18],同时,重悬液由去离子水转变成20%甘油/1.5%甘露醇溶液,重悬液的改变是否也会影响电场强度对电转化效率的影响,也需要进一步研究。为了探索电场强度大小以及重悬液的改变对电转化效率的影响,分别采用不同重悬液重悬细胞在不同的电场强度下进行电击试验。经过3次重复试验,结果表明,随着电场强度的提高,电转化效率随之提高,当以去离子水重悬细胞,电场强度在13 kV/cm时,电转化效率最高,达2.3×109 CFU/μg DNA,而当以20%甘油/1.5%甘露醇溶液重悬细胞,电场强度在15 kV/cm时,电转化效率最高,达4.2×109CFU/μg DNA,随后電转化效率急剧降低(图3)。
在进行电转化试验时,经高电场强度电击后本身大量的细胞会死亡,只有少部分细胞存活下来,而携带了外源核酸片段的细胞存活下来的数量更少,在寻找到最适宜的电场强度后,再进一步增加电场强度反而会导致细胞大量死亡,电转化效率急剧降低。同时,电击缓冲液由20%甘油/1.5%甘露醇溶液代替去离子水时,在不同电场强度条件下的电转化效率均有一定程度的提高,使得最适宜的电场强度由13 kV/cm变为15 kV/cm。
2.5 温度对电转化效率的影响
在制备电转化细胞及电转化试验过程中通常温度要保持在0~4 ℃[12],也有不少研究认为室温甚至更高温度进行电转化试验相比于低温其效率反而更高[19]。因此,为了进一步探究温度对电转化效率的影响,探索出更加简便的电转化试验方案,本研究进行了3次重复试验。由表3可知,在不同温度梯度下进行电转化感受态细胞的制备以及电击试验,随着温度的提高,电转化效率急剧降低,当温度为37 ℃时,其电转化效率仅为7.3×107 CFU/μg DNA,而当温度保持在0~4 ℃时,其电转化效率可达 3.9×109 CFU/μg DNA,即0~4 ℃时的电转化效率比37 ℃时提高了约52倍。
电转化效率的提高意味着外源DNA进入更多的细胞,同时在电击结束后有更多的细胞存活下来。在制备电转化细胞时,需要使用预冷的去离子水洗涤细胞以去除培养基和导电溶质,所有的设备都需要提前预冷,而且整个操作过程需要保持低温环境,具体的机理目前尚不清楚,可能的原因是保持低温环境影响细胞膜的结构,使细胞壁与细胞膜的脆性增加,瞬时的高电压更容易在细胞表面形成局部的瞬态孔隙[7],使得外源DNA更容易渗透到细胞内部。但也有一些菌株在进行电转化试验时需要保持室温甚至更高温度,其观点为细胞经多次低温洗涤离心后,细胞结构会受到一定破坏[12],不利于细胞的存活,经低温制备出的感受态细胞更容易收缩,从而降低了细胞膜的流动性与通透性,瞬时的高电压在细胞表面形成局部的瞬态孔隙减少,外源DNA反而不容易渗透到细胞内部,而温度的提高能够增加细胞膜的流动性,外源DNA更容易进入细胞。但通过对大肠杆菌DH5α进行多次反复的试验验证,发现随着电转化试验过程中的温度提高,电转化效率反而急剧降低。也有许多类似研究认为以一般的大肠杆菌菌株进行电转化试验,整个试验操作最好保持低温操作才能保证较高的电转化效率[12,20]。
3 小结
本研究分别对密度梯度离心技术及影响大肠杆菌电转化效率的因素进行探索。首先,通过对梯度介质进行分析选择,并对梯度介质浓度及菌悬液与梯度介质之间的体积比关系进行研究。利用15 mL离心管代替50 mL离心管,探索出一种类似于密度梯度离心法且适用于角转子离心机的离心方法,使用角转子离心机实现细胞与盐分的有效分离,整个电转化试验仅需2步离心,省去了常规方法的多步洗涤离心除盐,简化了电转化试验步骤。其次,在确定好离心技术的同时进一步探究影响电转化效率的因素——渗透溶液的浓度、梯度介质体积、电场强度以及电转化试验过程的温度等。研究发现,菌悬液与脱盐梯度介质比例为1∶5时,使用20%甘油/1.5%的甘露醇作为渗透溶液重悬细胞,在电场强度为 15 kV/cm下进行电击,且制备电转化感受态细胞及电转化过程中温度维持在0~4℃,最终所制备的感受态细胞电转化效率达4.2×109 CFU/μg DNA,较传统方法电转化效率提高的同时也大大缩短了试验时间,为以后的分子试验打下了坚实的基础。
参考文献:
[1] ITOH N, KOUZAI T,KOIDE Y. Efficient transformation of Pseudomonas strains with pNI vectors by electroporation[J]. Bioscience biotechnology & biochemistry, 1994, 58(7):1306-1308.
[2] MURPHY K C. Use of bacteriophage λ recombination functions to promote gene replacement in Escherichia coli[J]. Journal of bacteriology, 1998, 180(8):2063-2071.
[3] WANG Y,WEI D, ZHU X, et al. A ‘suicide CRISPR-Cas9 system to promote gene deletion and restoration by electroporation in Cryptococcus neoformans[J]. Scientific reports, 2016, 6(1):31145.
[4] HANANAN D. Studies on transformation of Escherichia coli with plasmids[J]. Journal of molecular biology, 1983, 166(4):557-580.
[5] INOUE H,NOJIMA H,OKAYAMA H. High efficiency transformation of Escherichia coli with plasmids[J]. Gene,1990,96(1):23-28.
[6] 冯建成,牛 成,邢 旭, 等.大肠杆菌HB101感受态细胞制备条件的优化[J]. 热带生物学报, 2010, 1(3):224-227.
[7] AUNE T E V,AACHMANN F L. Methodologies to increase the transformation efficiencies and the range of bacteria that can be transformed[J]. Applied microbiology and biotechnology,2010,85(5):1301-1313.
[8] 朱森康,黄 磊,李燕飞,等. 制备高效大肠杆菌电转化感受态细胞和电转化条件的研究[J]. 生物技术通报,2011(10):206-209.
[9] WARREN D J. Preparation of highly efficient electrocompetent Escherichia coli using glycerol/mannitol density step centrifugation[J].Analytical biochemistry, 2011, 413(2):206-207.
[10] TU Q, YIN J, FU J, et al. Room temperature electrocompetent bacterial cells improve DNA transformation and recombineering efficiency[J]. Scientific reports, 2016, 6(1):24648.
[11] VOLK A, K?HLER C J. Density model for aqueous glycerol solutions[J]. Experiments in fluids,2018,59(5):1-4.
[12] EGUSA G, BRADY D W, GRUNDY S M, et al. Isopropanol precipitation method for the determination of apolipoprotein B specific activity and plasma concentrations during metabolic studies of very low density lipoprotein and low density lipoprotein apolipoprotein B[J]. Journal of lipid research,1983, 24(9):1261-1267.
[13] SLATER T,BEESLEY J, FLATMAN A, et al. Preparation of suspensions of human cervical epithelial-cells suitable for biochemical, cytochemical and immunocytochemical investigations[J]. International journal of oncology, 1993, 2(2):233-236.
[14] HAKAN P. Fractionation of cells and subcellular particles with Percoll[J]. Journal of biochemical and biophysical methods,2000,44(1-2):1-30.
[15] XUE G P, JOHNSON J S, DALRYMPLE B P. High osmolarity improves the electro-transformation efficiency of the gram-positive bacteria Bacillus subtilis and Bacillus licheniformis[J]. Journal of microbiological methods, 1999, 34(3):183-191.
[16] 北婷婷,李 晨,谷新晰, 等. 鼠李糖乳桿菌电转化条件的研究[J].中国食品学报, 2017, 17(4):65-71.
[17] CHRIS G,DI V D,SUSMITA S,et al. Techniques used for the isolation and characterization of extracellular vesicles: Results of a worldwide survey[J]. Journal of extracelluler vesicles,2016,5(1):32945.
[18] CHEN D Q, HUANG S S, LU Y J. Efficient transformation of Legionella pneumophila by high-voltage electroporation[J]. Microbiological research, 2006, 161(3):246-251.
[19] WARDS B J, COLLINS D M. Electroporation at elevated temperatures substantially improves transformation efficiency of slow-growing mycobacteria[J]. Fems microbiology letters,1996,145(1):101-105.
[20] ANTONOV P A, MAXIMOVA V A, PANCHEVA R P. Heat shock and osmotically dependent steps by DNA uptake after Escherichia coli electroporation[J]. Biochimica et biophysica acta (BBA)- gene structure and expression,1993,1216(2):286-288.
