13种多酚类异构体的超高效液相色谱-四级杆串联飞行时间质谱分析
2020-11-09贺光云邱世婷张思林
贺光云, 侯 雪*, 韩 梅, 邱世婷, 李 莹, 张思林, 陈 西
[1. 四川省农业科学院 分析测试中心,四川 成都 610066; 2. 农业农村部农产品质量安全风险评估实验室(成都),四川 成都 610066;3. 绵阳市农畜产品质量安全检验检测中心,四川 绵阳 621000; 4. SCIEX中国,上海 200335]
多酚类化合物是多羟基酚类化合物及其衍生物的总称,是一类结构复杂的次生代谢产物,广泛分布于多种植物的皮、根、叶、果中,如茶多酚、苹果多酚、葡萄多酚、石榴皮多酚等[1]。茶多酚(TP, Tea polyphenols)又名茶鞣质,主要包括儿茶素、黄酮、花青素和酚酸四类约三十多种[3],具有抗氧化、抗衰老、降血脂、防癌抗癌、抗骨质疏松、抗炎抑菌、抗放射损伤以及减肥等生理功效和药理作用[2-3]。茶多酚是茶叶中的主要功能成分,是茶中苦味、涩味和色泽的重要来源,是评价茶叶品质的重要指标,其在茶叶中的含量较高,约占干物质总量的15%以上,有的品种甚至高达40%[4]。茶叶中茶多酚的快速筛查及定量分析对茶叶的品质鉴定具有重要作用。
多酚类化合物结构复杂,部分化合物具有多个构造异构或手性异构体。这些异构体通常结构相近、理化性质相似,尤其是官能团位置异构和立体异构体,在色谱中往往具有相同的保留时间,在质谱中产生相同的母离子甚至相同的子离子,通常很难对其进行有效的分离鉴定[5--6]。大量的同分异构体分析物是色谱分析中的巨大挑战,因此研究同分异构体的分离分析具有重要意义。有关同分异构体的分离研究中,采用超临界流体色谱法[7]、手性色谱柱[8]、高速逆流色谱[9]、离子淌度质谱[10]以及借助各种新型材料[11-12]的研究较多,而通过普通液相色谱进行异构体,尤其是多酚类化合物异构体的研究则鲜有报道。绿原酸类物质广泛存在于茶叶、咖啡、金银花及枸杞叶等植物中,具有抗氧化、抗炎症、抗痉挛、抗病毒及抑制致癌物质诱变等功效[13],近年来广受研究人员关注。董珊等[14]建立了同时测定茶叶、枸杞叶、地瓜叶、咖啡、金银花中新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A和异绿原酸C含量的高效液相色谱法,采用Agilent Eclipse XDB-C18色谱柱,乙腈-0.1%甲酸溶液流动相,梯度洗脱。易小丽等[15]采用高效液相色谱法测定烟叶中的绿原酸及其异构体,以Diamonsil plus C18色谱柱为固定相,甲醇和乙酸/水(1/99)为流动相,经梯度洗脱使绿原酸及其异构体得到分离,并采用紫外检测器对其含量进行检测。吴国利等[16]建立了同时测定植物饮料中7种绿原酸单体含量的高效液相色谱法,采用乙腈-三氟乙酸-水作为流动相,通过梯度洗脱,将7种单体进行分离。以上研究大多是对单组异构体的分析检测,而对多个异构体同时分析的研究报道较为少见。
本课题组多年来致力于茶叶的营养成分和质量安全风险评估研究。本研究在课题组前期研究工作基础上[17-18],建立了多个多酚类异构体(Chart 1)的UPLC-QTOF-MS分析方法。采用Kinetex 2.6μm Biphenyl色谱柱,流动相A为0.1%甲酸水溶液,B为甲醇/乙腈(30/70),通过梯度洗脱程序,在负离子模式下进行全扫描,实现了多个酚类异构体的有效色谱分离及高分辨质谱分析。并将建立的UPLC-QTOF分析方法应用于桑叶茶和3种绿茶中该类多酚类化合物的筛查,检测到绿原酸及其异构体和山奈酚-3-O-葡萄糖醛酸苷等7种组分。该方法涉及异构体5组共13个,A组:木犀草素(A1)、山奈酚(A2)、漆黄素(A3), B组:樱花素(B1)和异樱花素(B2), C组:隐绿原酸(C1)、新绿原酸(C2)、绿原酸(C3),C组:山萘酚-7-O-葡萄糖苷(D1)、山奈酚-3-O-葡萄糖醛酸苷(D2)、木犀草素-7-O-葡萄糖苷(D3), D组:橙皮甙(E1)和新橙皮苷(E21)。该方法也可用于茶多酚等植物多酚或有机合成多酚类化合物的快速筛查及定性定量分析。
1 实验部分
1.1 仪器与试剂
Nexera X2型超高效液相色谱仪,日本岛津公司;SCIEX TripleTOF© 5600高分辨质谱系统,美国SCIEX公司;WH-3微型涡旋混合仪,上海路西分析仪器有限公司。
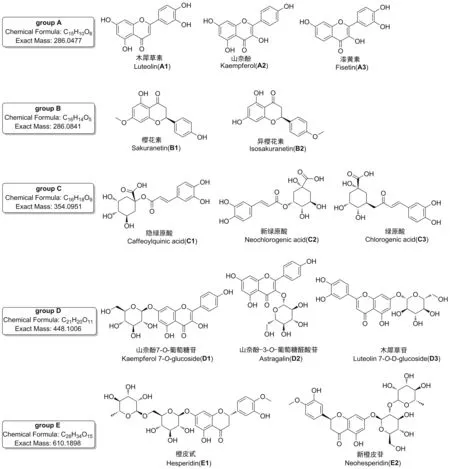
Chart 1
13种多酚类标准物质,PhytoLab GmbH & Co. KG;甲醇、乙腈和甲酸均为色谱纯,美国Fisher Scientific公司;绿茶样品,四川省文君茶叶有限公司和四川省花秋茶业有限公司;绿脉牌桑叶茶,成都世煌生物科技有限责任公司。
1.2 标准溶液的配制
标准储备液的配制:分别准确称取多酚标准品,用甲醇溶解配制浓度为400 mg·L-1的标准储备液,于-18 ℃储存。
混合标准储备液的配制:准确量取储备液各1.0 mL,用甲醇稀释定容至50 mL,配制8.0 mg·L-1的混合标准工作液,于-18 ℃下保存,备用。
上机样品:取混合标准储备液50 μL,加入10%甲醇水溶液950 μL稀释为0.4 mg·L-1,过0.22 μm膜上机。
1.3 样品提取
称取一定量茶叶(桑叶茶:一袋2.0 g, 3种绿茶各2.0 g),分别置于500 mL烧瓶中,加入300 mL沸水,浸泡30 min;倾倒出上清液,再加入300 mL沸水浸泡,重复提取3次。合并提取液,取1 mL茶汤过0.22 μm膜上机检测。
1.4 仪器条件
色谱条件: Kinetex 2.6 μm Biphenyl色谱柱(2.1 mm×100 mm, 100 Å);流动相:A为0.1%甲酸水溶液,B为甲醇/乙腈(30/70);流速:0.45 mL·min-1;进样量:5 μL;柱温:45 ℃。梯度洗脱程序为:0~5 min, 5%B; 5~7 min, 5%B→25%B; 7~14min, 25%B→50%B; 14~15 min, 50%B→90%B; 16.1~18 min, 5%B。
实验数据采用Analyst 1.7.1和Peak View 2.2软件进行处理。
2 结果与讨论
2.1 色谱柱的选择
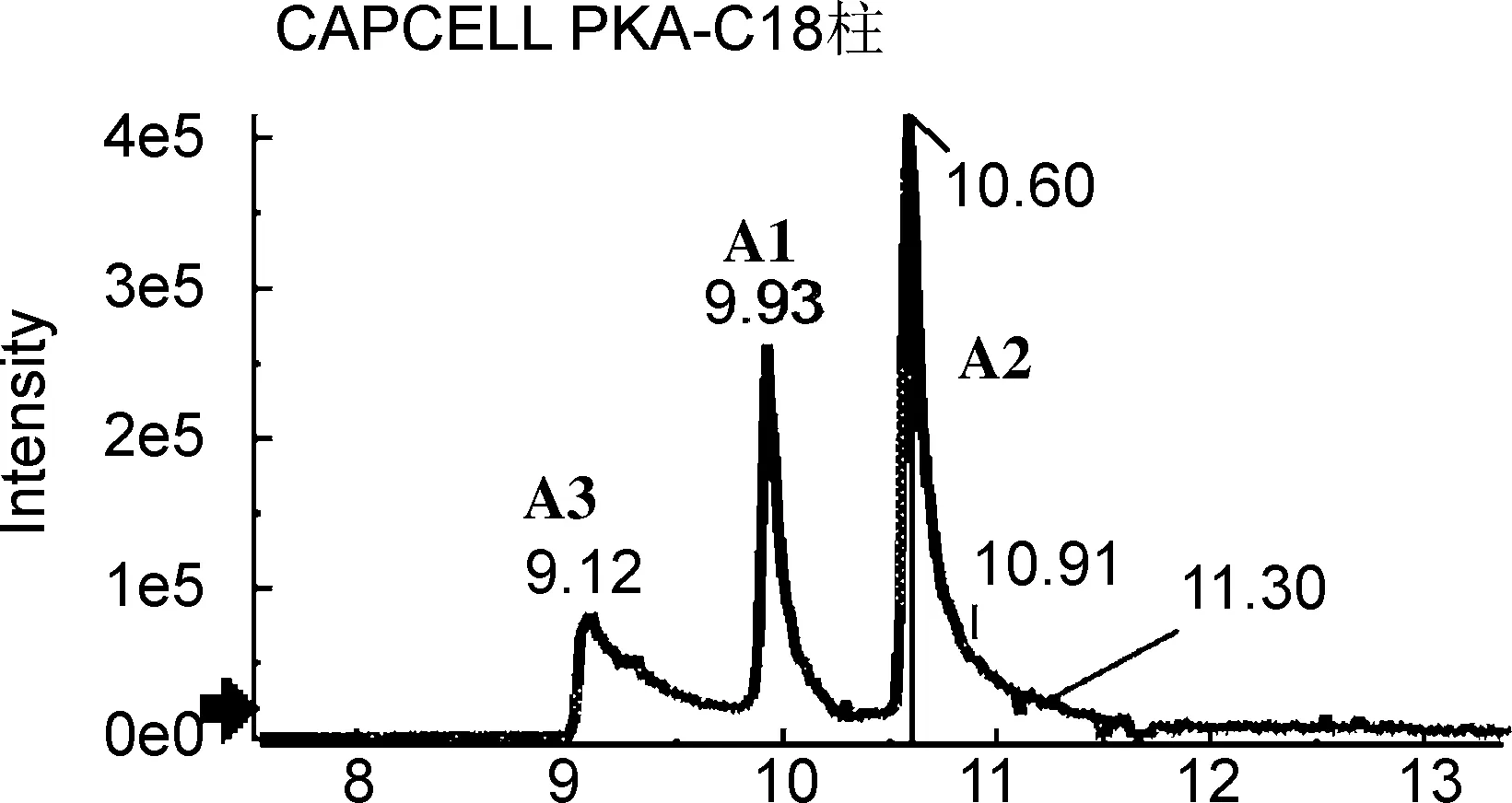
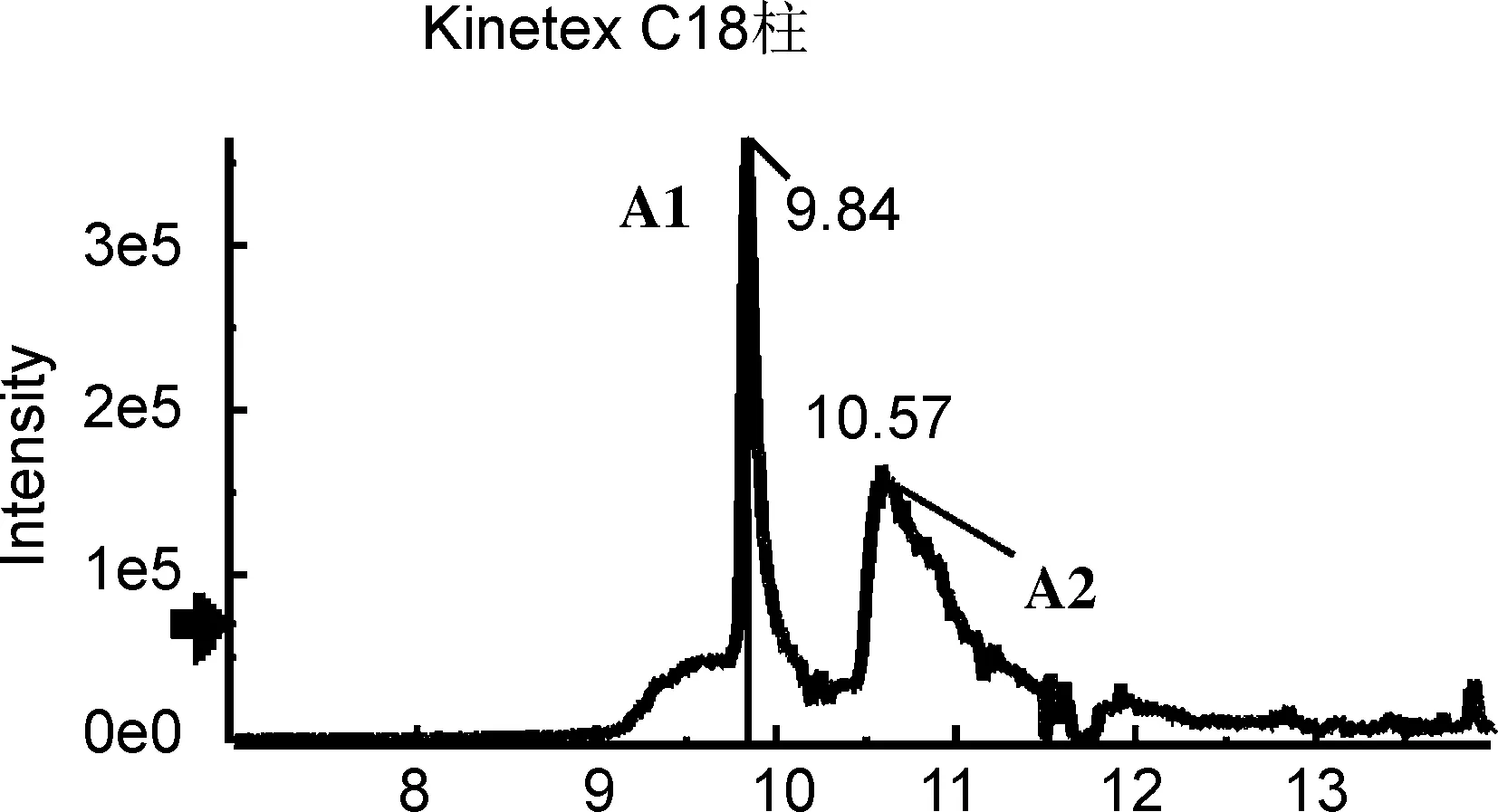
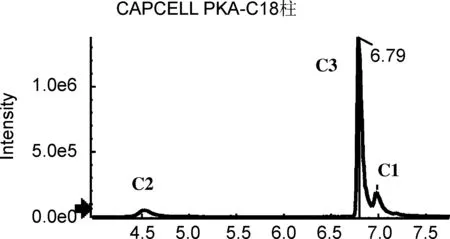
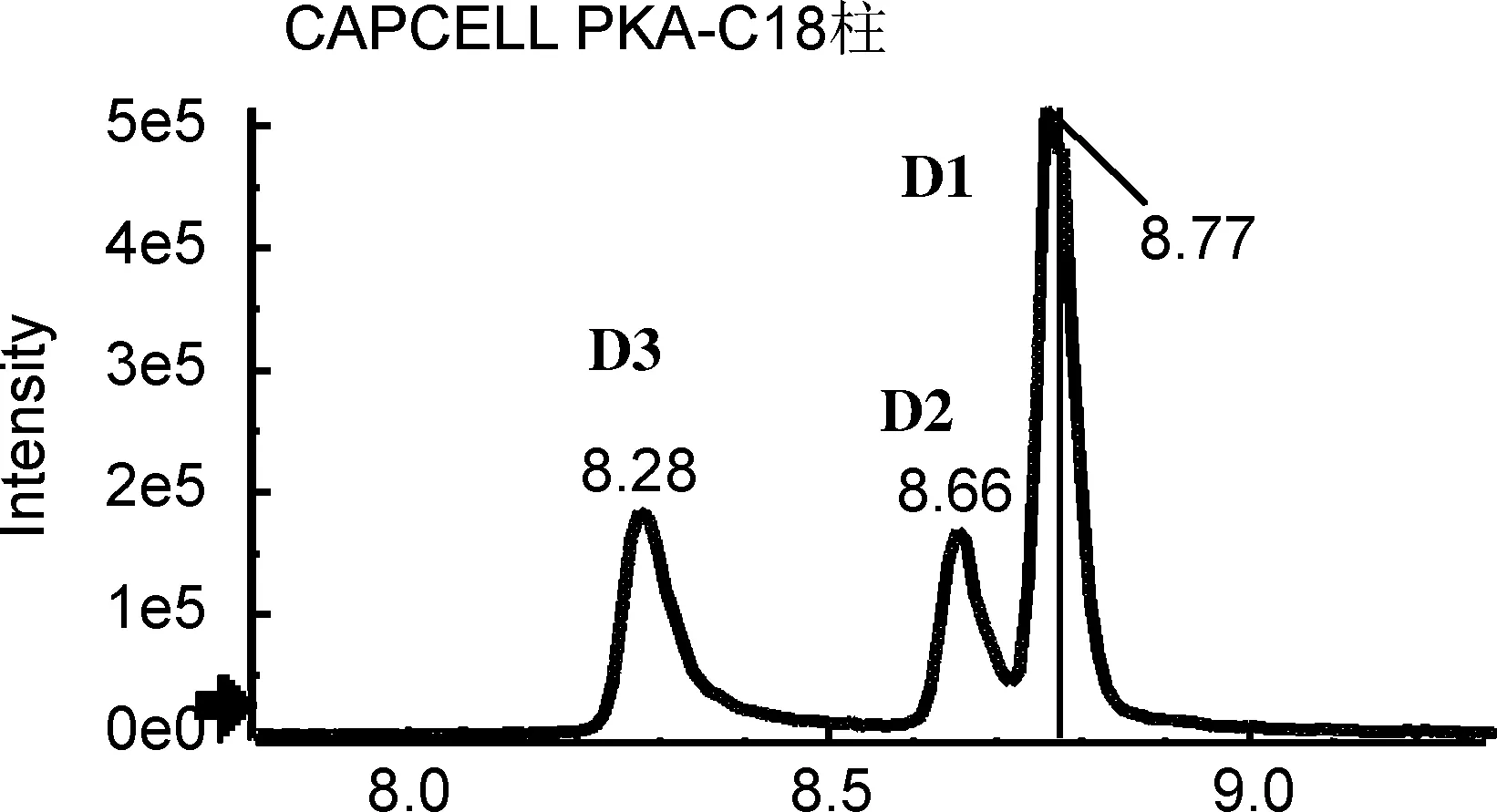
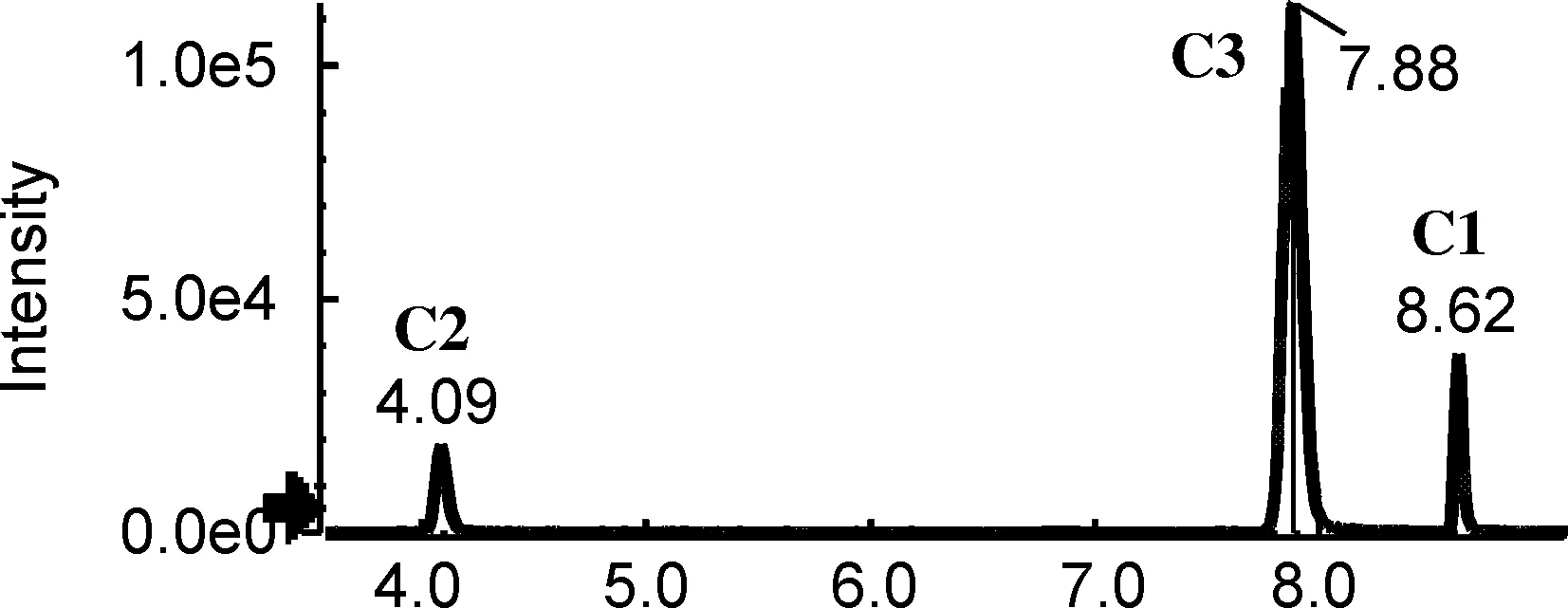
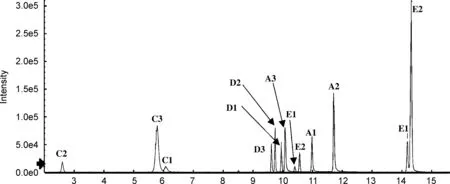
为获得对多组异构体的最佳分离条件,分别考察不同色谱柱的分离性能,包括Shim-pack XR-ODS Ⅲ柱(2.0 mm×150 mm, 2.2 μm,柱-1)、 CAPCELL PKA-C18柱(2.1 mm×100 mm, 2 μm,柱-2)、 Acquity UPLC BEH C18柱(2.1 mm×100 mm, 1.7μm,柱-3)、 Kinetex C18柱(2.1 mm×100 mm, 100 Å,柱-4)和Kinetex Biphenyl(2.6 μm)柱(2.1 mm×100 mm, 100 Å,柱-5),提取离子流色谱图分别见图1~图4。
Time/min
Time/min图1不同色谱柱对A组异构体的提取离子流色谱图
由图1~图4可以看出,在柱-1~4上,5组异构体均未能同时实现有效分离。A组、C组和D组异构体在柱-2上分离效果较好,但B组和E组异构体未达到基线分离。在柱-3上,A组、C组和E组异构体分离较好,而B组几乎无分离,D组中D2和D3也未达到基线分离。柱-4分离效果更差,A组异构体色谱峰拖尾严重,C组和D组均未达到良好分离。对于该类多酚类异构体来说,最不适宜的是柱-1,分离效果差,且部分组分未能检测到信号峰。

Time/min
研究还发现,对于文中涉及的多酚类异构体,分离效果较好的是柱-3和柱-5。值得一提的是,对于C组,即绿原酸组异构体和E组橙皮苷异构体的分离,柱-3是最佳选择,其响应高、峰型好,而且异构体的保留时间差异较大(图5),分离效果较柱-5更胜一筹。因此,针对分析物中绿原酸类和橙皮苷类异构体的分析研究可优先选择柱-3。而对于B组异构体樱花素和异樱花素,除柱-5外,在其他4根色谱柱,即使调节流动相配比及酸碱、以及优化梯度均不能实现有效分离,因此对该组异构体的分析柱-5是最佳选择。
Time/min
不同色谱柱分离效果的差异主要是由于色谱柱固定相与待测物保留特征不同。普通C18柱和待测物间主要靠疏水作用而获得保留,单一的疏水作用机制使其对强极性样品,如芳香酸类物质的保留时间过短,导致分离效果不理想;而苯基柱中,固定相和待测物间不仅具有疏水作用,还有π-π电子作用,对于具有共轭体系的化合物来说,选择性更强[19]。
Time,min
综上所述,最适于本文考察的5类异构体同时分离检测的是Kinetex Biphenyl柱(柱-5),图6为其提取离子流图。可以看出,虽然该色谱柱对绿原酸的分离不够理想,但足以实现定性和定量分析。此外,由于隐绿原酸和绿原酸的二级特征离子不同,分别为m/z135.0450和m/z85.0292,采用二级离子进行定量,可完全排除色谱峰不完全分离对定量分析造成的影响。因此,本研究选择Kinetex Biphenyl色谱柱进行下一步实验。
Time,min
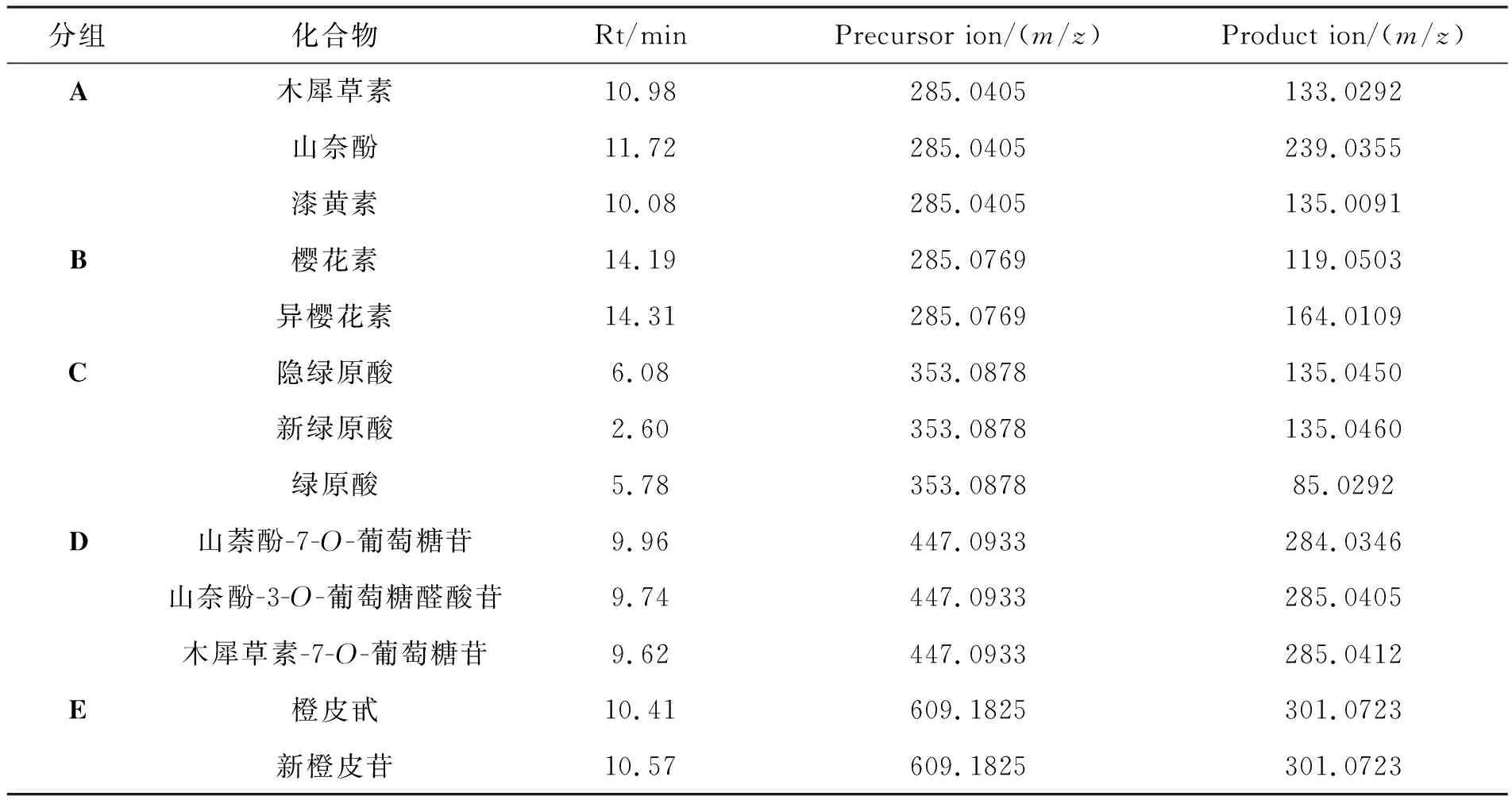
表 1 13种多酚的保留时间及质谱参数
2.2 流动相的优化
采用Kinetex Biphenyl色谱柱,进一步考察不同流动相体系对样品分离及质谱响应信号的影响。首先考察水相,以甲醇为有机相,分别以0.1%氨水溶液、纯水和0.1%甲酸为水相。一般情况下负离子模式下采用纯水或氨水溶液作为流动相,有助于待测物的电离[20]。而实验结果表明,水相为0.1%氨水溶液或纯水时,色谱分离不好,峰型较差,有明显的拖尾现象,质谱响应信号也较弱。甲酸由于提供氢离子,一般会抑制负离子化合物的电离,但经实验发现,选择0.1%甲酸作为水相时,峰型拖尾现象得到明显改善,分离度得到提高,因此本实验以0.1%甲酸为水相。
在此基础上,进一步考察有机相的影响,分别以甲醇、乙腈以及不同配比的甲醇/乙腈体系为有机相。实验结果显示,甲醇体系有利于樱花素和异樱花素(B组)的分离,由于樱花素和异樱花素结构极其相似,而甲醇可增加樱花素和异樱花素在苯基固定相的π-π电子作用,致使两者在固定相上保留时间不同,从而被分离[19]。而乙腈体系有助于分离橙皮苷和新橙皮苷(E组),但甲醇和乙腈体系均无法使研究的5对异构体达到同时分离的效果。异构体在质谱中常常产生相同的分子离子峰,甚至由此产生的子离子也相同,如B组异构体中的隐绿原酸和新绿原酸,在质谱中产生相同的特征碎片离子m/z135.0450, B组异构体中三个化合物的子离子均为m/z285.0405, D组异构体橙皮甙和新橙皮苷的子离子峰同为m/z301.0723。进一步,为了实现在质谱分析中多种组分同时检测,考察混合有机体系甲醇/乙腈不同配比(V/V, 70/30、 60/40、 50/50及30/70)的分离效果。结果表明,以甲醇/乙腈(V/V=30/70)为有机相时,通过梯度洗脱程序可实现5组异构体的同时分离,保留时间及质谱参数见表1。
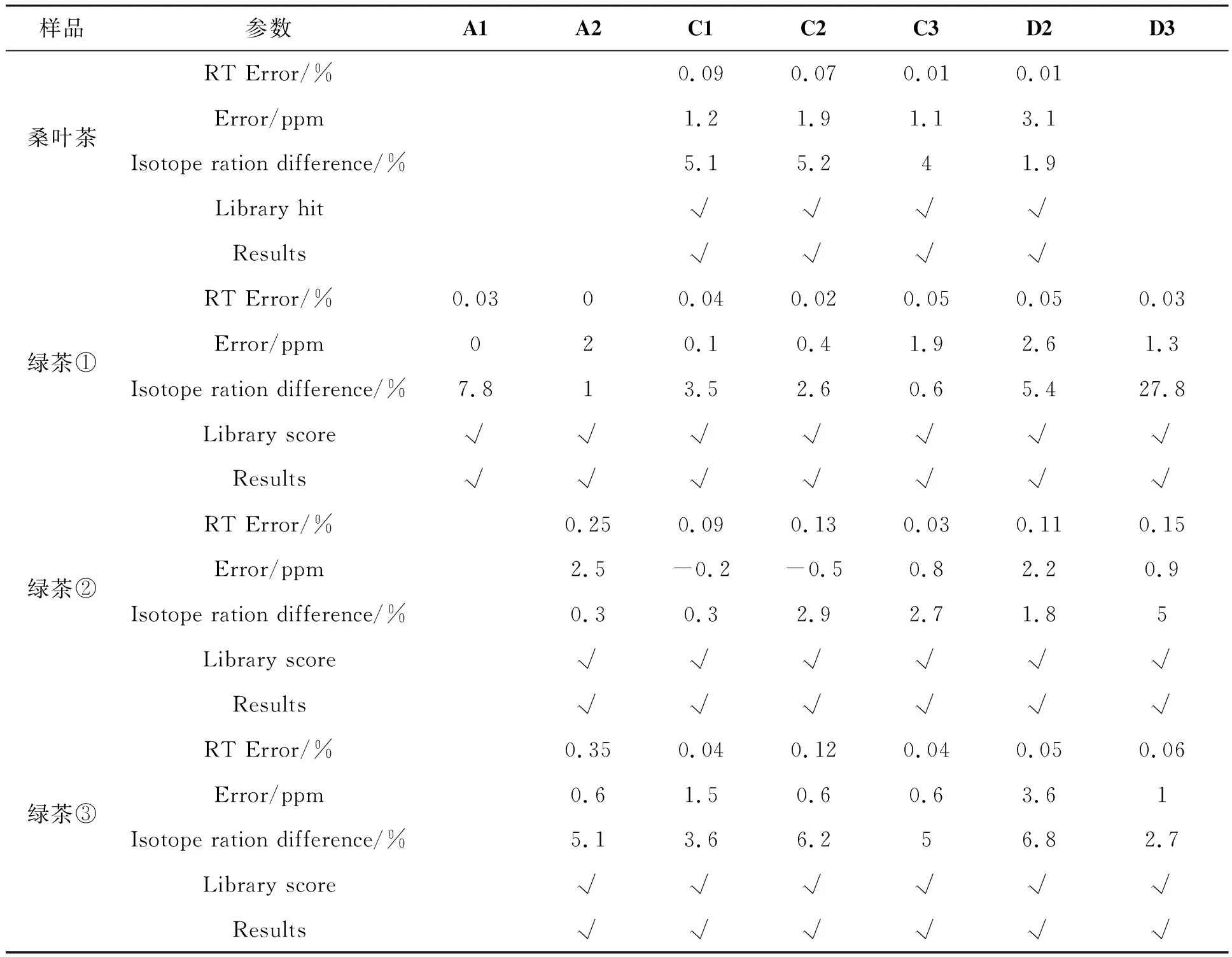
表 2 筛查结果判定汇总表
2.3 方法应用
采用建立的UPLC-QTOF分析方法分别对桑叶茶和绿茶进行筛查分析,结果见表2。根据母离子的精确质量数、保留时间、同位素分布匹配指数以及数据库匹配情况进行判断。设定母离子精确质量数的允许偏差范围<5 ppm,保留时间偏差范围<10%,同位素分布匹配指数>80,数据库匹配得分>70,判定为阳性样品。
由表2可以看出,在13种目标多酚中,共筛查到7种成分,即A1、A2、C1~C3、D2和D3,其中,桑叶茶中显示有C1、C2、C3和D2的存在。3种绿茶筛查结果相近,绿茶①检测到目标成分最多,为7种,其余两种绿茶筛查结果相同,共检测到6种目标多酚。可以看出,绿原酸及其异构体和山奈酚-3-O-葡萄糖醛酸苷广泛存在于测试茶叶中,与文献报道一致[3]。
建立了5组多酚类异构体的UPLC-QTOF-MS分析方法。最优色谱条件为:采用Kinetex 2.6 μm Biphenyl色谱柱,以0.1%甲酸水溶液(V/V)-甲醇/乙腈(V/V=30/70)为流动相,梯度洗脱,在负离子模式下进行全扫描采集。该研究涉及山奈酚、樱花素、绿原酸、橙皮甙及其异构体共13种化合物。将建立的UPLC-QTOF-MS分析方法应用于桑叶茶和3种绿茶中该类多酚类化合物的筛查,结果显示绿原酸及其异构体和山奈酚-3-O-葡萄糖醛酸苷在绿茶中的广泛存在。该方法还可用于其它植物多酚或合成多酚类化合物的快速筛查及定性定量分析,具有较好的实用价值。
