骨肉瘤干细胞来源外泌体对T细胞增殖及分化的影响
2020-11-09陈思历杨洪彬
陈思历杨洪彬*
(1.西南医科大学附属医院骨科,四川泸州 646000; 2.四川现代医院骨科,成都 610041)
骨肉瘤是最常见的原发恶性骨肿瘤之一,约占原发性恶性骨肿瘤的1/3,其好发于儿童和青少年的长骨干骺端。骨肉瘤的恶性程度极高,早期即可转移,研究报道约15%~20%的患者在首次出现症状时就已发生了远端转移[1-3]。目前临床上针对骨肉瘤的治疗方法包括手术和化疗的联合治疗,但该方法对已发生了转移的骨肉瘤患者效果不佳且仍有部分患者在治疗后发生肿瘤的复发或远处转移[4]。
肿瘤干细胞(cancer stem cells,CSCs)被认为是肿瘤组织中一小部分具有干细胞自我更新与分化潜能的细胞亚群[5]。CSCs 的存在是导致肿瘤转移及复发的关键因素,这一方面因为CSCs 所具有的的干细胞特性能够无限增殖,并通过干细胞标志物如Sox-2、Snail 等促进上皮间质转化,诱导新生血管形成和招募基质细胞等促进肿瘤细胞的增殖及侵袭;另一方面CSCs 通过与其微环境中其他细胞之间相互作用可分泌多种可溶性因子介导免疫抑制,使肿瘤细胞逃脱机体的免疫监控,进而免于受到免疫攻击[6]。因此,针对CSCs 及其微环境的深入研究,对探寻潜在治疗靶点有望解决骨肉瘤早期转移及治疗后复发的难题。
外泌体(exosomes)是由细胞分泌的直径约为30~100 nm 的膜性囊泡,其广泛存在于多种体液中。研究发现外泌体内包含母体细胞的蛋白(如CD9、CD63、Hsp70 等 )、DNA、mRNA/miRNA/lncRNA、脂类等多种生物活性成分,故其能够参与调节肿瘤微环境的形成并在肿瘤细胞的增殖、免疫逃逸及播散转移等过程中发挥着重要的作用[7]。而CSCs 作为恶性肿瘤的种子细胞,对其外泌体的研究尚鲜有报道。基于此,本文重点探讨骨肉瘤干细胞来源的外泌体是否影响T 细胞的增殖及分化,并初步探究其相关分子机制。现将结果报告如下。
1 材料和方法
1.1 实验材料
人骨肉瘤细胞株 MG-63、HOS、U20S、MGHOS均购自中国科学院细胞库。人外周血由健康志愿者提供。所有志愿者已签署知情同意书。
1.2 主要试剂
DMEM/F12、RPMI1640、0.25%胰蛋白酶(美国Hyclone 公司,批号 8112347、1184655、210175K);胎牛血清(FBS)、青链霉素混合液(均为100 U/mL)(杭州四季青生物公司,批号098N0261、023M755);干细胞无血清培养基(加拿大Stemcell 公司,批号30984);RIPA 裂解液、BCA 蛋白定量试剂盒(美国Invitrogen 公司,批号 5571043、044623K);羧基荧光素乙酰乙酸琥珀酰亚胺酯(CFSE)荧光染色(上海麦克林公司,批号 0122763);OKT3、anti-IL-4、anti-INF-γ、bFGF、EGF、LIF(美国 BioXcell 公司,批号115848179010、044617K、052723K、c10649、c224616、c779012);IL-2、IL-12、TGF-β(美国 R&D 公司,批号309316、373528、3136477);CD133/CD3/CD4 细胞磁珠分离试剂盒、MACS 缓冲液、磁力架、磁珠分选柱(德国美天旎公司,批号1045032549、2470848672、MB07512、MB24403);流式抗体 FITC-CD133 mAb(美国 eBioscience 公司,批号 E0947-712);FITCCD3 mAb、PE-CD8 mAb、APC-CD4 mAb、Percpcy5.5- INF-γ mAb、FITC-Foxp3 mAb、PE-cy7-IL-17 mAb (美国 Biolegend 公司,批号 024137K、277S016、5527190、320186K、077243S,033157K);抗人 T 细胞表面CD3(OKT3)单克隆抗体(美国BD Bioscienc 公司,批号 MS-0253L5);ERK、p-ERK、p-STAT1、p-STAT3、p-STAT5、GAPDH、CD63 抗体(美国 Santa Cruz 公司,批号 SC-6641、SC-027、SC-17855-R、SC-02249、SC-44975、SC-559、SC-5227);其他试剂为国产分析纯。
1.3 实验方法
1.3.1 肿瘤干细胞球的培养及流式鉴定
常规复苏骨肉瘤细胞系 MG-63、HOS、U20S、MGHOS 后使用含10% FBS、1%青链霉素的DMEM/F12 培养基于37℃、5% CO2恒温培养箱进行培养。待细胞生长融合至70%~80%时用0.25%的胰酶进行消化,室温下 800 r/min 离心 5 min,弃上清,DMEM/F12 重悬细胞后进行传代。取处于对数生长期的 MG-63、HOS、U20S、MGHOS 细胞,常规进行消化后,PBS 调整细胞密度至1×105个/孔接种至低粘附细胞培板中,使用含20 ng/mL bFGF、10 ng/mL EGF 与 10 ng/mL LIF 的无血清 DMEM/F12 培养基于37℃、5% CO2恒温培养箱中进行培养。经无血清培养基培养10 d 后于显微镜下观察到骨肉瘤细胞系可形成典型的悬浮生长骨肉瘤干细胞球,拍照并计数。取无血清培养的骨肉瘤细胞系 MG-63、HOS、U20S、MGHOS,培养至第 10 天时收集细胞,室温下300 r/min 离心5 min,取细胞沉淀用PBS 调整至细胞密度为每毫升1×105个,取2 mL 细胞悬液至流式管中,室温下300 r/min 离心5 min,弃上清后,加入100 μL 的 PBS 重悬细胞后,加入抗人 FITCCD133 mAb 抗体,4℃避光孵育30 min,PBS 洗涤细胞2 次,800 r/min 离心10 min,弃上清,500 mL PBS重悬细胞后,0.22 μm 滤膜过滤后采用流式细胞仪检测上述培养的肿瘤干细胞球中CD133+细胞(即骨肉瘤干细胞)所占比例。
1.3.2 分离外周血单个核细胞(PBMC)
采用Ficoll 密度梯度离心法分离PBMC,简述如下:将收集的健康志愿者血液标本的抗凝采血管置于离心机中,常温下1500 r/min 离心10 min,取下层血细胞与等体积的PBS 混匀后缓慢匀速加至适量的淋巴细胞分离液面上,并使其形成界面。将上述得到的分层液体于室温下在缓升缓降的离心机中2320 r/min 离心20 min,使其分层,移液管小心吸出中间形成的“云雾层”细胞,并加入5 倍体积的PBS,室温下1500 r/min 离心10 min,底层白色沉淀即为分离所需的PBMC,PBS 洗涤细胞2 次进行纯化,并细胞计数。
1.3.3 免疫磁珠法分选 CD133+OSCs 与 CD4+T细胞
应用免疫磁珠阳选法分别进行分选CD133+MG-63 与CD4+T 细胞,操作参照试剂盒说明书进行,分别简述如下:①CD133+MG-63 的分选:取生长状态良好的MG-63 细胞球,4℃、1200 r/min 离心3 min,弃上清,PBS 重悬细胞后用移液管将细胞吹打成单细胞悬液,并计数。取 300 μL 约含 1×108个细胞的细胞悬液,并依次加入100 μL 的FcR 阻断剂与结合有CD133 单抗的免疫磁珠100 μL,充分混匀后于4℃避光孵育30 min,PBS 洗涤细胞3 次,4℃、1200 r/min 离心 3 min,弃上清,用 500 μL 的 PBS 重悬并制成单细胞悬液。按照试剂盒使用说明书进行组装磁力架及分选柱,MACS 缓冲液冲洗分选柱后加入细胞悬液进行分选。待分选结束后,将分选柱移出磁场,加压收集吸附于分选柱中的细胞,即为 CD133+MG-63 细胞。将收集的 CD133+MG-63 于干细胞无血清培养基中进行培养以备后续实验使用,该培养基用于可长时间培养干细胞,并支持细胞增殖且维持细胞的多能性。②CD4+T 细胞的分选:取生长状态良好的PBMC,按前述步骤制成单细胞悬液后,加入100 μL 的FcR 阻断剂与结合有CD4单抗的免疫磁珠100 μL,孵育、洗涤、离心并再次制备单细胞悬液后,组装磁力架及分选柱,按前述方法进行细胞分选,最后收集吸附于分选柱中的细胞,即为CD4+T 细胞。
1.3.4 骨肉瘤干细胞外泌体(OSCs-exo)提取及鉴定
取传至3 代后的 CD133+MG-63 骨肉瘤干细胞,待细胞生长达70%~80%时收集培养上清液。按照外泌体分离纯化试剂盒说明书方法进行提取细胞上清液中的外泌体,-80℃保存备用。取20 μL PBS 稀释2 μL OSCs-exo,3.5%的多聚甲醛固定后滴加到铜网上,乙酸双氧铀负染,透射电镜观察OSCs-exo 形态;用 950 μL PBS 稀释 50 μL 外泌体,0.22 μm 滤膜过滤外泌体稀释液后使用纳米粒度颗粒跟踪分析仪进行外泌体粒径检测;应用Western blot 实验检测OSCs-exo 表面特征性蛋白CD63 的表达。上述实验单独重复3 次。
1.3.5 T 细胞增殖检测
本研究采取CFSE 染色检测OSCs-exo 对T 细胞的增殖的影响,实验步骤简述如下:取上述分离纯化的PBMC 进行细胞计数后,调整细胞密度至每毫升 3×107个,加入终浓度为 10 μmol/L 的 CFSE 进行混匀,室温下避光孵育10 min,加入4℃预冷的10 mL 含10% FBS 的 RPMI-1640 的完全培养基终止反应,1000 r/min 离心5 min,取下层细胞沉淀用无血清的RPMI-1640 洗涤细胞2 次,1000 r/min 离心5 min,弃上清,用含10% FBS 的RPMI-1640 培养基重悬细胞,进行细胞计数后以备用,整个操作过程中注意避光。将CFSE 染色的PBMC 分为三组,分别为A 组:接种至预先用30 ng/mL OKT3 进行包被96 孔板中的PBMC,使用完全培养基进行培养;B组:接种至预先用30 ng/mL OKT3 进行包被96 孔板中的PBMC,并使用终浓度为10 μg/mL OSCs-exo 的完全培养基进行培养;C 组:接种至未使用OKT3 包被的96 孔板中,使用含10% FBS 的 RPMI-1640 的培养基进行培养的PBMC 为对照。3 组细胞置于37℃、5% CO2恒温培养箱中培养5 d,并于第3 天更换各组相应的培养基。收集3 组的PBMC,调整细胞密度至每毫升1×105个,取2 mL 细胞悬液至流式管,每管再分为3 份,按照上述流式细胞步骤加入抗人 FITC-CD3 mAb、APC-CD4 mAb、PE-CD8 mAb 抗体后进行检测 PBMC 中表达 CD3、CD4、CD8 阳性的细胞。上述实验单独重复3 次。
1.3.6 T 细胞分化检测
取上述免疫磁珠分离获得的CD4+T,接种至预先使用1 μg/mL OKT3 包被的48 孔板中,并将细胞密度调整至1×106个/孔。按照实验目的将加入10 μg/mL OSCs-exo 的CD4+T 设为实验组,对照组为不加OSCs-exo 培养的细胞,并分别加入含 Th1、Th2、Th17、Treg 诱导分化培养液(Th1 诱导条件:IL-12 15 ng/mL、IL-2 30 ng/mL、anti-IL-4 5000 ng/mL;Th2 诱导条件:IL-12 20 ng/mL、anti-CD28 2 μg/mL、anti-IL-4 10 ng/mL;Th17 诱导条件:IL-6 20 ng/mL、TGF-β 5 ng/mL、anti-IL-4 10 μg/mL、anti-INF-γ 10 μg/mL;Treg 诱导条件:TGF-β 15 ng/mL、IL-2 30 ng/mL、anti-INF-γ 10 μg/mL、anti-IL-4 5000 ng/mL)的DMEM/F12 培养基中,并置于37℃、5% CO2恒温培养箱中培养5 d,每3 天更换培养基一次。取经诱导分化的各组细胞,弃除原培养基后用含10 ng/mL PMA 与1000 ng/mL 离子霉素的DMEM/F12 于细胞培养箱中孵育5 h,按上述细胞流式实验步骤加入抗人 APC-CD4 mAb、Percp-cy5.5- INF-γ mAb、Percpcy5.5- IL-4、mAb FITC-Foxp3 mAb、PE-cy7-IL-17 mAb 后上机进行检测 Th1、Th2、Th17 及 Treg 细胞所占比例。上述实验单独重复3 次。
1.3.7 蛋白质免疫印迹
按照外泌体蛋白提取试剂盒说明方法进行提取OSCs-exo 中的蛋白质,BCA 法进行蛋白定量,按照1 ∶4向上清液中加入5×蛋白上样缓冲液,并于沸水中加热变性10 min。取30 μg 的蛋白进行聚丙烯酰胺凝胶(SDS-PAGE)电泳进行蛋白分离,采用湿转法将分离的蛋白转至PVDF 膜上,5%的脱脂牛奶于室温下封闭2 h 后,分别加入 p-STAT1(1 ∶500)、p-STAT3(1 ∶500)、p-STAT5(1 ∶500)、p-ERK(1 ∶800)、ERK(1 ∶800)、GAPDH(1 ∶2000)、CD63 (1 ∶1000)、Hsp70 (1 ∶1000)一抗,4℃摇床孵育过夜。TBST 溶液清洗3 次,每次5 min,以辣根酶标记的二抗(1 ∶5000)室温孵育 1 h,以 TBST 溶液清洗 3 次,每次5 min。最后均匀滴加ECL 发光液后于凝胶成像仪进行曝光拍照。Image J 软件测定条带灰度值,以目标蛋白与内参GAPDH 的比值作为其相对含量。上述实验单独重复3 次。
1.4 统计学方法
采用SPSS 19.0 和 GraphPad Prism 5.0 进行统计分析,数据结果以平均数±标准差(±s)表示。采用单因素方差分析(One-way ANOVA)进行多组间分析,两组间比较采用独立样本t检验。显著性检验水准 α = 0.05,P<0.05 为差异具有统计学意义。
2 结果
2.1 骨肉瘤干细胞球的形态、干性鉴定
采用无血清悬浮培养法获取OSCs,细胞悬浮成球实验结果显示在 4 株骨肉瘤细胞系 HOS、MGHOS、U20S、MG-63 中,MG-63 的细胞成球率显著高于其他三株细胞系。流式细胞术检测OSCs 标志物CD133 的实验结果表明,MG-63 细胞系中CD133的表达率(17.1%)明显高于其他三株细胞系,见图1A、1B。光镜下观察 MG63 细胞系分选出的 OSC,可见OSC 呈不规则球形,表面具有大量棘突伸出,见图1C。
2.2 OSCs-exo 的形态及鉴定
选取免疫磁珠分选的CD133+MG-63 OSCs 的外泌体进行观察。透射电子显微镜结果表明,外泌体呈圆形或椭圆形囊泡结构;粒径分析显示器直径约为30~100 nm;Western blot 实验检测外泌体标志性蛋白CD63、HSP70,结果显示在OSCs-exo 中均能高表达 CD63、HSP70。见图2。
2.3 OSCs-exo 抑制 T 细胞的增殖
流式细胞术检测OSCs-exo 对T 细胞增殖的影响,结果显示与对照组PBMC 相比,OKT3 可显著刺激 PBMC 中 T 细胞增殖(P<0.01),而 OSCs-exo 可显著抑制OKT3 刺激后PBMC 中T 细胞的增殖,包括 CD4+、CD8+的 T 细胞(P<0.05)。见图3。

图1 骨肉瘤干细胞取的形态及干性鉴定Figure 1 Morphological and phenotypic identification of osteosarcoma stem cells

图2 OSCs-exo 的形态结构及鉴定Figure 2 Morphological structure and identification of OSCs-exo
2.4 OSCs-exo 通过下调ERK 蛋白磷酸化抑制T细胞的增殖
Western blot 实验结果表明与对照组PBMC 相比,OKT3 刺激后PBMC 中ERK 蛋白的磷酸化水平显著升高(P<0.05),而OSCs-exo 可明显抑制OKT3刺激后 PBMC 中 ERK 蛋白的磷酸化水平(P<0.05)。见图4。
2.5 OSCs-exo 抑制 CD4+T 细胞的分化
取免疫磁珠分选的CD4+T 细胞,在不同的培养基中诱导其定向分化后利用流式细胞术检测OSCsexo 对CD4+T 细胞分化的影响,结果显示与对照组细胞相比,OSCs-exo 可显著抑制 CD4+T 向 Th1、Th17 的分化,而促进 CD4+T 向 Th2、Treg 分化,差异均具有统计学意义(P<0.05)。见图5、图6、表1。
2.6 OSCs-exo 通过 STAT 信号通路抑制 T 细胞的分化
Western blot 实验检测 OSCs-exo 对 CD4+T 中STAT 信号通路的影响,结果显示与对照组 CD4+T 细胞相比,OSCs-exo 能够显著抑制细胞中STAT1、STAT3 蛋 白 的 磷 酸 化 (P< 0.05),而STAT5 蛋白的磷酸化水平无明显变化(P>0.05)。见图7。

图3 OSCs-exo 对T 细胞增殖的影响Figure 3 Effect of OSCs-exo on T cell proliferation
表1 OSCs-exo 对CD4+T 细胞分化影响的结果分析( ±s,n=3)Table 1 Analysis of the effect of OSCs exo on the differentiation of CD4+ T cells

表1 OSCs-exo 对CD4+T 细胞分化影响的结果分析( ±s,n=3)Table 1 Analysis of the effect of OSCs exo on the differentiation of CD4+ T cells
注:与CD4+T 细胞组相比,*P<0.05.Note.Compared with CD4+T group,*P <0.05.
组别Groups Th1(%) Th2(%) Th17(%) Treg(%)CD4+ T 细胞 CD4+ T cell 2.67±1.36 10.17±0.44 2.56±0.17 13.21±1.15 OSCs-exo 与 CD4+ T 细胞 OSCs-exo+CD4+ Tcell 9.84±0.80* 3.03±0.22* 12.95±1.18* 3.74±0.56*P<0.05 <0.05 0.00 0.00

图4 OSCs-exo 抑制OKT3 所诱导的ERK 蛋白磷酸化水平Figure 4 OSCs-exo inhibits T cell proliferation by down regulating ERK phosphorylation

图5 OSCs-exo 与CD4+T 细胞共培养Figure 5 Co-culture of OSCS-EXO and CD4+T cells
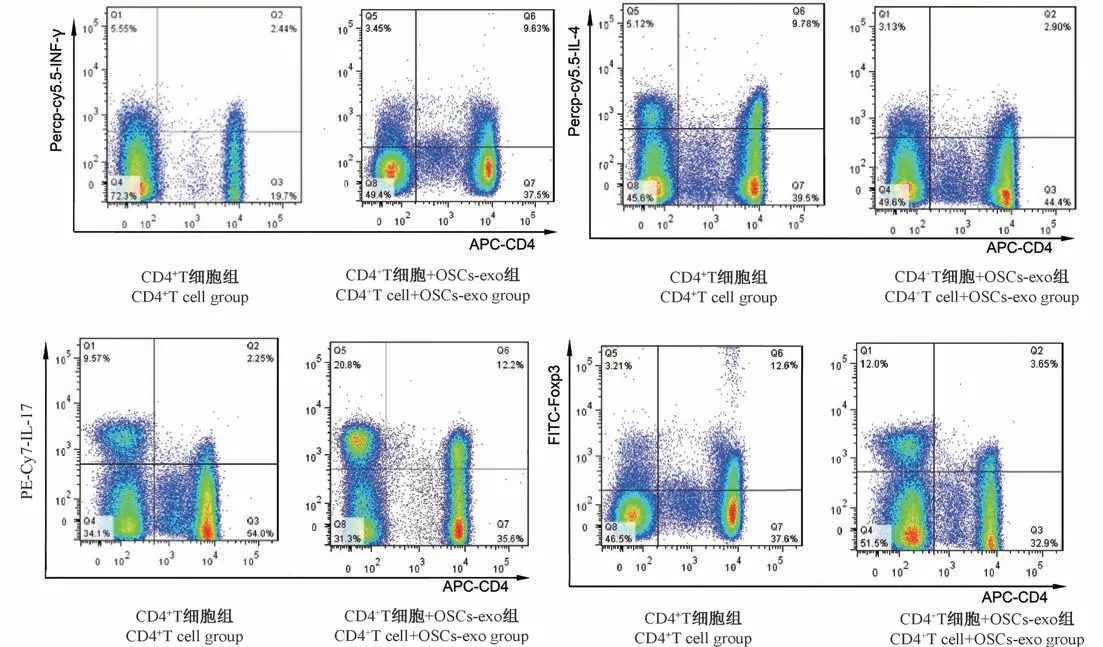
图6 OSCs-exo 对 CD4+T 细胞分化的影响Figure 6 Effect of OSCs exo on the differentiation of CD4+ T cells
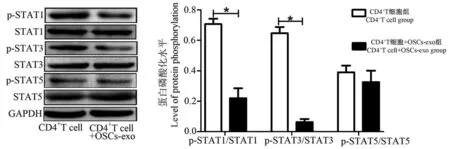
图7 OSCs-exo 对 CD4+T 中STAT 信号通路的影响Figure 7 Effect of OSCs-exo on STAT signaling pathway in CD4+T
3 讨论
骨肉瘤是好发于儿童和青少年的高度恶性肿瘤,复发及转移是骨肉瘤预后不良的主要因素[8]。肿瘤干细胞是指在肿瘤中少量存在的具有自我更新能力与多向分化潜能的肿瘤细胞,研究表明其与肿瘤的侵袭、转移、及复发密切相关[9]。因此,探寻靶向骨肉瘤干细胞的治疗方法可能是是改善患者预后的主要策略。
随着Gibbs 等[9]于2005 年在骨肉瘤组织中首次发现并报道了骨肉瘤干细胞的存在,相继有大量学者从鼠及犬类骨肉瘤细胞系中分离鉴定出具有干细胞特性的骨肉瘤类肿瘤干细胞[10-11]。CD133是一种细胞膜蛋白,研究发现其在脑肿瘤、结肠癌等多种肿瘤干细胞表明均有表达[12]。Tirino 等[12]对SAOS2、MG-63、U20S 3 种骨肉瘤细胞系中分离出CD133 阳性骨肉瘤细胞,进一步实验证实该类细胞能够表达 Oct3/4、Nanog、Sox-2 等干细胞基因,并具有向间质细胞分化的能力,且在体外具有很强的肿瘤诱发功能,因此认为CD133 同样是骨肉瘤干细胞的特征性表面蛋白。
研究表明CD4+T 细胞经刺激后可分化为不同的亚群,如 Th1、Th2、Th17 及 Treg 细胞等,其中 Th1细胞主要通过分泌IL-2、IFN-γ 等细胞因子介导细胞免疫,Th2 细胞主要分泌IL-4、IL-10 等,参与体液免疫[13]。肿瘤免疫主要是细胞免疫,Th1 细胞诱导的免疫应答能够抑制肿瘤细胞的增殖,而Th2 细胞主要诱导B 细胞的分化并抑制机体的细胞免疫。Th17 细胞通过分泌 IL-17、TNF-α 等细胞因子,参与募集中性粒细胞与促进树突状细胞的成熟、协同刺激Th1 细胞的活化[14]。
而Treg 细胞是一群具有免疫抑制作用的CD4+T 细胞,其主要通过分泌 IL-10 及 TGF-β 并负向调控免疫应答[13]。近年来,有研究发现肿瘤干细胞能够优先通过对其微环境中的进行免疫调控以逃逸机体的免疫攻击,从而激发和维持肿瘤的生长及疾病的进展。如在胶质瘤中,Di 等[15]研究报道胶质瘤干细胞能够抑制来自健康志愿者外周血T 细胞的增殖并下调Th1、Th17 亚群细胞的免疫应答。外泌体作为携带母体细胞相关抗原,如MHC-1 类分子、粘附分子1、共刺激分子86 等免疫信息分子的重要信息传递介质,在参与肿瘤干细胞对其微环境的免疫调控中发挥着不可忽视的作用,如 Wang等[16]研究发现在多发性骨髓瘤中,骨髓基质干细胞来源的外泌体可激活STAT1 与STAT3 信号通路促进抗凋亡蛋白BCL-1 与MCL-1 的表达,直接诱导骨髓源性抑制性细胞(MDSC)存活,并进一步刺激后者释放更多的一氧化氮以抑制T 细胞功能,从而有助于肿瘤细胞的免疫逃逸。本研究首先通过无血清悬浮培养与干细胞标志物CD133 流式分选方法成功获得了人骨肉瘤干细胞,又通过免疫磁珠分选法对其进行分离纯化,采用外泌体分离纯化试剂盒收集OSCs-exo,并利用透射电镜、粒径分析检测及Western blot 进行鉴定,实验结果表明获取的OSCsexo 呈圆形或椭圆形囊泡结构,直径约为30 ~100 nm 且高表达外泌体标志性蛋白CD63、HSP70。
研究发现肿瘤干细胞免疫逃逸的根源在于肿瘤微环境中免疫细胞生物学行为的改变[9]。而T细胞的增殖与活化并不偶联,Dietz 等[17]应用抗肿瘤药伊马替尼处理经PMA 刺激的人初始CD4+T 细胞发现,伊马替尼可通过降低ERK 信号通路的磷酸化水平抑制T 细胞的增殖,但其并不影响T 细胞活化标志物CD25 与CD69 的表达。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)作为MARK/ERK 通路中的一个关键成分,广泛参与调节细胞的分化、增殖、侵袭、凋亡等多种生物学过程。在细胞中,被激活的ERK 发生磷酸化,并由随后胞质转移至细胞核内,进而活化下游相关转录因子,参与细胞的多种生物学反应[18]。Dumont 等[19]研究表明ERK 信号通路特异性阻滞剂PD98059 能够明显抑制OKT3 刺激后的T 细胞增殖能力。这提示ERK 信号通路在T 细胞的增殖过程中发挥着重要作用。STAT 是潜在的信号转录因子和转录激活因子,其作为JAK 信号通路的底物,能够被后者磷酸化,而磷酸化的STAT 形成二聚体,依赖核蛋白作用因子穿膜进入核内,从而激活或抑制靶基因的转录,产生生物学效应。其中STAT1/3/5 在免疫细胞的活化中发挥重要的调节作用[20-21]。为明确OSCsexo 对T 细生物学行为的影响,笔者将OSCs-exo 与健康志愿者来源的PBMC 进行共培养,CFSE 染色及细胞流式实验检测其对T 细胞增殖的影响,实验结果表明 OSCs-exo 能够明显抑制 CD3+、CD4+、CD8+T 细胞的增殖。Western blot 进一步实验检测其相关作用机制,结果表明OSCs-exo 可能通过下调ERK 蛋白磷酸化抑制T 细胞的增殖。在探究OSCsexo 对T 细胞分化的实验中,本研究发现OSCs-exo能够抑制CD4+初始T 细胞向Th1 及Th17 细胞的分化,但能够促使其向 Th2 与 Treg 细胞的分化,Western blot 实验结果表明OSCs-exo 对CD4+T 细胞分化的影响可能是通过抑制 STAT 信号通路中STAT1 与STAT3 蛋白的磷酸化而发挥作用。
综上所述,本研究发现骨肉瘤干细胞来源的外泌体能够通过下调ERK 蛋白的磷酸化抑制T 细胞的增殖,并降低磷酸化STAT1 与STAT3 蛋白的表达以诱导CD4+T 细胞向Th2、Treg 细胞分化,而抑制其向Th1、Th17 的分化,从而下调骨肉瘤干细胞微环境中的细胞免疫功能,最终达到促进肿瘤的进展目的。然而,上述作用机制可能仅仅是一个方面,有关骨肉瘤干细胞外泌体的其他作用,尚需进一步研究探讨。
