血CTCs、cfDNA检测在乳腺癌中的应用
2020-11-09常立伟杨东炜刘东辰
常立伟 杨东炜 刘东辰
目前乳腺癌已成为女性最为常见的恶性肿瘤,其发病率在全球范围内均持续增长,具有较高的死亡率[1]。我国乳腺癌发病率也长期居高不下,且发病年龄呈年轻化趋势,严重威胁女性健康状况[2-3]。早期乳腺癌无明显症状,发现困难,延误治疗现象严重。因此,针对乳腺癌病变的早期发现是目前医学领域关注的重点。现阶段常用的诊断方法主要为一些影像学检测手段,如乳腺B 超、乳腺钼靶、磁共振等,但仍需要简便操作、无创、价廉的血清肿瘤标志物提高诊断准确性[4]。根据美国临床生化科学院(National Academy of Clinical Biochemistry,NACB)检验医学时间指南推荐,已将糖类抗原125(carbohydrate antigen 125,CA125)、糖类抗原153(carbohydrate antigen 153,CA153)及癌胚抗原(carcino-embryonic antigen,CEA)等血清肿瘤标志物用于乳腺癌的诊断[5]。随着分子生物技术的迅猛发展,循环肿瘤细胞(circulating tumor cells,CTCs)、循环游离DNA(circulating free DNA,cfDNA)检测在癌症诊疗过程中的作用成为研究热点[6]。本研究旨在探究血CTCs、cfDNA 联合检测在乳腺癌中的应用价值,并分析血CTCs、cfDNA 水平与患者临床病理特征及预后的关系。
1 资料与方法
1.1 一般资料
选取2014年4月至2016年4月经手术治疗的乳腺疾病患者163 例,其中85 例术后病理确诊为乳腺癌(乳腺癌组),另78 例为乳腺良性疾病患者(良性疾病组),同时募集同期入院体检健康女性50 例(对照组)。乳腺癌组患者平均年龄(45.46±11.62)岁;良性疾病组患者平均年龄(43.29±12.73)岁;对照组平均年龄(46.35±10.58)岁。3 组年龄资料比较差异无统计学意义(P>0.05),具有可比性。纳入标准:乳腺癌患者经术后病理检测确诊,且为首次、单侧发病;具有手术指征;签署知情同意书。排除标准:患者术前接受放化疗、内分泌治疗等;合并其他恶性肿瘤;严重心、肝、肾等功能不全;合并出血性疾病;存在严重系统性疾病或感染;处于妊娠、哺乳期女性;精神异常,存在沟通障碍。本研究经本院伦理委员会批准,各组受试者均签署知情同意书。
1.2 方法
1.2.1 病例资料及样本采集
收集受试者一般人口学资料和疾病相关资料,并采集受试者空腹下肘部静脉血5 mL,室温静置后待测。
1.2.2 血CTCs 检测
采用免疫磁珠阴性富集法富集血液样本中的细胞,进行荧光原位杂交实验,再通过免疫荧光染色定位CTCs 细胞,最后荧光显微镜下计数CTCs和判读结果。判读标准:以2 个CTCs/3.2 mL 血液为临界值,任一探针信号点>2 个,无血源性白细胞表面抗原着色时,可计为1 个阳性细胞,阳性细胞>1 个时即为阳性[7]。
1.2.3 血cfDNA、肿瘤标志物检测
分离样本血浆,参照QIAGEN 血液基因组DNA 纯化试剂盒(批号:51106)说明书操作,提取血浆DNA,采用荧光定量PCR 检测血浆DNA 含量。其中GADPH 上游引物:5′GGAAGGTGAA GGTCGGAGTC3′,下游引物:5′GAAGATGGTGA TGGGATTC3′,探针序列:5′FAM-CAAGCTTCC CGTTCTCAGCC-TAMRA3′。以≥1×103基因拷贝数为阳性标准[8]。
应用全自动微粒子化学发光酶免疫分析仪,检测样本血清中CA125、CA153 及CEA 的浓度,其中各指标阳性标准为:CA125>35 U/mL,CA153>31.5 U/mL,CEA>5 U/mL,联合检测时任一指标超标即为阳性[9]。
1.2.4 术后随访
术后通过门诊复查形式随访1年,随访时间截止2019年4月30日,记录患者疾病进展情况,将其中出现疾病进展的患者作为疾病进展组,剩余患者作为无疾病进展组,比较两组血CTCs、cfDNA水平。
1.3 统计学方法
采用软件SPSS 17.0 分析处理数据,计量资料以(±s)表示,多组均数比较采用单因素方差分析,组间两两比较采用SNK-q法;计数资料以n(%)表示,采用χ2检验;采用受试者工作特征(receiver operating characteristic,ROC)曲线描述血CTCs、cfDNA 对于乳腺癌诊断的可行性,以曲线下面积(area under the curve,AUC)大小表示其诊断价值,组间比较采用Z检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 各组血清CTCs、cfDNA、CA125、CA153 及CEA 水平的比较
各组血清CTCs、cfDNA、CA125、CA153 及CEA 水平比较,差异均有统计学意义(P<0.05),其中乳腺癌组上述指标水平明显高于良性疾病组和对照组,差异具有统计学意义(P<0.05),但良性疾病组和对照组比较差异无统计学意义(P>0.05),见表1。
表1 各组血CTCs、cfDNA、CA125、CA153 及CEA 水平的比较(±s)Table 1 Comparison on levels of serum CTCs,cfDNA,CA125,CA153 and CEA among all groups(±s)

表1 各组血CTCs、cfDNA、CA125、CA153 及CEA 水平的比较(±s)Table 1 Comparison on levels of serum CTCs,cfDNA,CA125,CA153 and CEA among all groups(±s)
注:与对照组比较,aP<0.05;与良性疾病组比较,bP<0.05。
指标CTCs(个)cfDNA(×103基因拷贝数)CA125 CA153 CEA乳腺癌组(n=85)1.34±0.29ab 29.65±8.57ab 22.37±7.24ab 35.84±11.62ab 6.69±2.13ab良性疾病组(n=78)0.03±0.01 0.05±0.01 16.21±5.20 9.13±2.65 1.85±0.54对照组(n=50)0.00±0.00 0.03±0.01 15.43±4.67 8.87±2.41 1.76±0.42 F 值1325.262 762.096 29.931 316.891 309.314 P 值<0.001<0.001<0.001<0.001<0.001
2.2 血CTCs、cfDNA 诊断乳腺癌的ROC 分析
ROC 分析血CTCs、cfDNA 单独或联合及三项联合检测诊断乳腺癌的AUC 高于传统肿瘤标志物诊断,差异具有统计学意义(P<0.05),但cfDNA、CTCs+cfDNA 及三项联合检测间两两AUC 比较差异无统计学意义(P>0.05)。见表2、图1。
2.3 血CTCs、cfDNA 水平与乳腺癌患者临床病理特征的关系
肿瘤大小≥2 cm 乳腺癌患者血CTCs 阳性率高于肿瘤大小<2 cm 者,差异具有统计学意义(P<0.05),CTCs 阳性率在不同年龄、病理类型、绝经情况、TNM 分期、分化程度、淋巴结转移患者间的比较差异无统计学意义(P>0.05);有淋巴结转移者cfDNA 阳性率高于无转移者,差异具有统计学意义(P<0.05),cfDNA 阳性率在不同年龄、病理类型、绝经情况、肿瘤大小、TNM 分期、分化程度患者间的比较差异无统计学意义(P>0.05),见表3。
2.4 血CTCs、cfDNA水平与乳腺癌患者预后的关系截止2019年4月30日,85 例乳腺癌患者术后
有22 例出现疾病进展,其中疾病进展者CTCs、cfDNA 阳性率分别为19(86.36%)和22(100.00%),均高于无疾病进展组34(53.97%)和49(77.78),差异具有统计学意义(χ2=7.290,P<0.05)。
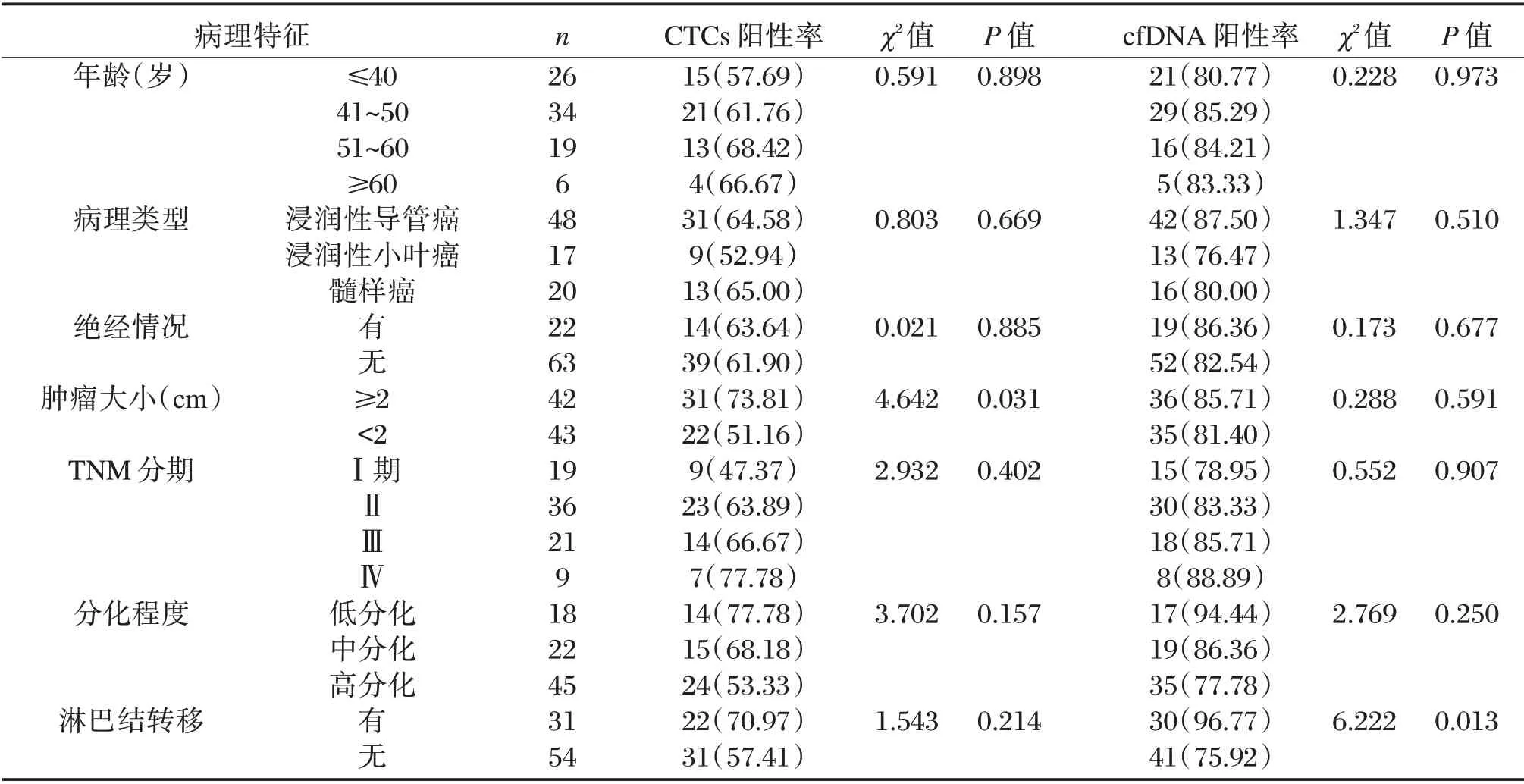
表3 血CTCs、cfDNA 水平与乳腺癌患者临床病理特征的关系[n(%)]Table 3 Relationship between serum CTCs,cfDNA levels and clinicopathological features of breast cancer patients[n(%)]
3 讨论
CTCs 是外周血中的各类肿瘤细胞的总称,这些细胞大多是原发肿瘤部位、复发或转移病灶脱落从而进入血液循环,具有与肿瘤特异性相关的抗原蛋白质和遗传变异表达[10]。cfDNA 是外周血游离的DNA 总称,常以蛋白复合体形式存在,包括肿瘤来源的DNA 和正常细胞来源的DNA。由于癌症患者血浆中核酸酶活性降低,cfDNA 的清除率降低,导致癌症患者cfDNA 浓度高于健康者[11]。故检测cfDNA 水平可实时监测癌组织情况。张潇分等[12]研究指出,CTCs 和cfDNA 可能是乳腺癌辅助诊断的潜在生物学标志。本研究结果提示CTCs、cfDNA 在乳腺癌的诊断中均具有较高价值,与上述文献结果基本相符。但考虑CTCs 和cfDNA 的检测方法和阳性标准不同,后续还需要加大样本量进行验证。CA125、CA153 及CEA 是常用的乳腺癌诊断血清标志物,上述指标对于乳腺癌均有较高的敏感性,但特异性较差[13]。本研究将联合检测中任一指标阳性指定为阳性结果进一步说明血CTCs、cfDNA 联合检测对于乳腺癌的早期诊断有较高的应用价值。在本研究中,比较3种不同检查方法单独或联合及部分联合的诊断价值,在国内外相关报道较少。
乳腺癌的临床治疗主要依据患者临床病理特征,因此,分析乳腺癌的临床病理特征与CTCs、cfDNA 的关系也是十分必要的。既往研究显示,CTCs 阳性与乳腺癌的临床分期、肿瘤大小、淋巴结状态及相关抗体表达有关[13]。而血cfDNA 检测作为一种液体活检,可动态评估乳腺癌患者临床疗效及预后[14]。本研究结果提示肿瘤直径越大,肿瘤细胞脱落进入血液循环的可能性更大;有淋巴结转移者cfDNA 阳性率高,可能是肿瘤细胞活跃增殖时释放更多DNA 进入血循环。但本研究中其他临床病理特征与CTCs、cfDNA 水平无明显相关性,后续将纳入更多研究对象深入分析其相关性。另外,术后随访结果显示,疾病进展患者CTCs、cfDNA 阳性率要高于无疾病进展组,与文献报道血CTCs、cfDNA可评估乳腺癌患者预后的结果相符[15-16]。
综上所述,血CTCs、cfDNA 检测对于乳腺癌有较高的诊断价值,且与患者临床病理特征及预后密切相关,可为乳腺癌患者的早期诊断和个体化治疗提供可靠依据。但目前血CTCs、cfDNA 诊断乳腺癌患者的截断值尚未有确切定义,还需要不断优化检测技术和数据分析方法,提高其临床利用率。
