肝细胞癌中CCT4 基因的表达及其临床意义
2020-11-09俞旭东钱叶本通讯作者
俞旭东 钱叶本(通讯作者)
(安徽医科大学第一附属医院 安徽 合肥 230022)
肝细胞癌是全球范围内发病率排名第六的癌症,并且是导致患者死亡的第四大最常见原因,其特点是高度增殖、异质性和侵袭性[1]。肝癌治疗方法多样,主要包括根治性切除术、肝移植术、射频消融术及放疗和化疗等方法。但其临床疗效有限,复发率高,肝癌患者的生存率较低[2,3]。目前肝癌缺乏特异性预后标志物。TCP1 环复合物是一种ATP 依赖性分子伴侣蛋白,其由八个不同的亚基(命名为CCT1 至CCT8)组成。TCP1 环复合物可以折叠肌动蛋白和微管蛋白,参与癌细胞的增殖,迁移[4-5]。作为TCP1 环复合物的亚基,CCT4 在恶性肿瘤中的作用鲜有报道。本文基于癌症基因图谱(The Cancer Genome Atlas,TCGA)公共数据库肝癌组织标本数据,利用生物信息学分析CCT4 在肝癌中的表达并使用PCR 和免疫组化验证;同时还分析了其异常表达在肝癌患者中的临床意义和其潜在机制。本文旨在阐明CCT4 在评估肝癌患者预后中的价值。
1.资料和方法
1.1 数据下载和处理
从TCGA 数据库 (https://tcga-data.nci.nih.gov/tcga/) 下载374 个HCC 组织和50 个正常肝组织样品的mRNA seqV2 表达谱数据和377 例HCC 患者的临床病理数据。下载的临床数据包括的指标为生存期、生存状态、年龄、性别、分级和TNM 分期。
1.1.1 差 异 表 达 分 析 使 用limma 包(http://bioconductor.org/packages/release/bioc/html/limma.html)分析CCT4 在TCGA 数据库中所包含的374 个HCC 组织和50 个正常肝组织样品中的表达差异。
1.1.2 生存曲线 剔除TGCA 数据里中肝癌样本中生存数据不全的患者,剩余370 例患者。以CCT4 在这些组织中表达的中位值为截断值,将患者分为CCT4 高表达组和低表达组。使用survival 包(https://cran.r-project.org/web/packages/survival/index.html)分析两组患者的总生存率。
1.1.3单因素和多因素Cox分析 剔除任意指标不全的患者,剩余235 例患者。使用survival 包(https://cran.r-project.org/web/packages/survival/index.html)行单因素和多因素Cox分析。
1.1.4 临床相关性分析 剔除指标不全的患者,剩余370 例年龄信息齐全的患者,371 例性别信息齐全的患者,367 例分级信息齐全的患者,353 例TNM 分期信息齐全的患者,分析各指标与CCT4 的表达关系。
1.1.5 GSEA富集 使用GSEA 软件(software.broadinstitute.org/gsea/index.jsp)和全基因表达数据进行GSEA 富集分析。根据CCT4 表达中位值将患者分为高表达组和低表达组,比较两组患者的其他基因表达差异,根据KEGG 富集要求对差异表达基因进行通路富集。Nom p-val <0.05 和FDR q-val ≤0.25 视作有意义。
1.1.6 蛋白互作网络 检索数据库String (https://string-db.org/)和,Genemania (http://genemania.org/)以筛选人体内和CCT4的互作蛋白。String筛选的基因截断值为0.4,大于0.4 表示相关性较强。使用cytoscape 软件绘图。
1.2 临床样本
我们收集了2015 年-2019 年安徽医科大学附属第一医院肝胆胰外科收治的肝癌患者中的60 例肝细胞癌患者,所有病例经手术后病理资料证实为肝癌患者,对于临床资料的完善与否不作特殊性要求。另收取60 例取自远离癌组织中心5cm 以上的癌旁正常组织作为对照,所有患者术前均均未行放、化疗。选取2019 收集的肝癌组织中的15 例,经10%的中性福尔马林固定,脱水,石蜡包埋,4μm 厚切片保存备用。
1.3 RNA 提取和qRT-PCR
根据Biotech RNA 提取试剂盒说明书提取60 对癌与癌旁组织的总RNA,并反转录成互补的脱氧核糖核酸(cDNA)。试用Nanodrop 2000 分光光度计(Thermo Scientific,美国)测量RNA 的浓度及纯度。使用SYBER Green I Master Mix 方案行qRT-PCR,反应体系为10μ L,反应条件为:95℃ 5min;95℃ 10s,60℃ 30s,72℃ 20s,40 个循环;95℃,5s,65℃,1min。CCT4 正向引物:5′-ATGCCCGAGAATGTGGCAC-3′;反向引物:5′-GCTTGTCGCGGTCCTGATAG-3′。使用β-actin 为内参,β-actin 正向引物:5′-GGGAAATCGTGCGTGACATTAAG-3′;β-反向引物:5′-TGTGTTGGCGTACAGGTCTTTG-3′。
1.4 免疫组化
将组织切片脱蜡,水合,通过柠檬酸盐抗原修复溶液(用PBS 稀释)在微波条件下修复,CCT4 单克隆抗体(中国 Proteintech 公司,货号:21524-1-AP)以1 ∶100 稀释,辣根过氧化物酶标记的山羊抗兔的二抗(购买自美国Jakson 公司)以1 ∶200 的比例稀释。显微镜下拍照,观察肝脏组织中的CCT4 蛋白表达强度。
1.5 统计学分析
用Wilcox 秩和检验分析TCGA 数据库中CCT4 在不配对肝癌和正常组织中的差异表达。使用t检验分析qRT-PCR 检测的CCT4在配对癌和癌旁组织中表达。使用χ2检验分析TCGA 数据库中CCT4 表达水平与肝癌患者的临床病理特征关系;Log-Rank 法检验行单因素和多因素Cox分析。以P<0.05表示具有统计学意义。
2.结果
2.1 CCT4 在肝癌中的表达水平
我们首先比较了CCT4 mRNA 在TCGA 数据库里374 个肝癌和50 个正常组织中的表达(图1A),同时使用qRT-PCR 检测CCT4 mRNA 在60 例配对癌和癌旁组织中表达以验证TCGA 数据库结果(图1B)。结果表明,CCT4mRNA 在肝癌组织中的表达显著高于其在癌旁的表达(图1A/B)(P=1.085e-23,P<0.001)。进一步,我们使用免疫组化检测CCT4 蛋白在15 例配对癌和癌旁组织中表达(图1C)。结果提示在癌组织中CCT4 蛋白表达较高。总之,CCT4 mRNA 和蛋白在癌组织中高表达。

图1 注:A.在TCGA 公共数据库中CCT4 在癌旁与肝癌组织中的表达差异;B.在60 对标本中CCT4 在癌旁和肝癌组织的表达差异;C.CCT4 在肝组织的免疫组织化学染色(左边配对癌旁组织,右边配对肝癌组织)
2.2 CCT4 在肝癌中的预后价值
为了探讨CCT4 在肝癌中的预后价值,我们使用Kaplan-Meier 法绘制了生存曲线,同时使用log-Rank 法行单因素和多因素cox 回归分析。如图2 所示,CCT4 高表达组患者的1 年-,3 年-和5 年总生存率分别约为75.1%,52.5%和41.7%;CCT4 低表达组患者的1 年-,3 年-和5 年总生存率分别约为89.7%,70.2%和53.6%。CCT4 高表达组患者的总生存率更低 (P=0.005)。见表1 所示,单因素Cox 分析结果提示TNM 分期 (HR[95%CI]=1.86[1.46 ~2.39]) (P<0.01)、T 分 期 (HR[95%CI]=1.8[1.43 ~2.27]P<0.01)、M 分 期(HR[95%CI]=3.85[1.21 ~12.28]P<0.01) 及CCT4 表 达(HR[95%CI]=1.02[1.01 ~1.03]P<0.01)与患者预后相关。多因素Cox 分析结果提示,CCT4 mRNA 表达(HR[95%CI]=1.02[1.01~1.03]P<0.01)是肝癌患者的独立危险因素。总之,CCT4是肝癌独立不良预后因子。
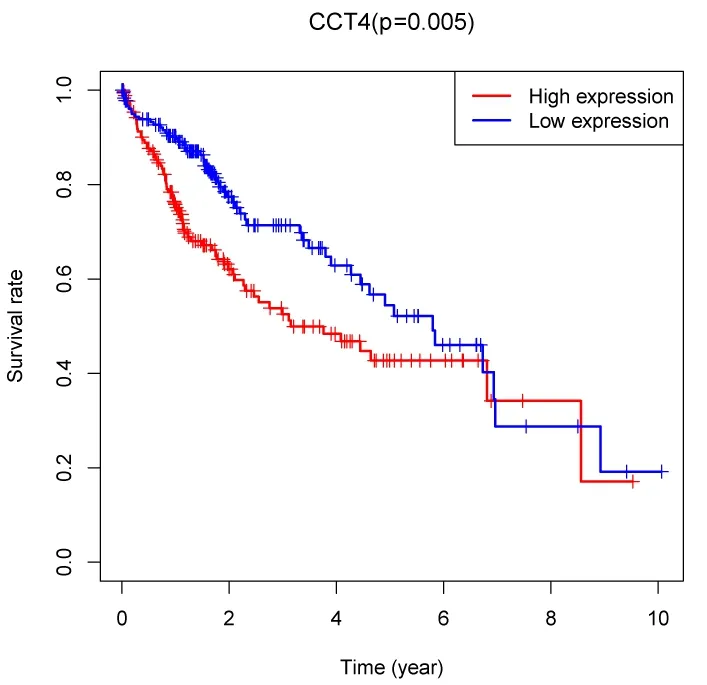
图2 在TCGA 数据中CCT4 的表达与肝癌患者的生存分析

表1 TCGA 中CCT4 的单因素和多因素Cox 回归分析
2.3 CCT4 表达与患者临床病理特征的关系
如图3 所示,CCT4 表达与患者的性别无关。但是与患者的年龄(P<0.022)、病理分级(P<0.001)及TNM 分期呈正相关 (P<0.001)。

图3 A.以中位值为界限将肝癌患者中不同的年龄分为高低两组,CCT4 的表达与年龄的相关性;B.根据肝癌患者的性别进行分组,CCT4 的表达与性别的相关性;C.CCT4 的表达与肝癌患者中不同病理分级的关系;D.CCT4 的表达与肝癌患者中不同的病理分期的关系
2.4 GSEA 富集分析结果
我们使用GSEA 软件对HCC 中CCT4 进行GSEA 富集分析,以探索CCT4 调控的基因集。我们分析了CCT4 对178 个富集通路的影响。如图4 所示分析结果提示与细胞周期及WNT 信号通路,MAPK信号通路和VEGF通路途径有关的基因组在CCT4的高表型中上调。
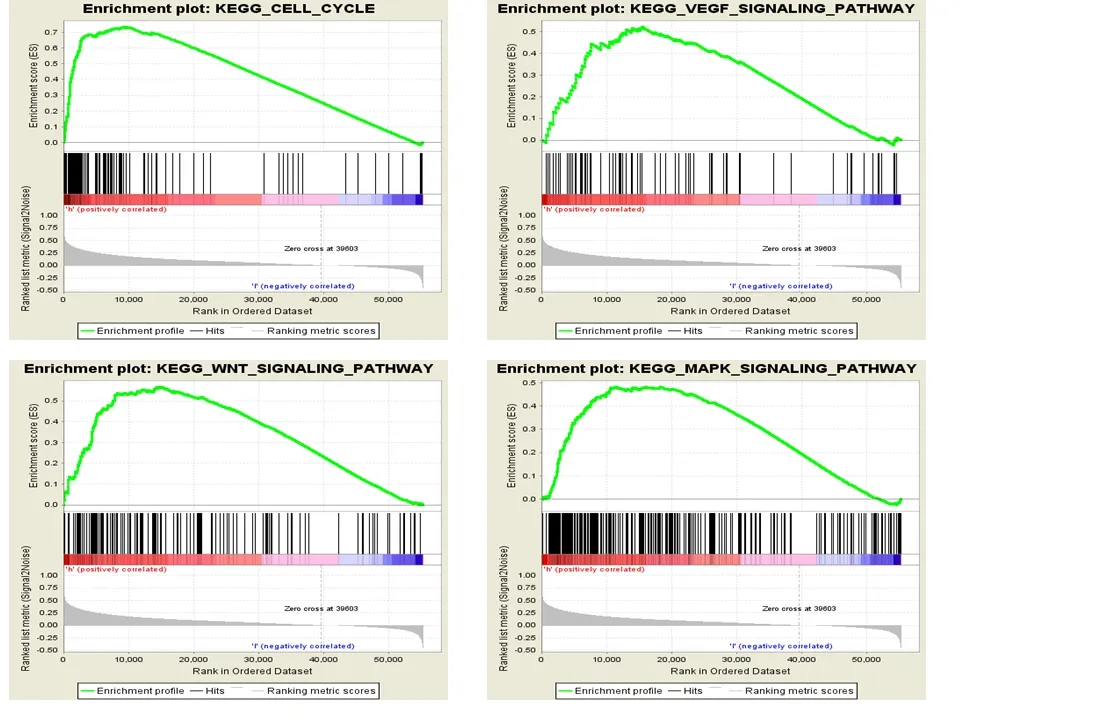
图4 示:使用GSEA 软件对CCT4 在肝癌中进行GSEA 富集分析,所得到的4个与癌症关系密切相关由CCT4 高表型所富集到的通路.
2.5 蛋白互作网络
我们检索了String 和Genemania 两个数据库以分析CCT4 在人体的互作蛋白。结果如图5 所示这些蛋白主要包括PFDN 复合物中多个亚基(PFDN1,PFDN2,PFDN4,PFDN5,PFDN6)及CDC20 蛋白,SPHK1 蛋白等。
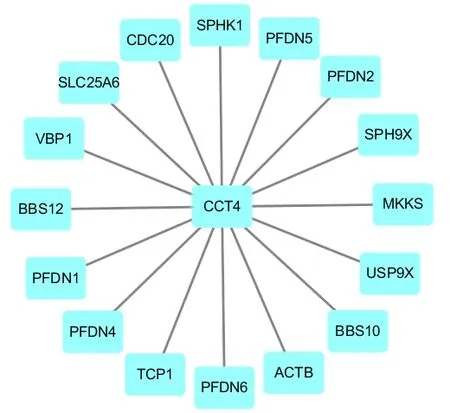
图5 示:通过使用String,Genemania 两个数据库预测CCT4 的蛋白互作网络
3.讨论
CCT 复合物属于分子伴侣蛋白,其可通过折叠肌动蛋白及微管蛋白而参与细胞的分裂和迁移[12]。此外,在肿瘤中,CCT4 还可通过折叠癌基因或抑癌基因而调控肿瘤进展。这些基因包括VHL、P53、STAT3、cyclin E和CDC20等[6-10]。作为CCT家族的一员,CCT4 的丢失可抑制食道鳞状细胞癌的增殖、侵袭和迁移[11]。但是目前CCT4 在HCC 的作用仍不清楚。
本研究比较TCGA 数据库中CCT4 mRNA 在肝癌中的表达并通过qRT-PCR和免疫组化在肝癌患者标本中验证TCGA数据库结果,我们发现CCT4 在肝癌组织中高表达。进一步通过对TCGA 数据库中肝癌患者行生存分析、单因素和多因素回归分析,发现高表达的CCT4 的患者预后较差,且CCT4 是肝癌的独立预后因子。这提示CCT4 在肝癌中表达上调,且充当预后标志物。
此外我们通过蛋白互作网络及GSEA 富集分析初步讨论了CCT4 在肝癌中的潜在机制。GSEA 的结果表明细胞周期、VEGF 信号通路、MAPK 信号通路和Wnt 信号通路的相关基因在CCT4 高表型中表达上调。MAPK 信号通路通过多种级联反应发挥作用,MAPK/ERK 信号通路的异常激活在肝癌中发挥重要作用[12]。Wnt信号通路参与细胞增殖、存活、自我更新和分化等[13-14]。在肝癌中Wnt/β-catenin 信号通路的活化与肝癌的发生密切相关[15]。蛋白互作网络结果显示,CCT4 与PFDN 蛋白中的数个亚基互作。PFDN 亚基可以在HepG2 肝癌细胞中以高亲和力与癌基因HDAC1互作而促进肝癌细胞的增殖[16]。CDC20 是细胞周期调节中的关键分子[17]。chu 等研究表明CDC20 可能通过Wnt /β-catenin 信号传导通路促进皮肤鳞状细胞癌的发展[18]。综上CCT4 可通过与PFND 的亚基及CDC20 互作而参与调控肝癌进展。
但是,我们的研究仍然存在一些局限性。(1)组化样本不足。(2)没做细胞功能学和裸鼠体内实验。(3)未验证GSEA 富集和蛋白互作网络所得出的结果。这些不足正是我们下一步的研究重点。尽管存在局限性,我们的研究表明CCT4 是肝癌预后有价值的标志物.
