醋酸-醋酸钠体系中铜铅硫化矿物电氧化浸出分离行为
2020-11-08曹占芳谭锦勇钟宏
曹占芳, 谭锦勇, 钟宏
(中南大学化学化工学院,锰资源高效清洁利用湖南省重点实验室,长沙410083)
铜、铅等有色金属是国民经济建设的重要基础原料。2016年,我国精炼铜、精炼铅的产量分别达到1 164.2万t和465.5万t,占比为 全球 的35.9%、41.6%,均连续多年位居世界第一。近年来,我国云南、四川、青海、西藏、湖南等地相继探明了多个超大型铜铅锌多金属复杂硫化矿床[1-3]。该类型矿成分及结构复杂,Cu、Pb均以硫化物形式存在,采用现有浮选工艺,较难浮选分离出单一金属的合格精矿,往往仅能得到金属互含较高的混合精矿或中矿产品,这给后续的冶金技术带来了巨大的分离压力[4-8]。实现铜铅等混合精矿经济高效分离与综合回收成为该类矿产资源合理开发利用的关键。近年来,针对铜铅锌混合精矿选择性浸出分离技术,国内外开展了大量的研究工作,相继研究了高压浸出、含氯化合物浸出、H2O2浸出等一系列技术[9-18]。Xu Bin等研究了呷村铜铅锌混合精矿氧压酸浸过程,结果表明,溶液中铜、锌的浸出率分别为96.2%和97.5%,铅则可以在固相渣中回收[10]。Harvey T.J.等研究了高压酸浸过程中闪锌矿的选择性浸出行为。结果表明,氧浓度、方铅矿以及黄铁矿等因素均影响闪锌矿选择性浸出过程[11]。李元坤等针对某铜铅锌混合精矿,以液氯为浸出剂,通过催化剂调控矿浆电位,实现了Cu、Pb、Zn矿物的先后选择性浸出,元素硫的回收率大于76%;但液氯毒性较强,保存和使用过程具有一定的危险性[12]。现有浸出分离技术虽取得了良好进展,但也分别受到过程控制要求高、分离效率低以及成本高等因素的制约,难以进一步广泛推广应用。因此,急需开发新型环保的铜铅锌冶金分离技术。
矿物电氧化浸出技术具有选择性强、电位易调控、条件温和及资源利用率高等优点,近年来在复杂硫化矿物处理领域深受重视[19-20]。研究表明,方铅矿可在206.1~268.6 mV条件下分解[21],而黄铜矿在800 mV以下基本上不发生反应[22]。因此,文中系统研究了醋酸-醋酸钠体系中铜、铅硫化矿物的电氧化浸出分离行为,以期为我国有色多金属复杂资源的经济高效利用提供一些技术基础。
1 矿样与实验
实验矿样取自于广西梧州市某铅锌铜矿;矿样颗粒尺寸(2~200μm),其中小于100μm的颗粒大于80%。由XRF结果可知(表1),铅精矿中Pb含量为70.429%,铜精矿中Cu含量为34.840%。XRD结果表明(图1),铅精矿主要矿物为方铅矿(PbS),铜精矿主要矿物为黄铜矿(CuFeS2)。

表1 铅精矿、铜精矿的XRF分析结果Table 1 XRF analysis results of lead concentrate and copper concentrate单位:质量分数,%
实验所用电氧化装置主要由S22型直流稳压电源系统、自制无隔膜电解槽组成(7.5 cm×5.5 cm×5.5 cm);阳极采用DSA电极,阴极采用钢板,两电极间距为5 mm。实验过程,Pb、Cu的分析均采用ICPOES方法完成。

图1 铅精矿、铜精矿的XRD分析结果Fig.1 XRD analysis results of lead concentrate and copper concentrate
2 结果与讨论
实验系统考察了缓冲体系、pH、搅拌速率、液固比、时间、温度、催化介质等因素对方铅矿、黄铜矿的电氧化浸出分离行为,并构建了适合铜铅硫化矿物高效分离的电氧化体系。
2.1 缓冲体系种类影响
电氧化过程中,阳极通常发生析氧副反应,阴极发生析氢副反应,两个半反应并不平衡,也就造成电氧化体系pH的持续变化。如果电氧化过程中,体系酸性较强,就可能有部分铅、铜硫化矿物与H+直接反应,并生成对环境有害的H2S气体。因此,十分有必要通过研究,实现电氧化体系的相对稳定。本实验拟构建缓冲电氧化体系,一方面维持电氧化体系在合理的pH范围,另一方面,缓冲介质(阴离子等)也能够与铜、铅等金属离子形成络合物,促进目标矿物浸出;此外,阴离子与铅、铜离子络合能力的差异则可进一步强化铅、铜矿物的选择性电氧化浸出分离。
实验考察了不同缓冲介质对铜、铅矿物电氧化行为的影响。实验条件为:固液比0.02 g/mL,搅拌速度700 r/min,电流为1 A,温度40℃,反应时间60 min,氯化钠浓度3 mol/L,槽电压3.8~4.4 V,缓冲溶液的浓度为1 mol/L,pH值为3。铅矿物、铜矿物的浸出情况如图2所示。

图2 不同缓冲体系对方铅矿、黄铜矿浸出行为的影响Fig.2 The influence of different buffer systems on the leaching behavior of galena and chalcopyrite
由图2可知,当缓冲介质为醋酸-醋酸钠时,铅精矿中Pb的浸出量为1.12 g,而铜精矿中Cu的浸出量仅为0.04 g,强化了铅的选择性电氧化浸出。由此表明,采用缓冲电氧化技术完全有可能实现方铅矿和黄铜矿物的高效分离。因此,后续试验优选醋酸-醋酸钠作为电氧化体系缓冲介质。
2.2 pH对铅矿物、铜矿物浸出的影响
实验条件:固液比0.02 g/mL,搅拌速度700 r/min,阳极电流密度659.4 A/m2,3 mol/L NaCl,反应时间60 min,室温,槽电压3.8~4.4 V。实验研究了电解液pH对铅精矿、铜精矿的浸出影响规律,结果见图3。

图3 pH对黄铜矿、方铅矿浸出行为的影响Fig.3 The influence of pH on the leaching behavior of chalcopyrite and galena
由图3可知,pH对方铅矿的电氧化浸出行为影响较大,pH值由2.6增大到6.6,铅的浸出率逐步下降。然而,pH对铜矿物的浸出影响不是很明显,pH=2.6~6.6的范围内,黄铜矿的浸出率均不高。因此,后续实验电氧化体系的pH值均控制在5.7左右。
2.3 搅拌速度对铅矿物、铜矿物浸出的影响
实验考查了搅拌速度对方铅矿、黄铜矿的电氧化浸出行为影响,结果见图4。实验条件:pH值5.7,固液比0.02 g/mL,3 mol/L NaCl,反应时间60 min,阳极电流密度989 A/m2,温度为室温,电压3.8~4.4 V。
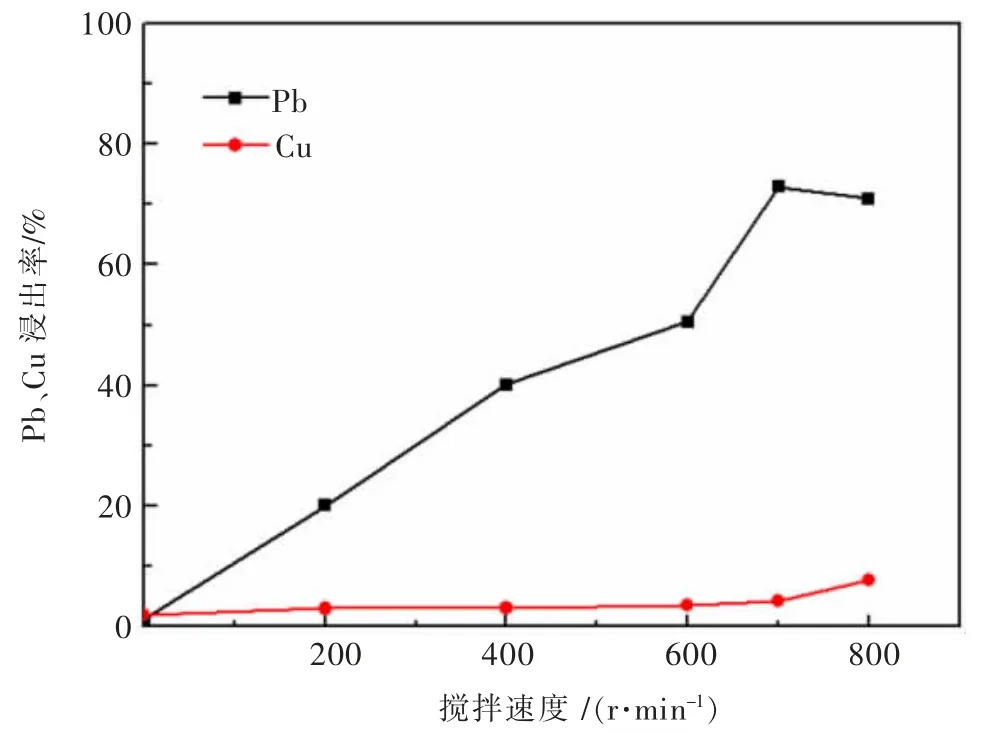
图4 搅拌速度对黄铜矿、方铅矿浸出行为的影响Fig.4 The influence of stirring speed on the leaching behavior of chalcopyrite and galena
由图4可知,搅拌速度对方铅矿、黄铜矿的电氧化浸出行为有显著影响。随着搅拌速率的增加,方铅矿、黄铜矿的浸出均有所增加。一般认为,搅拌影响矿物颗粒在电解质溶液中的扩散,进而影响其与氧化介质的接触能力与机会。当搅拌强度足够大时,矿物能与氧化剂充分接触,再增大搅拌速度对矿物的浸出几乎没有影响。因此,后续实验将搅拌速度固定为700 r/min。
2.4 固液比对铅矿物、铜矿物浸出的影响
实验考查了液固比对方铅矿、黄铜矿的电氧化浸出行为影响,结果见图5。实验条件:pH值5.7,搅拌速度 为700 r/min,阳极电流密度659.4 A/m2,3 mol/L NaCl,反应时间60 min,温度为室温,电压3.8~4.4 V。

图5 固液比对黄铜矿、方铅矿浸出行为的影响Fig.5 The influence of solid-liquid ratio on the leaching behavior of chalcopyrite and galena
由图5可以发现,当固液比小于0.02 g/mL时,方铅矿的浸出基本稳定。随着固液比的继续增加,方铅矿的浸出率开始逐渐下降。可能的原因是电氧化过程中,阳极表界面瞬时生成的氧化介质相对稳定,矿物总量的增加将降低矿物浸出率。同时,实验也发现固液比对黄铜矿的浸出影响与方铅矿类似,当液固比大于等于0.02 g/mL时,总体浸出率均较低。因此,后续电氧化实验的液固比优化设定在0.02 g/mL。
2.5 氯离子浓度对铅矿物、铜矿物浸出的影响
实验考查了氯离子浓度对方铅矿、黄铜矿的电氧化浸出行为影响,结果见图6。实验条件:pH值为5.7,固液比为0.02 g/mL,搅拌速度为700 r/min,反应时间60 min,阳极电流密度为989 A/m2,温度为室温,电压3.8~4.4 V。
由图6可以看出,电氧化介质(氯离子)浓度的增加有利于促进矿物的电氧化浸出,特别是,当氯离子浓度从1 mol/L增大到3 mol/L,方铅矿的浸出效率提升十分显著;当Cl-浓度为3 mol/L时,方铅矿Pb的浸出率达到72.88%,黄铜矿中Cu的浸出率仅为4.20%。当氯离子浓度大于3 mol/L后,这一因素的影响不再那么明显。可能的原因是阳极区产生的氧化介质(ClO-)的量受电流密度等因素制约,Cl-浓度的增加不会进一步增加氧化剂氯氧化物的含量。因此,本实验后续氯离子浓度优化设定为3 mol/L。
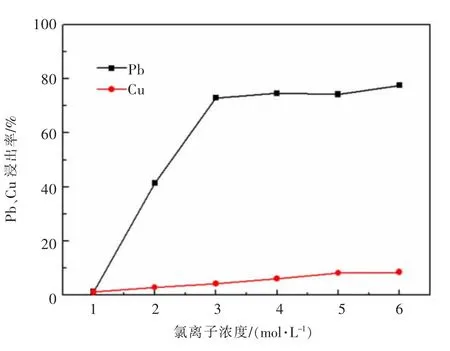
图6 氯离子浓度对黄铜矿、方铅矿浸出行为的影响Fig.6 The influence of chloride ion on the leaching behavior of chalcopyrite and galena
2.6 反应时间对铅矿物、铜矿物浸出的影响
实验考查了时间对方铅矿、黄铜矿的电氧化浸出行为影响,结果见图7。实验条件:pH为5.7,固液比为0.02 g/mL,搅拌速度为700 r/min,阳极电流密度659.4 A/m2,3 mol/L的NaCl,室温,电压3.8~4.4 V。
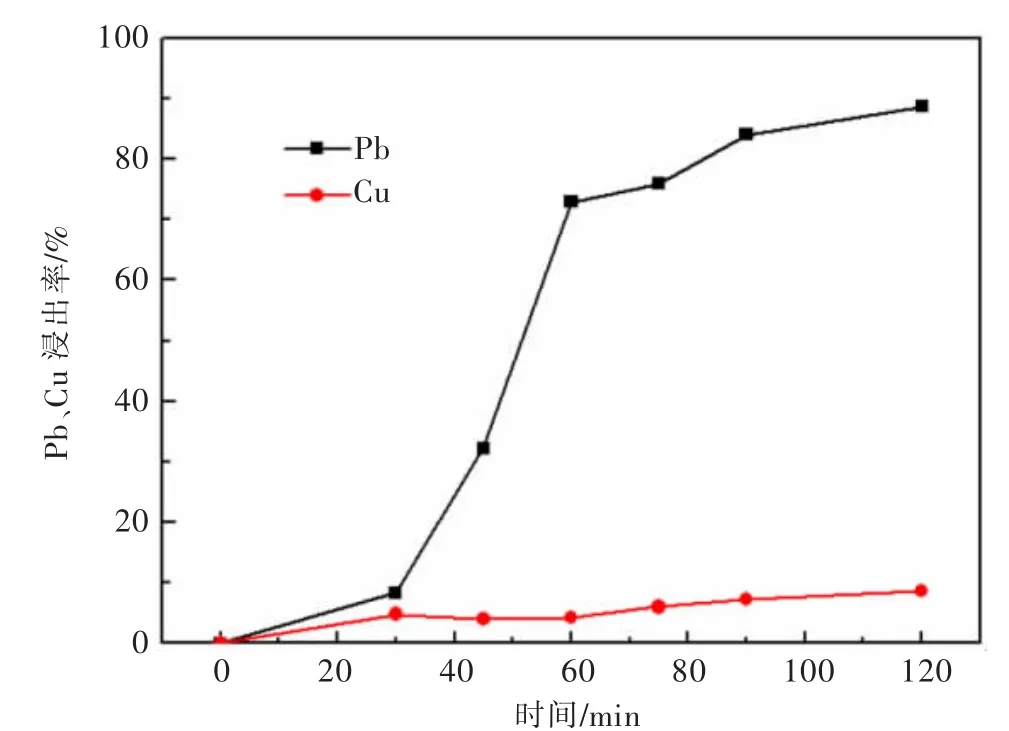
图7 反应时间对黄铜矿、方铅矿浸出行为的影响Fig.7 The influence of reaction time on the leaching behavior of chalcopyrite and galena
由图7可知,随着电氧化浸出时间的增加,方铅矿、黄铜矿浸出率均逐渐增大,特别是60 min内,方铅矿的浸出率增长较快,在60 min时已达到了72.88%。超过60 min后,随着体系中矿物颗粒浓度的降低,矿物浸出率的提升逐渐趋缓。因此,实验优化的电氧化反应时间为60 min。
2.7 温度对铅矿物、铜矿物浸出的影响
实验考查了温度对方铅矿、黄铜矿的电氧化浸出行为影响,结果见图8。实验条件:pH为5.7,固液比0.02 g/mL,搅拌速度为700 r/min,3 mol/L的NaCl,阳极电流密度为989 A/m2,反应时间为60 min,电压3.8~4.4 V。由图8可以看出,随着温度的变化,矿物的浸出率变化不是很大。因此,实验优化在室温下进行。
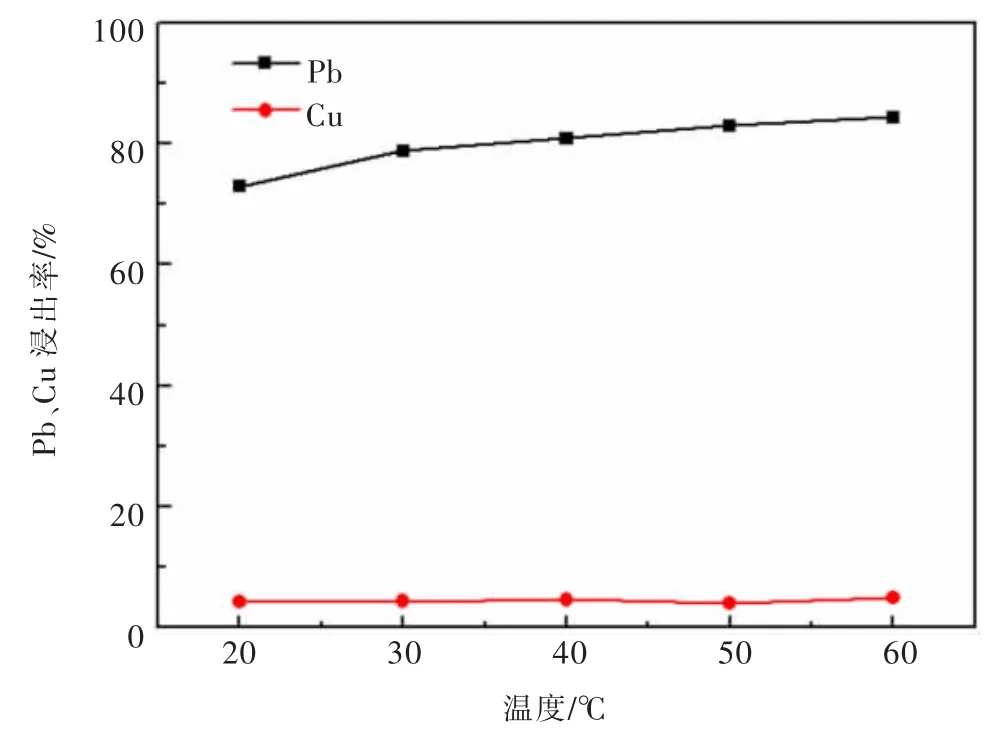
图8 温度对黄铜矿、方铅矿浸出行为的影响Fig.8 The influence of temperature on the leaching behavior of chalcopyrite and galena
2.8 电流密度对铅矿物、铜矿物浸出的影响
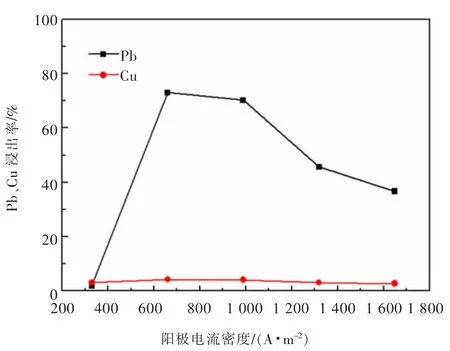
图9 阳极电流密度对黄铜矿、方铅矿浸出行为的影响Fig.9 The influence of anode current density on the leaching behavior of chalcopyrite and galena
实验考查了电流密度对方铅矿、黄铜矿的电氧化浸出行为影响,结果见图9。实验条件:固液比0.02 g/mL,搅 拌 速 度 为700 r/min,温 度 为 室 温,3 mol/L的NaCl,pH 5.7,反应时间为60 min,电压3.8~4.4 V。
由图9可知,阳极电流密度对矿物中金属铜、铅的浸出率有显著的影响。随着阳极电流密度的增大,方铅矿中铅的浸出率先增加后减小。当阳极电流密度为659.4 A/m2时,Pb浸出率达到72.88%。然而,当阳极电流密度继续增大,铅的浸出率逐渐降低。可能的原因是高电流密度条件下,促进了副产物ClO3-的形成,使体系有效的氧化介质浓度降低,进而使方铅矿等矿物的浸出率下降。因此,电流密度太小或太大,均不利于方铅矿的浸出和分离,本实验优化设定阳极电流密度为659.4 A/m2。
2.9 醋酸-醋酸钠缓冲体系中的可能的电极反应
在醋酸-醋酸钠体系中,方铅矿的电氧化浸出过程可能发生一系列反应。其中,氯氧化物的形成存在于阳极(方程(1)和方程(2))。阳极中还存在方铅矿的直接电氧化(方程(4))和析氧反应(方程(3))。由于溶液中存在大量氯离子,氯氧化物的形成是阳极的主要反应。阴极上主要存在的反应是海绵铅的形成(方程(5)),副反应是氢气的析出(方程(6))。实验过程中,由于氯氧化物的形成,氯氧化物在电解液中浸出方铅矿为电解质溶液中的主要反应(方程(7))。如方程(8)所示,过程存在少量酸性浸出。过程中少量的中间体(H2S和S)被迅速氧化成SO42-(方程(9)和方程(10))。
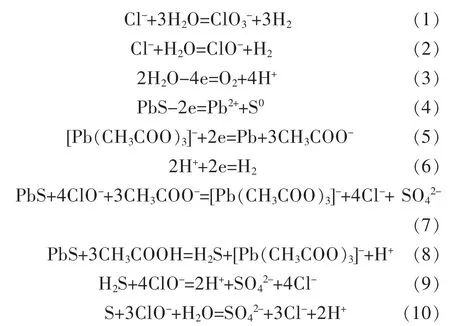
2.10 醋酸-醋酸钠缓冲体系中电解液循环实验
实验条件:CH3COOH-CH3COONa缓冲电解质(pH=5.7),固液比0.02 g/mL,搅拌速度700 r/min,阳极电流密度659.4 A/m2,室温,反应时间60 min,NaCl浓度3 mol/L,槽电位3.8~4.4 V。实验研究了方铅矿、黄铜矿在缓冲电解质中的3次循环实验。每次电氧化浸出试验后,将渣与电解液过滤分离,电解液直接用于下次浸出实验。从表2可以看出,经过3次循环实验,铅、铜的回收率基本保持稳定,并没有下降。每次循环后测试电解质溶液的pH值,结果均在5.5~6.0。因此表明,本实验所构建的CH3COOHCH3COONa缓冲电氧化体系具有良好的工业化应用潜力。

表2 醋酸-醋酸钠缓冲体系中铅精矿和铜精矿的电氧化浸出行为Table 2 Electro-oxidation leaching behavior of galena and chalcopyrite in acetic acidsodium acetate buffer system
3 结论与展望
论文系统研究了醋酸-醋酸钠缓冲体系中铜铅硫化矿物电氧化浸出分离行为。结果表明:
1)醋酸-醋酸钠不仅能维持体系的稳定,还能与铅离子结合形成络合物,强化方铅矿的选择性浸出过程。同时,该技术也显著提升了电氧化体系酸度的稳定性,较大程度上避免了浸出过程有害气体(H2S)的生成,生产过程更为清洁环保。
2)优化的电氧化工艺条件为:固液比 为0.02 g/mL,搅拌速度700 r/min,阳极电流密度659.4 A/m2,常温,反应时间为60 min,氯化钠浓度3 mol/L,外加电压3.8~4.4 V。优化工艺条件下,铅的浸出率达71.55%,铜的浸出率小于1.85%,实现了铅、铜矿物的经济高效分离回收。
综上所述,本文构建的铅、铜硫化矿物电氧化浸出分离体系具有良好的工业化应用前景。
