弱精子症患者精子差异表达蛋白质串联质谱标签技术筛查与生物信息学分析
2020-11-07张盼盼努尔比亚阿力甫毛吾兰买买提依明马文静西尔艾力买买提阿地力江伊明夏米西努尔伊力克童卓云
张盼盼,努尔比亚·阿力甫,毛吾兰·买买提依明,马文静,西尔艾力·买买提,阿地力江·伊明,夏米西努尔·伊力克,童卓云
弱精子症为临床男科常见病之一,属于引发男性不育的主要原因之一。有报道显示,不孕不育发病率约占世界育龄夫妇的15%,其中男性因素约占30%~40%[1]。弱精子症又称为精子活力低下,是指精液中前向运动精子(PR)<32%或前向运动精子(PR)+非前向运动精子(NP)<40%[2]。关于弱精子症的基础与应用领域的研究结果显示,其发病机制复杂,分别与内分泌改变、系统性遗传疾病、氧化应激和相关基因突变及离子通道和蛋白的改变等众多因素相关,给弱精子症的研究带来一定的困难[3-5]。蛋白质作为生命的物质基础,参与生物体的一切生命活动,其在精子的生成、成熟与获能等各阶段亦发挥着重要的生理作用,同时在环境与社会不同致病因素作用下可引起相关蛋白质表达差异,并通过影响相关生物学过程、分子功能和信号通路在弱精子症的发生发展过程中发挥关键性的作用。因此,如何找到弱精子症发生过程中的关键功能分子或指标,并进一步揭示其可能的作用对于基础及转化研究均具有重要意义。本研究采用串联质谱标签(TMT)技术鉴定弱精子症患者精子差异表达的蛋白质,运用生物信息学手段对差异蛋白进行分析,探讨差异蛋白的分子功能和分布以及参与的信号分子通路,为探索弱精子症的致病机制的研究提供新思路,为寻找弱精子症诊断的标志物奠定基础。
1 对象与方法
1.1 研究对象选择2018年6月—2019年3月期间在新疆医科大学第一附属医院产前诊断中心就诊的男性患者为研究对象,手淫法采集精液前需禁欲2~7 d,置于无菌尿杯后转移至恒温水浴箱(37 ℃)中,30 min液化处理后对标本进行精液常规检测。根据精子密度、PR率等检测结果,按照《世界卫生组织人类精液检查与处理实验室手册》(第5版)标准进行诊断,并收集符合正常精液、弱精子症诊断条件的男性精液样本,分别为105例和50例,共155例。随机取正常组和弱精子症患者各30例精子标本,分离精子标本,并进行TMT技术蛋白质组学分析。
1.2 主要试剂与仪器尿素(美国Gibco BRL公司);乙二胺四乙酸盐(EDTA)、苯甲基磺酰氟(PMSF)、二硫苏糖醇(DTT)化学纯和LAM化学纯(美国Promega公司);考马斯亮蓝G250(美国Amesco公司);丙烯酰胺和十二烷基硫酸钠(SDS)(美国Sigma公司);乙酸和乙醇(北京化工厂);甲醇和乙腈(美国Fisher Scientific公司);离心机(Eppendorf公司,型号:5417R);质谱仪(美国Thermo fisher 公司,型号:Q-Exactive)。
1.3 实验方法
1.3.1 精子标本的收集 随机收集各组精液后,1 500×g,离心15 min,弃上清液,加1×磷酸缓冲盐(PBS)3 mL混匀后,1 500×g,离心15 min,弃上清液,重复此步骤3次,收集沉淀即为精子标本,做好标记并储存于-80 ℃冰箱备用。
1.3.2 蛋白提取和浓度测定 精子样品取200 μL,20 000×g,4 ℃离心30 min,弃上清。在沉淀中加入裂解液后进行超声,20 000×g,4 ℃离心30 min后吸取上层清液,按照Bradford试剂盒的说明方法定量蛋白质浓度。
1.3.3 蛋白酶解、肽段标记及HPLC分级 各组精子样品取100 μg,加入到10K超滤管中,1 500×g,以4 ℃的条件离心40 min后弃掉上清液,加入胰蛋白酶(1 μg/μL),每100 g蛋白质底物加入3.3 μg的酶,37 ℃消化24 h后每管加入30 μL四乙基溴化铵(TEAB)复溶肽段。使用TMT试剂盒中的标记试剂TMT-126和TMT-128分别标记正常组和弱精子症患者精子蛋白酶解肽段,标记后加入5%羟胺,孵育15 min,真空抽干混合样品。HPLC预分离(强阳离子交换色谱柱)上述样品后共收集36个组分,根据色谱图结果合并成16个组分后进行质谱检测。
1.3.4 肽段的纯化和质谱检测 采用C18反相色谱柱对16个预分离纯化后的组分除盐后使用Q-Exactive质谱仪进行分析。质谱仪获得的原始数据文件导入到PD(Proteome Discoverer1.4,thermo)软件进行筛选。Mascot搜索PD提取后的谱图,根据搜索结果和筛选后的谱图进行定量分析,并通过ANOVA分析对结果进行差异性评估。对数据库检索得到的所有蛋白质进行分析,以P<0.05,且表达倍数≥1.2或表达倍数≤0.833为标准筛选弱精子症患者差异表达蛋白质。
1.3.5 生物信息学分析 差异蛋白质应用GO数据库分析差异蛋白的生物学过程(biological process,BP)、细胞组分(cellular component,CC) 和分子功能(molecular function,MF)。用KEGG数据库对蛋白质涉及的通路进行聚类并获取差异表达蛋白参与的主要通路。
2 结果
2.1 质谱鉴定与分析结果TMT鉴定结果显示,与正常人精子相比,以P<0.05且表达倍数≥1.2或≤0.833为标准,弱精子症患者差异蛋白共1 020种,上调蛋白606种,下调蛋白414种。以P<0.05且表达倍数≥1.7或≤0.588为标准,差异的蛋白共89种,上调蛋白73种,下调蛋白16种;以P<0.05且表达倍数≥2.0或≤0.5为标准,差异的蛋白共35种,上调蛋白28种,下调蛋白7种。
2.2 差异蛋白GO功能富集分析GO富集分析结果显示,弱精子症患者中精子差异蛋白涉及核转录mRNA分解过程、终止翻译、病毒转录、病毒基因表达、多生物代谢过程、翻译过程的延伸、核转录mRNA分解代谢过程、病毒生命周期、SRP-依赖的膜靶向共翻译蛋白和mRNA分解代谢过程等生物学过程;细胞成分富集主要涉及核糖体、核糖体亚单位、胞质核糖体、细胞内核糖核蛋白复合物、核糖核蛋白复合物、部分胞质、大核糖体亚单位、胞质大核糖体亚单位、小核糖体亚单位和胞质小核糖体亚单位等;分子功能主要涉及核糖体结构成分、结构分子活性、核酸结合、铜离子结合、DNA结合、跨膜受体活性、rRNA结合、溶菌酶活性、质子转运ATP酶活性和受体活性等功能,见图1~3。

图1 弱精子症患者精子差异蛋白生物学过程分析

图2 弱精子症患者精子差异蛋白细胞成分分析
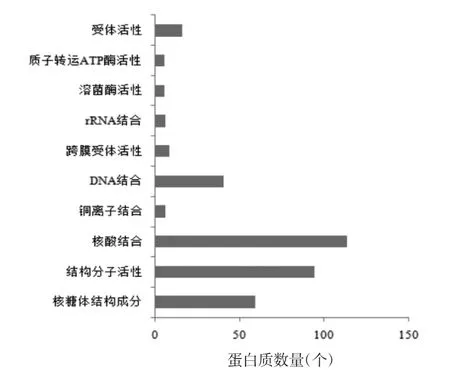
图3 弱精子症患者精子差异蛋白分子功能分析
2.3 差异蛋白的KEGG富集分析对弱精子症患者中精子差异蛋白进行KEGG通路分析,结果显示,差异蛋白匹配到257条KEGG通路,差异蛋白数量最多的前十条信号通路有代谢通路(60种)、核糖体通路(35种)、亨廷顿病通路(15种)、阿尔茨海默病通路(13种)、氧化磷酸化通路(12种)、帕金森病通路(11种)、蛋白酶体通路(10种)、PI3K-Akt信号通路(10种)、AMPK信号通路(9种)、糖酵解/糖异生通路(8种),其中氧化磷酸化通路、AMPK信号通路、糖酵解/糖异生通路网络分析结果见图4~6。其中氧化磷酸化通路复合体I中,NADH脱氢酶[泛醌]铁硫蛋白6(Ndufs6)、NADH脱氢酶[泛醌]1a亚复合物亚基2蛋白(Ndufa2)、细胞色素C氧化酶亚基4蛋白(Ndufa4)上调表达,酰基载体蛋白(Ndufab1)下调表达;复合体Ⅲ中细胞色素b-c1复合物亚基9蛋白(QCR9)上调表达;复合体Ⅴ中ATP合酶亚基α蛋白(alpha)、ATP合酶亚基O蛋白(OSCP)、ATP合酶亚基δ蛋白(delta)、ATP合酶亚基ε蛋白(epsilon)、ATP合酶亚基e蛋白(e)、V型质子三磷酸腺苷酶亚基B蛋白(B)上调表达,V型质子三磷酸腺苷酶亚基E蛋白(E)下调表达。AMPK信号通路中,血小板型和肌肉型ATP依赖性6-磷酸果糖激酶(PFK-1)、Ras相关蛋白Rab-8A、Ras相关蛋白Rab-11B和Ras相关蛋白Rab-14(Rab)和CPT1B蛋白(CPT1)上调表达;真核延伸因子激酶2(eEF2K)、丝氨酸/苏氨酸蛋白磷酸酶2A 55 ku调节亚基Bα亚型(PP2A)和磷脂酰肌醇4,5-二磷酸3激酶催化亚基β亚型(PI3K)下调表达。糖酵解/糖异生通路中,血小板型和肌肉型ATP依赖性6-磷酸果糖激酶(2.7.1.11)、甘油醛-3-磷酸脱氢酶(1.2.1.12)、丙酮酸脱氢酶E1组分亚基α(1.2.4.1)和L-乳酸脱氢酶A链(1.1.1.27)上调表达;磷酸丙糖异构酶(5.3.1.1)、醛脱氢酶家族1成员A3(1.2.1.5)和醛-酮还原酶家族1成员A1(1.1.1.2)下调表达。
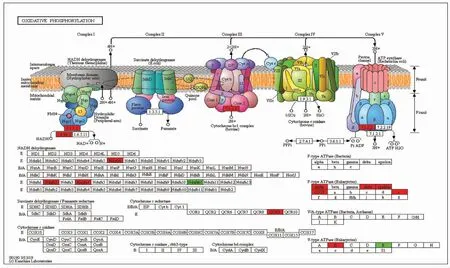
图4 弱精子症患者精子差异表达蛋白质氧化磷酸化信号通路图
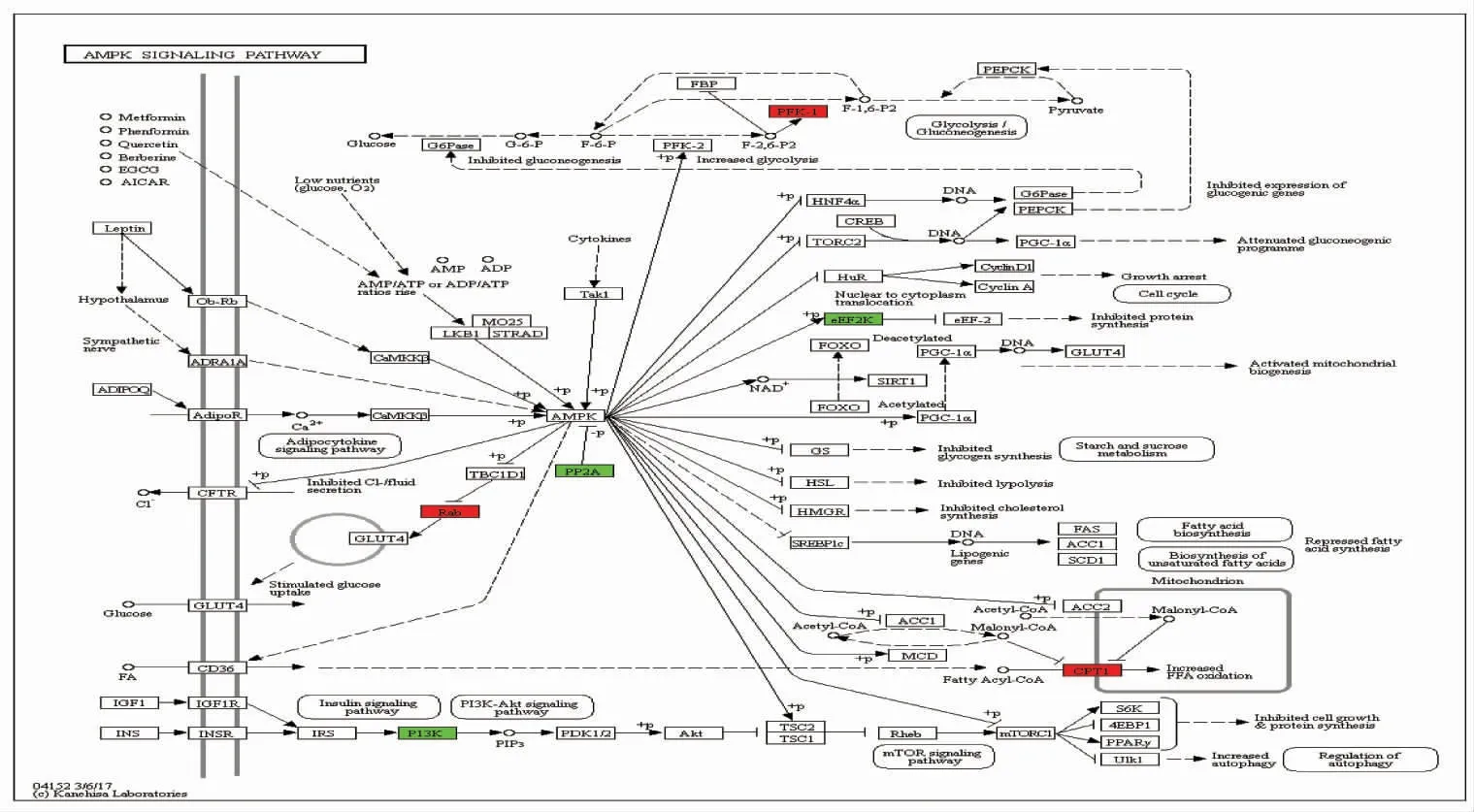
图5 弱精子症患者精子差异表达蛋白质AMPK信号通路图

图6 弱精子症患者精子差异表达蛋白质糖酵解/糖异生信号通路图
3 讨论
全球约有15%的育龄夫妇受到不孕不育的影响,在医疗机构寻求关于男性不育问题的育龄男性达到8%~22%。弱精子症是导致男性不育的主要原因之一,主要表现为精子运动异常[1],其原因与社会、环境和饮食因素改变、工作压力加大、生活节奏加快及生活习惯变化等有关。精子作为人类遗传物质的传递者,其精子质量、数量和形态的正常与否直接影响精子的发育、成熟、获能、运动能力以及受精功能。以往的研究表明,精子在发育、成熟、获能和受精等过程中涉及非常复杂的蛋白质变化,并最终通过相关蛋白质及其信号通路的变化导致精子功能异常。因此,针对弱精子症寻找其特异性蛋白标志物,探明其生殖生物学功能,并进一步开展转化应用研究具有非常重要的意义。
蛋白质组学作为一种高通量技术,属于系统生物学,并于近年来在技术和应用层面获得快速发展,且日趋完善[6-7]。本研究利用TMT技术对弱精子症患者和正常组精子之间的差异蛋白进行了检测,以P<0.05,且表达倍数≥1.2或≤0.833为标准,共鉴定出1 020种弱精子症差异蛋白,上调表达606种,下调表达414种。差异倍数前10位的蛋白质中,下调蛋白-锌指蛋白家族中的锌指蛋白185和锌指蛋白PRDM16蛋白是以往文献报道过的[8-9],主要与精子发生有关。但更多的差异蛋白在弱精子症相关研究领域中并未得到关注,尤其是差异倍数大的含WD重复序列的蛋白质54和抗白细胞蛋白酶可能可以作为弱精子症研究的目标蛋白。GO富集分析结果可知,在生物学过程分类中,弱精子症差异表达蛋白主要参与核转录mRNA分解过程和终止翻译过程。细胞成分与分子功能分类方面差异蛋白主要涉及与核糖体、核糖体结构成分、核酸结合和铜离子结合等。核糖体主要由核糖体RNA及数十种不同的核糖体蛋白质组成,主要功能是提供参与蛋白翻译所需的酶,其中核糖体转移RNA(tRNA)可以在一系列不同的辅助蛋白的协助下将mRNA翻译为蛋白质[10-11]。核糖体数目下降可导致精子多数蛋白质发生变化,进而导致减数分裂进程受阻和精子发生失败机制,但在人类精子中影响核糖体功能变化的蛋白尚不明确,可根据本研究获得的与核糖体功能相关差异蛋白开展进一步研究。对弱精子症患者中精子差异蛋白涉及的KEGG信号通路富集发现,差异蛋白共富集到257条KEGG信号通路,其中氧化磷酸化通路、PI3KAkt信号通路、AMPK信号通路和糖酵解/糖异生信号通路在精子的发生和获能方面的研究中已有报道[12-13]。氧化磷酸化与糖酵解均可以产生ATP,它们是精子的获能过程中必不可少的两种途径,ATP的产生除了在精子头部和鞭毛主段通过糖酵解的方式产生外,在线粒体主要通过氧化磷酸化的方式产生[14-17]。两种途径中,无论哪一种途径受到阻碍,都可影响精子的正常活动。本研究中,弱精子症精子差异蛋白参与氧化磷酸化通路有12种,大多数蛋白为上调蛋白,其中线粒体氧化磷酸化蛋白质,NADH脱氢酶[泛醌]铁硫蛋白、细胞色素C氧化酶亚基NDUFA4和酰基载体蛋白等蛋白质的含量变化可能与精子质量下降密切相关,但仍需进一步验证。研究表明,PI3K-Akt通过不同分子路径调节mTOR信号及其下游靶蛋白p70S6K/4EBP1 的表达,参与调节精母细胞的减数分裂影响精子的发生过程[18]。Fernandez等[19]通过研究发现过氧化物蛋白6(PRDXs6)调节PI3K/AKT途径可以维持精子存活。AMPK通过抑制合成代谢途径和同时刺激分解代谢途径来控制代谢,从而调节细胞能量,它可通过支持细胞的增殖作用参与精子质量的调节,同时参与调节精子活力和顶体反应直接控制精子质量[20-21]。此外,其还具有糖代谢的调控作用[22],调控ATP能量的产生。因此弱精子症中AMPK信号通路异常,包括其中Ras相关蛋白和丝氨酸/苏氨酸蛋白磷酸酶的含量异常均与精子质量下降有关。上述有关AMPK信号通路研究结果,可为进一步揭示弱精子症的发病机制和寻找新的治疗手段提供理论支撑,而本研究富集的其他信号通路在弱精子症的研究中尚少见报道,有待于进一步开展相关研究。
综上所述,本研究通过TMT技术鉴定获得的弱精子症患者精子差异蛋白,并对其进行生物信息学分析,分析差异蛋白参与的生物学过程、主要的分子功能及典型的信号通路,为下一步开展基于创新途径分析(IPA)平台基础上的生物信息深度分析,进一步优化候选蛋白标志物体系,为候选蛋白质单一指标的逐步验证以及相关蛋白质的功能研究等工作奠定了基础。
