成像光谱技术在植物非生物胁迫表型高通量分析中的研究进展
2020-11-04曹晓峰余克强赵艳茹张海辉
曹晓峰,余克强,赵艳茹,张海辉
1. 西北农林科技大学机械与电子工程学院,陕西 杨凌 712100 2. 农业农村部农业物联网重点实验室,陕西 杨凌 712100 3. 陕西省农业信息感知与智能服务重点实验室,陕西 杨凌 712100
引 言
干旱、极端温度、土壤盐害等引发的植物非生物胁迫严重威胁植物种植,环境可持续基础上高效种植植物已经成为普遍要求,这需要可靠的胁迫监测以支撑精准种植和同时加速培育抗逆植物品种,两者都依赖可靠的植物表型分析[1-3]。表型是植物基因型与环境交互的宏观(结构)和微观(生理生化)性状的总和,获取评估植物复杂性状的过程被称为植物表型分析。种植中,表型分析可以有助于了解植物受胁迫程度,优化资源投入;育种中,有助于筛选鉴定具有优良抗性的品种,辅助遗传分析定位关键的遗传因素,为目标环境培育抗逆性更强的植物品种,实现遗传增益[4-6]。现代农业和植物育种需要高通量植物表型数据支持精准决策和基因挖掘[2, 7-8],传统表型分析方法费时费力的瓶颈使具备快速无损等优点的高通量表型分析技术得到了广泛关注,从近距离到卫星尺度的高通量表型平台被用来研究特定条件下植物细胞、植株、群体以及生态系统等水平的表型及变化规律以揭示基因型、环境和表型间的复杂关系,优化种植管理和提高育种效率,被称为现代农业和育种的加速器[9-11],其中成像光谱技术将光谱和成像合二为一能定性定量分析植物结构、生理、生化等表型并评估其空间分布,在高通量植物表型分析中表现出突出潜力[8, 12-14],如图1,在植物育种中,红外(infrared, IR)、可见(visible, VIS)、荧光(fluorescence, FLUO)等成像传感器获取植物高通量表型数据(high-throughput phenotype, HTP),结合植物高通量基因数据(high-throughput genotype, HTG)开展全基因组关联分析(genome-wide association study, GWAS)定位数量性状基因座(quantitative trait locus, QTL)等潜在基因,再利用标记辅助育种(marker assisted breeding)、基因工程(genetic engineering)等现代育种技术进行基因修饰实现作物改良(crop improvement)。由此看出,成像光谱高通量植物表型分析平台架起了沟通植物表型组学(phenomics)和基因组学(genomics)的桥梁[14-16]。
鉴于上述内容,本文回顾近年来在植物种植管理和育种中基于成像光谱高通量分析植物非生物胁迫表型的进展以分析其发展趋势,简单介绍了不同成像光谱技术(可见光成像(RGB imaging)、多/高光谱成像(multispectral/hyperspectral imaging, MSI/HSI)、叶绿素/多光谱荧光成像(chlorophyll/multispectral fluorescence imaging, ChlFI/MFI)和热红外成像(thermal infrared imaging, TIRI))的成像特点和在植物表型分析中的应用特点,然后概述了成像光谱技术高通量分析植物表型的基本流程,总结了近年来不同成像光谱技术高通量分析植物干旱、温度、盐、养分等胁迫表型的部分研究,探讨了上述光谱成像分析植物非生物胁迫表型存在的挑战,并对其发展趋势提了建议。
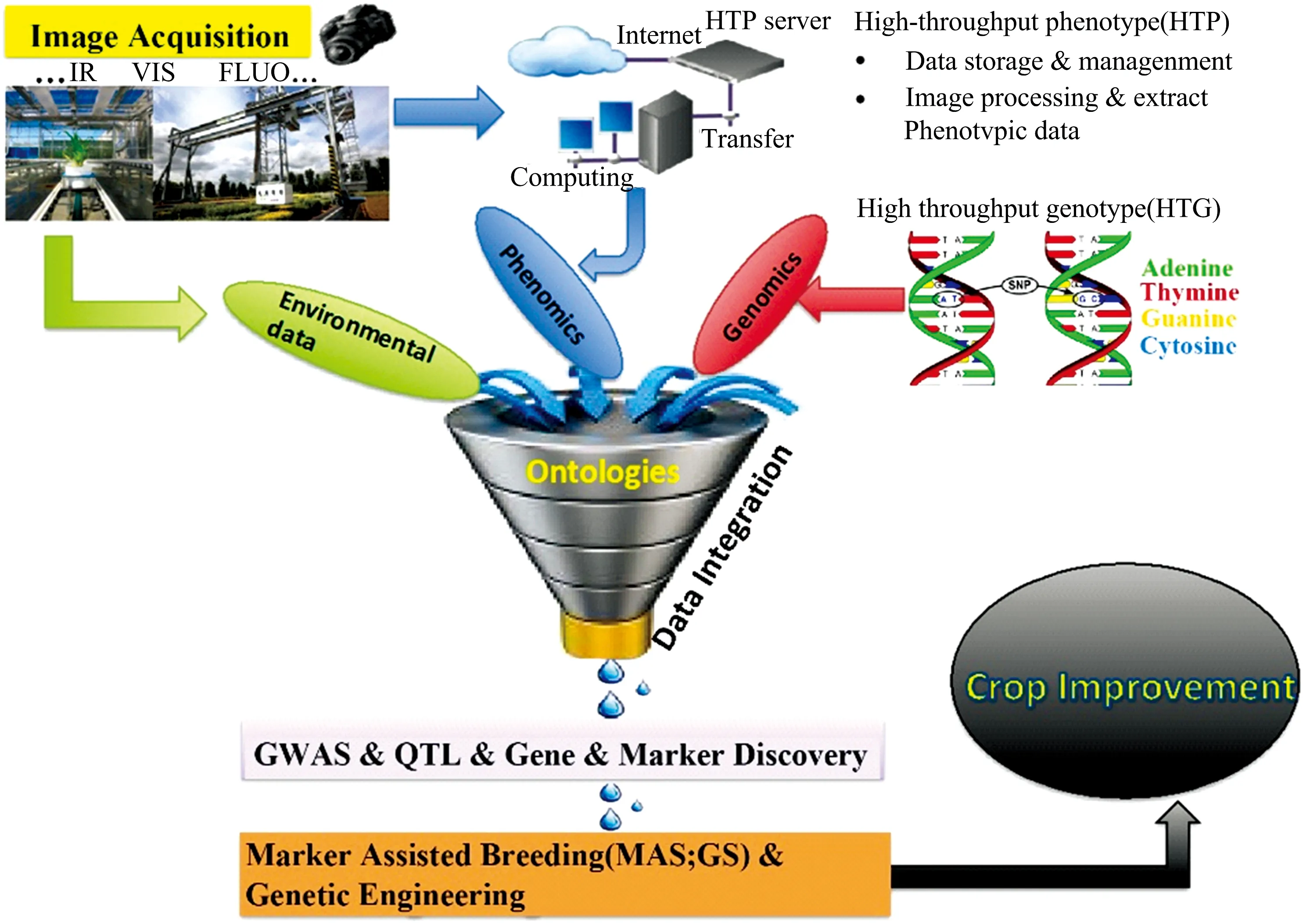
图1 高通量表型平台加速作物改良[14]Fig.1 High-throughput phenotyping platforms accelerate crop improvement[14]
1 成像光谱高通量分析植物表型
光谱成像技术既能利用基于植物因不同状态、成分等与电磁波表现出的不同交互作用(反射、透射、吸收、发射等)的光谱来定性定量分析分析植物表型,同时也能以图像呈现交互强度的空间分布实现对植物表型空间信息的评估[15-16],是便捷的植物表型分析工具。紫外至红外的光谱可以提供丰富的表征植物表型如光合、水分、色素、生物量的光谱信息,为此,紫外至红外光谱范围的常见的成像光谱技术在植物高通量表型分析中得到了广泛应用,不同成像技术的光谱范围和数据的类型存在较大差异,这也决定了不同技术在植物表型分析中的应用特点[17-20],如表1统计。

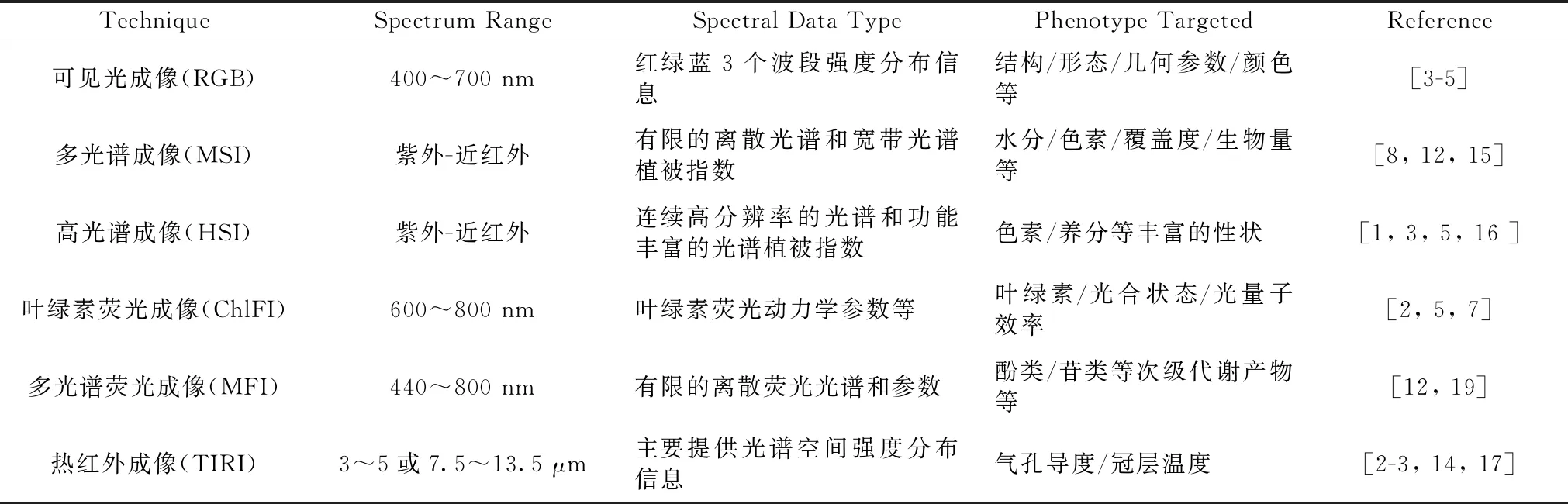
表1 成像光谱技术及其应用特点Table 1 Imaging spectroscopy techniques and their application characteristics
2 成像光谱技术高通量分析植物非生物胁迫表型的进展
非生物胁迫类型多,如干旱、养分缺乏、倒伏、异常温度、盐害,不同胁迫会伴随出现,如盐害造成干旱,高温伴随干旱等[17, 26, 30]。胁迫下植物代谢状态(光合、蒸腾等)和生理成分(色素、水分、激素等)含量会产生变化,持续胁迫会造成植物形态、结构等改变,如叶面积减小,生物量减少,植物衰老或死亡[31-32],所以通过测量和分析植物相关的性状即植物表型分析,可以了解植物受胁迫的状态以及不同植物响应胁迫的差异。加强胁迫治理和培育抗逆品种是缓解和解决胁迫的两种途径,也是成像光谱高通量分析植物非生物胁迫表型应用的主要领域,胁迫治理中主要实现非生物胁迫高通量监测以指导治理措施,在抗逆育种中用于抗逆品种高通量筛选鉴定和高通量测量表型数据辅助遗传分析等。
2.1 植物非生物胁迫高通量监测
有效监测识别胁迫的类型、程度等可以实现水肥药等的按需投入和胁迫精准治理,特别是胁迫早期监测,及时采取措施将胁迫损失和治理成本降至最低。成像光谱技术能提供植物丰富的表型信息,在植物非生物胁迫监测中得到了诸多应用,如表2所示。Rapaport等[33]以高光谱成像研究葡萄干旱下叶片水势、气孔导度和非光化学猝灭与光谱的相关性,530~550和1 500 nm处的光谱能反映表型变化,分析得到3个水分平衡光谱指数预测表型的效果优于已有的指数如光化学植被指数(PRI)、改进归一化植被指数(mNDVI)、结构不敏感色素指数(SIPI)。Yao等[19]利用叶绿素/多光谱荧光成像监测野生型(WT)和突变体(osca1)拟南芥干旱胁迫,分析得到与生理表型相关的特征荧光参数并建立了不同干旱程度的SVM分类模型,胁迫3天和7天的分类准确率分别为93.3%和99.1%,并利用荧光参数(如蓝/绿荧光Blue/Green Fluorescence(BF/GF)参数)图像分析了干旱对光合和代谢响应的空间分布,实现了叶片和冠层的表型的可视化(图2);Wang等[34]用叶绿素荧光和多光谱成像监测番茄干旱、营养缺乏等胁迫,表明合适的荧光参数和反射光谱指数能指示作物生理状态和区分胁迫类型。Simko等[36]以高光谱和叶绿素荧光成像分析生菜冻害、高温、盐胁迫的表型,说明高光谱指数能反映叶绿素和花青素变化,叶绿素荧光可揭示极端温度和盐胁迫对生长和光合的抑制。Song等[37]以日光诱导荧光(SIF)、归一化植被指数(NDVI)和增强型植被指数(EVI)遥感监测热胁迫对冬小麦的影响,分析产量年际变化与SIF,NDVI和EVI的相关性发现SIF的相关性最高(R2=0.8),胁迫早期SIF会显著降低而NDVI和EVI无明显变化。Pandey等[38]利用高光谱成像预测营养胁迫下玉米和大豆水分、大量和微量元素含量,光谱建立的各成分PLSR预测模型中含水量效果最好(R2=0.93, RPD=3.8),大量元素次之(R20.69~0.92, RPD 1.62~3.62),微量元素的精度较低(R20.19~0.86, RPD 1.09~2.69)。Bai等[39]以RGB成像检测大豆缺铁褪绿病(iron deficiency chlorosis, IDC),提取颜色特征建立了IDC的LDA和SVM分类模型,准确度>81%。Raji等[40]利用荧光成像监测香芋和甘薯除草剂/干旱胁迫,红荧光F687和远红荧光F760之比(F687/F760)随胁迫增加而上升,对照、除草剂和干旱下香芋的净光合速率与F687/F760相关系数分别为0.78,0.79和0.78,甘薯分别为0.77,0.86和0.88。
这些研究表明成像光谱可以分析植物多种胁迫下的多样化表型,在一定程度上可以为胁迫监测提供解决方案,胁迫早期的响应通常表现在生理生化等微观的变化,RGB成像适于分析胁迫后宏观表型的变化,对早期未出现症状的胁迫监测存在局限。荧光、红外成像等可以反映植物光合、气孔导度等微观响应的变化,具有监测植物早期胁迫的潜力,但同时也会受到使用条件如暗适应、环境温度的影响。所以需要新的思路解决实际应用存在的问题。
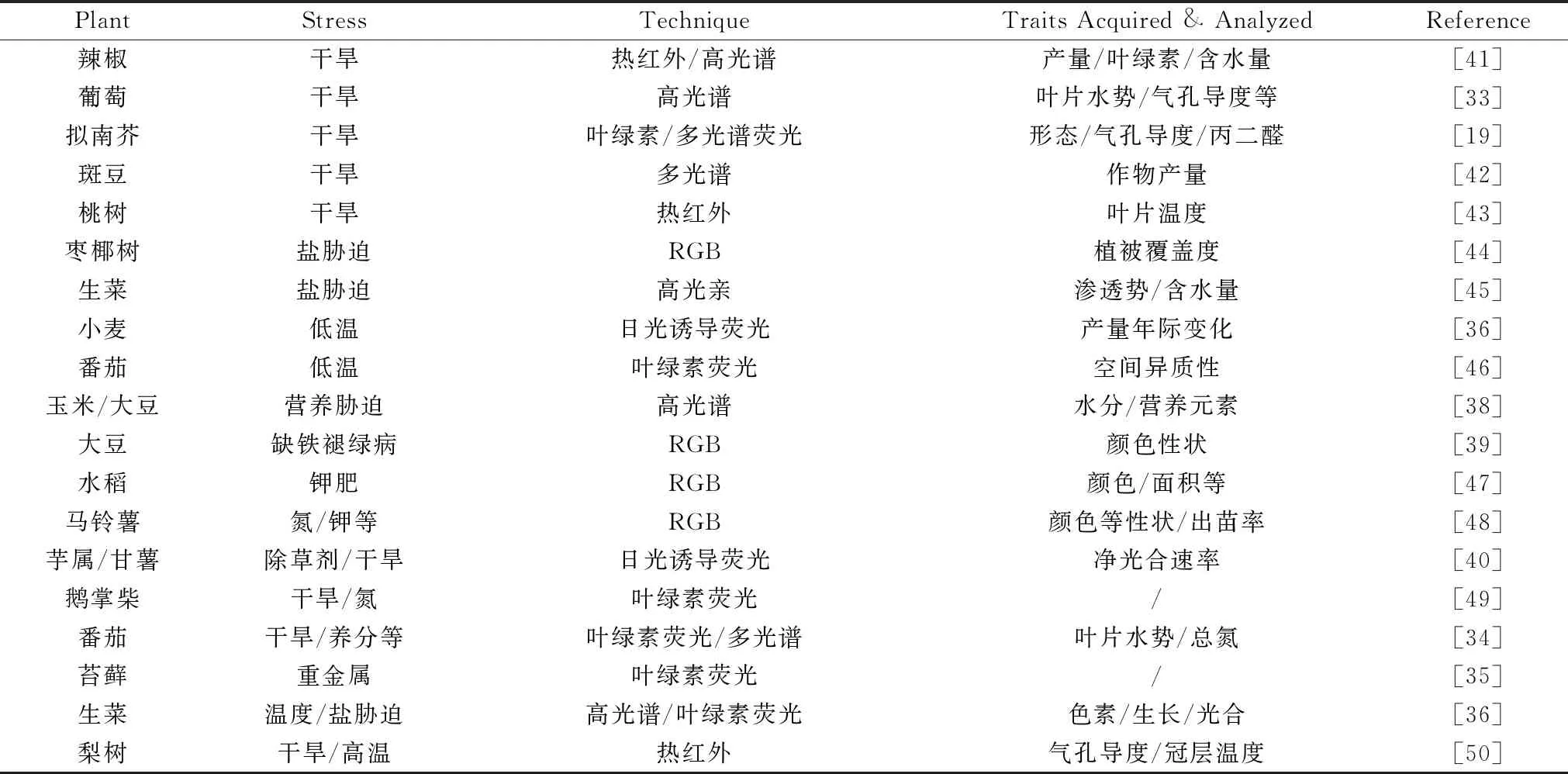
表2 成像光谱技术监测植物非生物胁迫的研究Table 2 Studies on abiotic stress monitoring of plants by imaging spectroscopy

图2 对照和干旱处理的拟南芥BF和GF荧光参数图像下表型的可视化Fig.2 Phenotype visualization under BF and GF of control and drought treated plants
2.2 抗逆植物品种高通量筛选鉴定
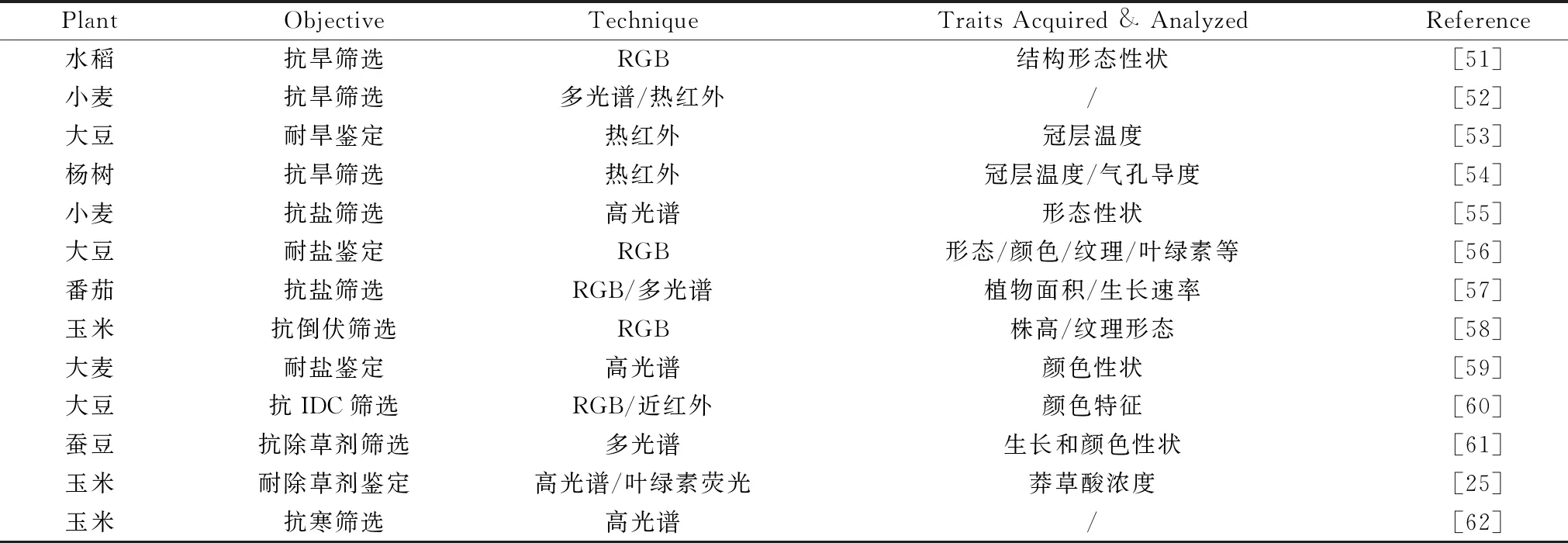
表3 成像光谱技术筛选鉴定植物品种的研究Table 3 Studies on screening & identification of plant varieties by imaging spectroscopy

图3 除草剂处理下野生型和转基因玉米植株草莽酸浓度的可视化
上述研究表明成像光谱可用于多种抗逆性的筛选鉴定,有助于实现品种高通量筛选鉴定,但RGB较难实现品种快速筛选鉴定,荧光、高光谱、热红外等成像可以实现品种快速的筛选鉴定,但荧光有限的光谱范围,只能定量分析光合、叶绿素等有限的性状,高光谱提供了诸多性状的特征光谱信息,可定量分析更多表型,但同时也面临信息冗余和数据处理的挑战,所以不同技术融合开展全面、精细的品种筛选鉴定可以作为后续研究的参考。
2.3 高通量表型辅助遗传分析
高通量基因测序的发展使得获取高通量基因数据不再受限,但解析基因的功能和定位基因区域需要大量的表型数据,成像光谱技术快速准确地测量高通量表型数据,可为遗传功能解析和基因定位(GWAS定位QTL等)提供大数据支持[1, 63-64]。Condorelli等[65]用无人机和地面多光谱成像测量248种小麦不同水分下的NDVI光谱数据开展GWAS,分别定位到22和16个影响NDVI的QTL,表型方差分别占89.6%和64.7%;Dhanagond等[66]利用可见光成像连续长期测量大麦随干旱持续的生物量并计算其生长模型结合GWAS揭示大麦抗旱和干旱恢复的基因区域,发现生物量的QTL可以分为组成生物量QTL、干旱适应性QTL和恢复适应性QTL,揭示并定位了不同类型的QTL分布的不同位置。Chen等[67]用无人机、地面可见/多光谱成像估计450种小麦冬季田间条件下的存活率、量化品种间存活差异,结合GWAS定位提高冬季存活率的关键遗传因素,发现了7个抗冻QTL;Wang等[68]以无人机成像预测的玉米株高数据开展GWAS分析,定位到7个与株高相关性状的68个QTL,其中35%的QTL与已发现的一致,这些证明了成像光谱技术精准预测表型辅助基因定位的潜力,有助于抗旱、冻和倒伏等育种。
此外,成像光谱技术无损可重复测量表型的优点能帮助揭示植物逆境的遗传变异和增加对植物响应胁迫过程的理解,有助于最终确定潜在的关键遗传因素。Klem等[69]以热成像和反射光谱揭示6种拟南芥干旱下生长减少和气孔关闭两个过程的基因型特异性,共鉴定出生长和光饱和CO2同化率3种不同表现的基因型类型;Enders等[70]利用RGB成像分析玉米恢复低温胁迫的遗传机制,量化和表征了40种玉米幼苗随胁迫持续的表型动态变化和从胁迫中恢复的过程,并用层次聚类比较了不同基因型的恢复能力;Awlia等[71]利用RGB和叶绿素荧光成像分析3种浓度NaCl下拟南芥的响应特性,发现100 mmol·L-1NaCl处理的响应最显著,胁迫对形态有显著影响,但对颜色和光合效率影响不明显,对植株生长和荧光性状聚类发现胁迫早期耐性与非光化学猝灭相关,后期耐性与量子产量相关。
以上研究可以看出在遗传分析中获取准确和可重现的表型数据是分析遗传因素的基础和关键,所以如何建立更稳定、更高精度、更快速的目标表型预测模型值得深入研究。
3 结论与展望
介绍了可见-红外光谱范围的成像光谱高通量分析技术在植物非生物胁迫表型分析中的研究进展,总结了成像光谱技术在植物非生物胁迫监测、抗逆品种筛选鉴定以及遗传分析方面的相关研究,可以看出成像光谱技术能够有效的为植物种植管理和育种提供丰富的表型信息,集成光谱分析、图像处理和机器学习并融合植物科学的知识可以成为支撑高通量分析植物非生物胁迫表型的理想工具来服务于植物种植和育种等农业实践。
不能忽视的是上述技术分析自然条件下植物地上部分具有优势,但对地下根系存在局限;高精度成像传感器(如高光谱,叶绿素荧光)的成本限制了其推广或现场部署;如何将光谱成像产生的表型大数据转化为种植和育种的有效参考等也是成像光谱技术在植物非生物胁迫表型分析中面临的一些挑战,所以融合更多的成像光谱技术如核磁共振、太赫兹成像等,更全面地分析植物表型;研发低成本、易推广的高通量表型平台;开发有效的表型大数据挖掘算法和高通量分析框架等可以作为后续的突破方向。
