蒲公英提取物对SK-BR-3、T47D 乳腺癌细胞增殖的影响
2020-11-04田苗苗修海楠宋明洋刘树民
田苗苗,刘 扬,修海楠,宋明洋,刘树民
(黑龙江中医药大学中医药研究院,哈尔滨 150040)
当今乳腺癌疾病已经跃居女性恶性肿瘤的首位,其严重危害了当代女性的生命健康[1]。近年来,利用中药活性物质治疗各类肿瘤的实验已成为生命科学领域研究的热点,许多中草药及其提取物已被证实具有良好的防治乳腺癌的作用[2-3]。现研究表明蒲公英活性成分主要为多糖、萜类、黄酮、植物甾醇、酚酸、内酯、香豆素等[4-5],其在乳腺癌治疗方面体现出良好的苗头[6]。蒲公英为菊科植物蒲公英Taraxacum mongolicum Hand.Mazz、碱地蒲公英的干燥全草。其味苦、甘,性寒。功效为清热解毒,消肿散结,利尿通淋。可应用于疔疮肿毒,乳痈,瘰疬,咽痛,肠痈,热淋涩痛[7]。本实验主要选择了蒲公英水煎液、蒲公英多糖、蒲公英萜醇3 种提取物进行实验,观察其对乳腺癌细胞增殖的抑制作用。
1 材料与方法
1.1 实验材料 蒲公英(由黑龙江中医药大学中医药研究院提供);蒲公英萜醇购自于上海广锐生物科技有限公司(批号:180402)。实验前用DMEM 完全培养液溶解制成相应浓度药液供使用。蒲公英全草干燥后粉碎过40目筛,用石油醚连续回流6 h,残渣按照1:20料液比,85 ℃水提2.5 h,提取2 次,Sevag 法除蛋白,药液以85%乙醇沉淀,离心取沉淀物,无水乙醇洗涤数次,水复溶后冷冻干燥,即得蒲公英粗多糖[8-9]。按下式计算多糖得率:多糖得率=多糖质量/蒲公英干燥全草质量×100%[10],多糖得率为4.54%。蒲公英全草,按1:20 料液比,90 ℃水提2 次,每次2 h,蒲公英水煎液出粉率21.82%。人乳腺癌T47D 细胞购于中科院上海细胞库;人乳腺癌SK-BR-3 细胞购于ATCC 细胞库。T47D、SK-BR-3 乳腺癌细胞均用含10%胎牛血清及1%双抗的DMEM 高糖培养液培养,放置于5%CO2,37 ℃的恒温水浴培养箱中,选择状态最佳的细胞进行细胞计数,使细胞的最终密度为5×104/mL。DMEM高糖培养液(批号:8118245)、胎牛血清(批号:1739463)购自美国Gibco 公司,PBS 缓冲液(批号:170919)购自北京博奥拓达科技有限公司,双抗(批号:171019)购自上海基实有限公司,胰蛋白酶(批号:090617171012)、细胞凋亡检测试剂盒(批号:060818181029)购自碧云天有限公司,CCK-8 检测试剂盒(批号:LK815)购自日本同仁化学研究所。二氧化碳培养箱(上海一恒科学仪器有限公司);倒置显微镜(奥林巴斯科技有限公司);离心机(湘仪集团有限公司);高压蒸汽灭菌锅(上海博迅医疗生物仪器股份有限公司);流式细胞仪(默克密理博有限公司);RTCA 细胞实时监控仪(赛默飞世尔公司)。
1.2 实验方法
1.2.1 CCK-8 检测细胞增殖抑制率 将密度为5×104/mL的细胞以每孔100 μL 接种于96 孔细胞培养板中,补足培养液,24 h 后将3 板细胞分别随机分为7 组,即空白对照组、蒲公英水煎液25、50、100、150、200、300 mg/mL 组;空白对照组、蒲公英多糖6 个浓度组,25、50、100、150、200、300 mg/mL 组;空白对照组、蒲公英萜醇6 个浓度组,25、50、100、150、200、300 μmol/L,每组5 个复孔。加药结束后继续培养48 h,将各组细胞改用终浓度含10% CCK-8 的培养基进行温育2 h,随后在酶标仪450 nm 处读取吸光度(OD)值。
1.2.2 实时xCELLigence 细胞分析系统监测细胞增殖毒性 基线检测所有孔Cell Index 低于0.063,将密度为5×104/mL 的T47D、SK-BR-3 细胞悬液以每孔100 μL接种于E-Plate 16 板中,室温放置30 min。开始Step2(24 h检测细胞增殖曲线),24 h 后给予药物,药物浓度,同2.1,开始Step3,检测48 h 内细胞增殖毒性。
1.2.3 细胞划痕愈合实验 在6 孔板背后,间隔0.5 cm均匀划5 条直线,每孔加入约1×105个T47D 乳腺癌细胞,24 h 后制造划痕,用PBS 溶液冲洗,加入不同浓度的蒲公英萜醇同2.1 继续培养。按0,24,48 h取样,拍照测量划痕宽度,计算各药物浓度组细胞迁移抑制率。
1.2.4 细胞凋亡检测 将T47D 细胞以1×105/mL 接种至6 孔细胞培养板中,将状态良好的细胞随机分为7 个蒲公英萜醇终浓度组,同2.1。待加样结束后继续培养48 h,清洗、消化、离心弃上清液,吸取100 μL Binding buffer 加入至上述各离心管中,随后加入5 μL AnnexinV-FITC,室温下避光温育l0 min,向上述离心管中加入1 μLPI (100 μg/μL)染色液,避光反应5 min,再加入400 μL 结合缓冲液,运用流式细胞仪进行检测。
1.2.5 统计学分析 采用SPSS 18.0 软件对本实验的数据进行单因素方差分析,数据以均数±标准差()表示。
2 结果
2.1 CCK-8 检测细胞增殖抑制率 由表1 可知T47D乳腺癌细胞经3 种药物作用48 h 后,蒲公英萜醇50~300 μmol/L 组与对照组比较有显著抑制作用(P<0.05或P<0.01),最高抑制率可达67.19%;蒲公英多糖100~300 mg/mL 组与对照组比较抑制作用显著(P<0.05 或P<0.01),但抑制作用较蒲公英萜醇弱;蒲公英水煎液100~300 mg/mL 组与对照组比较有较显著的抑制作用(P<0.05),其抑制作用最弱。
表1 蒲公英提取物各药物浓度组对T47D 细胞增殖的影响(,n =5)
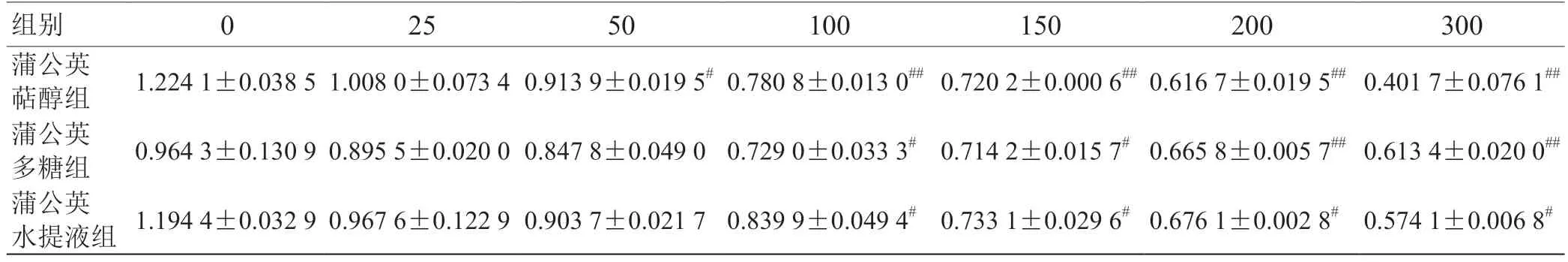
表1 蒲公英提取物各药物浓度组对T47D 细胞增殖的影响(,n =5)
注:与对照组比较,# P <0.05,## P <0.01
由表2 可知SK-BR-3 乳腺癌细胞经3 种药物作用48 h 后,蒲公英萜醇100~300 μmol/L 组与对照组比较有显著抑制作用(P<0.05 或P<0.01),其最大抑制率为43.15%;蒲公英多糖100~300 mg/mL 组与对照组比较抑制作用显著(P<0.05);蒲公英水煎液100~300 mg/mL组与对照组比较有显著抑制作用(P<0.05 或P<0.01),蒲公英萜醇对SK-BR-3 乳腺癌细胞增殖的抑制作用较蒲公英多糖和蒲公英水煎液强。
表2 蒲公英提取物各药物浓度组对SK-BR-3 细胞增殖的影响(,n =5)

表2 蒲公英提取物各药物浓度组对SK-BR-3 细胞增殖的影响(,n =5)
注:与对照组比较,# P <0.05,## P <0.01
2.2 实时xCELLigence 细胞分析系统监测细胞增殖毒性 由图1、2、3 可知T47D 乳腺癌细胞经药物作用后,各药物浓度组与对照组比较对乳腺癌细胞增殖均有一定的抑制作用,且呈剂量依赖性。蒲公英萜醇对T47D乳腺癌细胞增殖的抑制作用最强,72 h 时抑制率可达到70.50%。

图1 蒲公英萜醇组T47D 细胞增殖曲线

图2 蒲公英多糖组T47D 细胞增殖曲线
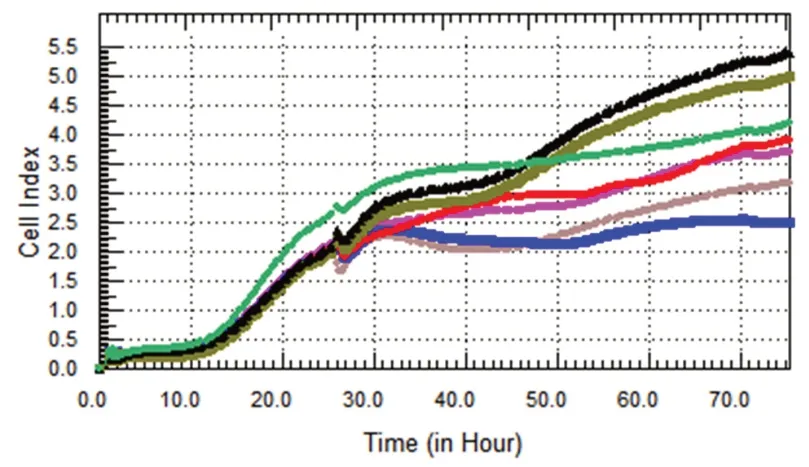
图3 蒲公英水煎液组T47D 细胞增殖曲线
由图4、5、6 分可知SK-BR-3 乳腺癌细胞经药物作用后,各药物浓度组与对照组比较均有显著的抑制作用,且呈剂量依赖性。蒲公英萜醇对SK-BR-3 乳腺癌细胞增殖的抑制作用最强,72 h 时抑制率可达45.67%。
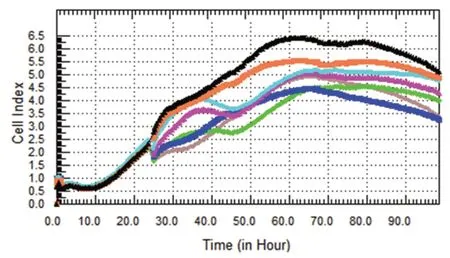
图4 蒲公英萜醇组SK-BR-3 细胞增殖曲线

图5 蒲公英多糖组SK-BR-3 细胞增殖曲线
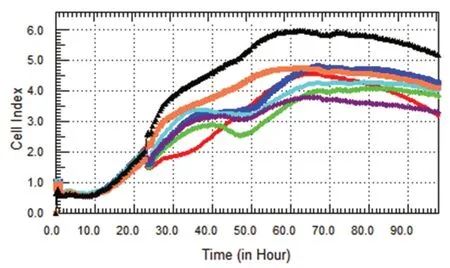
图6 蒲公英水煎液组SK-BR-3 细胞增殖曲线
2.3 细胞划痕愈合实验 T47D 乳腺癌细胞划痕经不同浓度蒲公英萜醇作用24、48 h 后,各浓度组与对照组比较均有一定的抑制作用,且呈剂量依赖性和时间剂量依赖性。蒲公英萜醇(100~300 μmol/L)作用48 h 后,T47D 乳腺癌细胞划痕愈合显著被抑制,最大迁移抑制率可达74.43%。见图7。
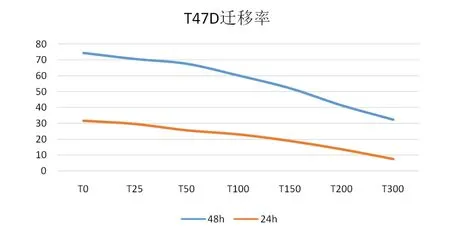
图7 蒲公英萜醇对T47D 乳腺癌细胞划痕愈合的影响
2.4 细胞凋亡检测实验 经蒲公英萜醇作用48 h 后,各浓度组与对照组比较T47D 细胞凋亡率均有一定程度增加,且呈剂量依赖性。蒲公英萜醇(100~300 μmol/L)组作用48 h 后诱导T47D 乳腺癌细胞凋亡作用显著,见图8。
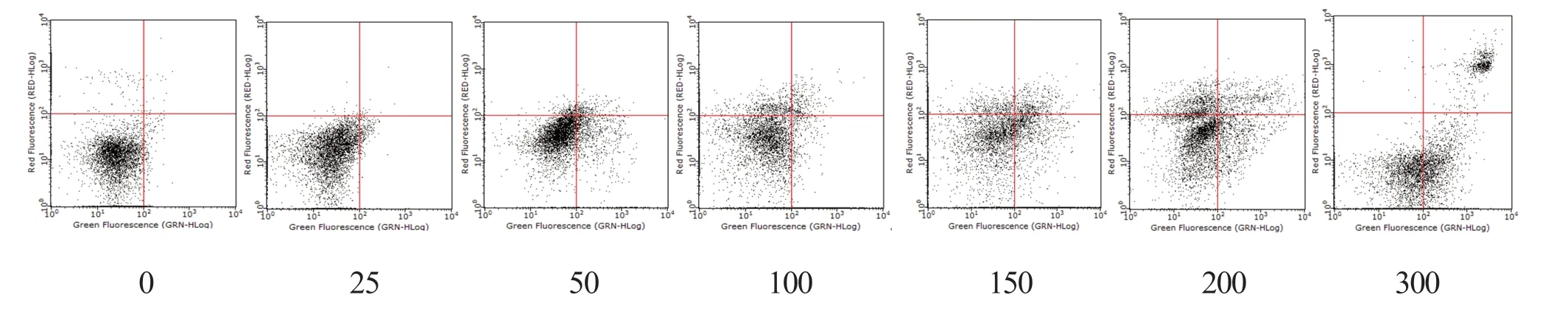
图8 蒲公英萜醇对T47D 乳腺癌细胞凋亡的影响
3 讨论
乳腺癌是生长于乳腺腺泡上皮或者乳腺导管内上皮的恶性肿瘤,发病率和病死率居于当今女性肿瘤的首位[11],虽然有关乳腺癌的临床实验研究已经取得了一定的进展,但乳腺癌患者的病死率仍持逐年上升状态[12]。PR、ER、Her-2 在乳腺癌的发病过程中起到一定作用,针对受体表达状态,浸润性乳腺癌大致可分为3 种分子亚型,LuminalA、B 型,三阴型和Her-2 过表达型[13-14]。不同细胞亚型的乳腺癌治疗方案有所不同,ER 阳性主要采用内分泌治疗法,Lumina A 型只进行内分泌治疗,就能得到良好的治疗效果[15-16];而ER阴性,Her-2 高表达的乳腺癌可以针对Her-2 因子靶向治疗[17-18],但由于三阴性乳腺癌肿瘤恶化程度较高,采用内分泌治疗基本无效,同时缺乏有效的治疗靶点[19-20],现主要采用化疗法治疗,药物治疗效果不明显,所以本实验未选取三阴型乳腺癌细胞。本实验选取蒲公英水煎液、蒲公英多糖、蒲公英萜醇分别作用于雌激素依赖Luminal 型T47D 乳腺癌细胞、Her-2 过表达型SK-BR-3 乳腺癌细胞,进行蒲公英提取物抑制乳腺癌细胞增殖作用的初筛。
3 种提取物对乳腺癌细胞的增殖均有一定抑制作用,CCK-8 增殖检测实验和细胞增殖毒性检测结果显示单体蒲公英萜醇抑制乳腺癌细胞增殖作用更为明显,50 μmol/L 时抑制率可达26.49%,最高抑制率可达70.50%,蒲公英多糖和水煎液组相对抑制率较低。蒲公英各种成分对乳腺癌细胞增殖的抑制作用呈现一定的差异性,蒲公英其他成分是否具有抑制乳腺癌细胞增殖的作用,还有待进一步研究。同时实验发现3 种提取物对T47D 细胞增殖的抑制作用明显高于对SKBR-3 细胞的抑制作用。T47D 细胞属于雌激素依赖型乳腺癌细胞,有研究表明内分泌疗法成为一种重要的治疗激素依赖型乳腺癌的疗法,推测蒲公英很可能通过调节T47D 乳腺癌细胞雌激素受体ER,从而达到抑制癌细胞异常增殖的作用。由于SK-BR-3 细胞中Her-2呈过表达状态,需要针对Her-2 因子靶向治疗,才能得到更好的治疗效果,蒲公英提取物对其的抑制作用较对T47D 细胞的抑制作用弱。因此划痕愈合实验以及凋亡诱导实验只选取蒲公英萜醇作为实验研究药物,T47D 乳腺癌细胞作为实验研究对象,实验结果显示蒲公英萜醇可通过抑制T47D 乳腺癌细胞迁移并诱导其凋亡,从而抑制乳腺癌细胞增殖,但相关的凋亡通路还有待进一步实验研究。
中药发挥抗肿瘤作用是多环节多靶点的,且其作用的机制十分复杂[21-22]。能够进一步明确蒲公英提取物对乳腺癌不同环节的作用机制,对今后更深入研究蒲公英对乳腺癌的治疗作用有很大帮助。蒲公英不同药用部位的提取物对乳腺癌细胞的增殖是否具有同样的抑制作用,以及所含的不同成分对同种类型乳腺癌治疗作用的平行性差异都应进行更深入的实验研究。蒲公英作为抗肿瘤的天然药物,仍具有很大的药用研究潜力,其治疗乳腺癌的机制可能是今后此类实验研究的重点。
