MALAT1在肠癌中的表达、生物学功能及其与患者预后关系
2020-11-04姚坤厚张军杰王朝阳秦长江
姚坤厚,张军杰,王朝阳,秦长江
河南大学淮河医院 普外科,河南 开封 475000
肺腺癌转移相关转录物1(MALAT1)定位于人染色体11q13,全长约8 500 bp,最初发现其高度特异性表达于肺腺癌,干扰其表达后可显著抑制肺腺癌细胞迁移能力,并由此得以命名[1]。MALATl是较早发现的一类与转录本加工有关的长链非编码RAN(LncRNA)。2003年JI及其同事[1]在对非小细胞肺癌患者的组织标本进行研究时发现,在转移患者的组织中,MALAT1 表达水平明显高于非转移组织。此后的功能学研究[2]显示,MALAT1 由DNA 转录后的3’端加工而来,其主要位于剪切斑点附近。MALAT1可与丝氨酸/精氨酸(Ser/Arg)剪接因子间存在相互作用,并还通过调控剪接因子在剪接斑点中的分布和磷酸化水平,使mRNA 前体的选择性剪接模式发生改变从而达到调控转录本剪接模式的分子生物学功能。MALAT1被认为是与肺癌转移相关的重要LncRNA。在肺癌转移病灶中,MALAT1的表达水平显著增高,因而推测其与肺癌的发生转移有关。进一步采用基因敲除技术研究显示,MALATl可对转录后调节运动相关基因的表达进行调控,如螺旋重复胶原蛋白1(CTHRCl)、真核细胞伴侣素(CCT)、透明质酸调节运动受体(HMMR)、分节因子1(RODl),而这些基因对细胞的迁移有重要作用。但关于MALAT1在肠癌组织中的表达情况及其与肠癌发生发展、侵袭转移的相关研究鲜有报道。近来研究表明,MALAT1在多种不同类型的恶性肿瘤中均有异常表达,其中包括结直肠癌[3-4]。功能学实验也已表明,MALAT1在结直肠癌细胞的侵袭和转移中发挥重要作用[5],然而,MALAT1参与调控结直肠癌转移的分子机制仍需进一步研究,以期更深入全面地理解该RNA 在结直肠癌中发挥功能的机理,为结直肠癌后期治疗新方案的研发提供理论依据。
1 材料与方法
1.1 临床组织样本
选取病理学确诊的肠癌患者30例,留取患者的癌组织和远癌的正常组织。
1.2 细胞和主要试剂
于美国ATCC 购买人肠癌细胞系(SW620、LOVO、HCT116)和正常人肠上皮细胞系(NCM460),培养基进行培养传代。
1.3 MALAT1表达水平检测
对30例患者的癌组织和远癌的正常组织首先采用RNA 提取试剂盒提取总RNA,并采用反转录试剂盒将RNA 反转录为cDNA,进一步应用实时荧光定量 PCR 方法,检测患者癌组织和远癌正常组织中MALAT1 的表示水平,比较MALAT1 在肠癌患者癌组织及远癌正常组织中是否存在表达差异。将培养好的人肠癌及正常肠上皮细胞系进行总RNA 提取,并反转录为cDNA 后采用实时荧光定量 PCR 进行测定上述细胞系中MALAT1的差异表达情况,评价肠癌细胞系和正常肠上皮细胞系中MALTA1是否存在差异表达。
1.4 下调MALAT1表达
由深圳吉玛公司合成针对MALAT1的小干扰RNA,采用脂质体(lipo2000)转染技术转染至人肠癌细胞系(SW620、LOVO、HCT116)和人正常肠上皮细胞系(NCM460),然后采用实时荧光定量 PCR方法检测转染前后MALAT1的表达水平,检测下调其表达效果。
1.5 实时荧光定量PCR
组织或细胞在Life Technologies 公司的Trizol试剂下裂解,经氯仿混合震荡离心,再经异丙醇沉淀,提取的总RNA 放置于-80 °C冰箱保存。经过定量,利用Promega公司的反转录试剂盒将RNA反转录成cDNA,并稀释待用。利用Toyobo公司的SYBR GREEN MASTER MIX,在ABI 7500 96孔实时荧光定量PCR 仪上进行实验,定量检测MALAT1的表达情况。
1.6 增殖和迁移能力
检测MALAT1对肠癌细胞增殖和迁移能力的影响,在肠癌细胞中采用小干扰RNA 技术下调MALAT1表达,采用细胞计数法判断下调MALAT1前后细胞增殖能力变化,应用划痕实验和侵袭力实验,探讨下调MALAT1前后细胞迁移能力变化。
1.7 生存分析
在TCGA 数据库中[6-7],根据MALAT1 中位表达水平分为高表达组(≥ 中位表达水平)和低表达组,logrank检验分析高、低表达组总生存和无疾病进展生存是否存在差异。
1.8 统计分析
统计分析采用Stata 12.0软件完成。定量数据均采用±s表示,两组之间比较采用配对t检验或成组t检验,生存分析采用logran 检验,以P<0.05 判断差异有统计学意义。
2 结果
2.1 肠癌患者癌组织与远癌组织中MALAT1的表达
利用实时荧光定量PCR 技术检测了30对人配对结直肠癌组织标本中MALAT1 的表达水平。结果显示相比正常组织,MALAT1 在46.7%(14/30)的结直肠癌组织中的表达增高(P<0.05),具有统计学差异,见图1A。Oncomine数据库中,结直肠癌患者癌组织中MLAT1表达水平高于癌旁组织,见图1B。
2.2 MALAT1 在肠癌及正常肠上皮细胞系中的表达
实时荧光定量 PCR 检测肠癌细胞系及正常肠上皮细胞株中MALAT1的相对表达水平,结果显示,肠癌细胞系中(SW620、LOVO、HCT116)MALAT1的相对表达量显著高于正常人肠上皮细胞(NCM460),差异有统计学意义(P<0.05),见图2。
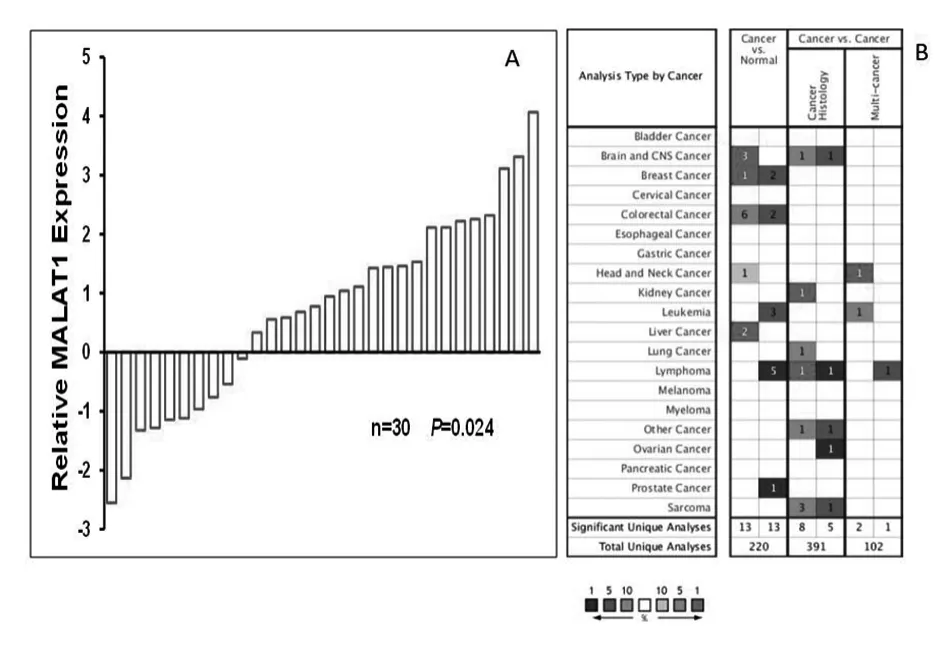
图1 实时荧光定量PCR 检测MALAT1在肠癌组织中的表达情况
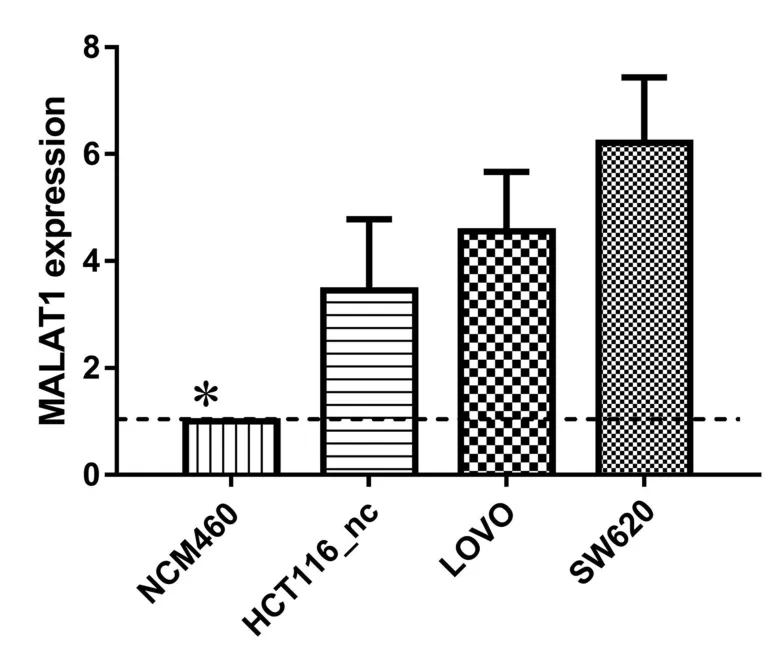
图2 MALAT1在肠癌及正常肠上皮细胞系中的表达
2.3 抑制MALAT1表达可抑制SW620细胞的迁移与侵袭能力
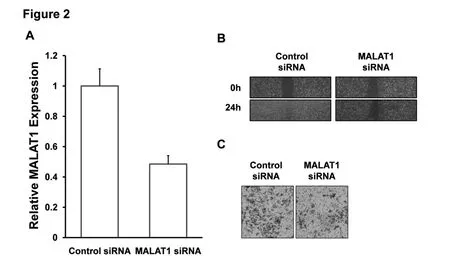
图3 抑制MALAT1表达对SW620细胞的迁移与侵袭能力的影响
利用从吉玛公司设计的能够特异性沉默MALAT1的siRNA 转染SW620细胞,在48 h后,先收集细胞抽提总RNA,经反转录和实时荧光定量PCR 检测,MALAT1 具有很好的沉默效果(见图3A)。再次转染SW620细胞,在24 h后消化细胞,分别铺入6孔板和24孔板进行细胞划痕实验和小室侵袭实验,48 h 后,分别拍照划痕宽度结果和小室染色结果。实验发现,抑制MALAT1 表达可明显抑制SW620细胞的划痕迁移与小室侵袭能力(见图3B、图3C)。
2.4 MALAT1共表达分析
在结直肠癌组织中,与MALAT1共表达基因为ANKRD11,THRAP3,C10orf118等,其共表达聚类分析见图4。
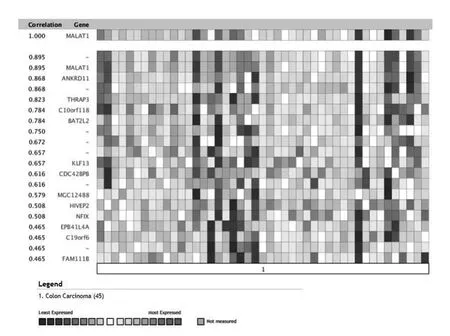
图4 MALAT1共表达基因聚类分析
2.5 MALAT1 在肠癌中的表达及其与患者预后关系
MALAT1表达的高低患者总生存(OS)差异无统计学意义(HR=1.2,P=0.35),见图5。而高低表达组无疾病进展生存(DFS)差异有统计学意义(HR=1.6,P=0.023),MALAT1高表达组DFS显著低于低表达组,见图6。

图5 MALAT1在肠癌中的表达及其与患者总生存(OS)关系
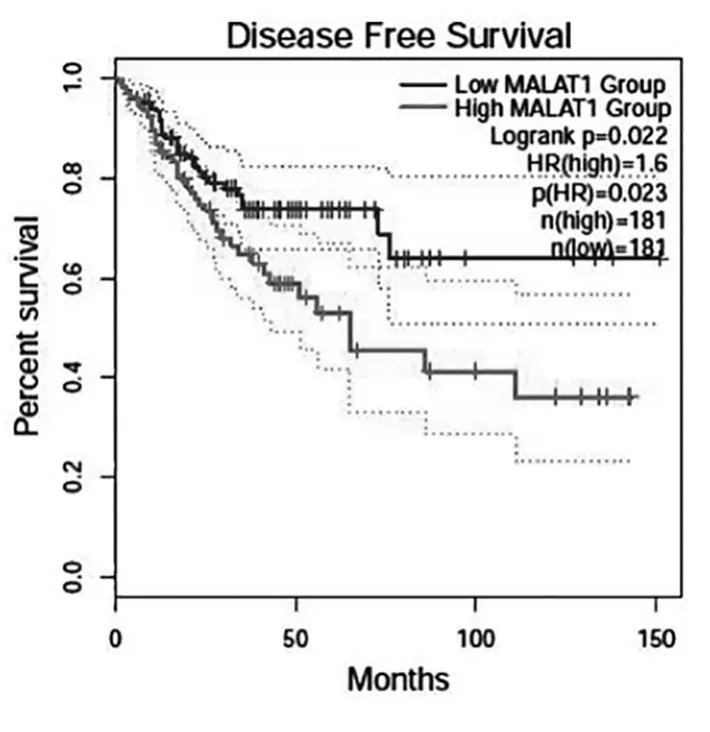
图6 MALAT1在肠癌中的表达及其与无疾病进展生存(DFS)关系
3 讨论
结直肠癌是最常见的消化道恶性肿瘤之一,其发病率居世界常见恶性肿瘤第3位,结直肠癌在我国居恶性肿瘤致死因素的第4位[8],严重危害人类健康。随着环境和饮食剧变,在我国,结直肠癌的发病率和死亡率分布具有以下特点:男性高于女性,城市高于农村,发病率和死亡率均随年龄增长而上升。手术后局部复发和远端转移是导致患者预后差的主要原因[9]。
近年来,随着高通量转录组测序技术的不断发展,众多新的转录序列被逐渐发现,研究[10]发现,在人和大多数哺乳动物基因组中有超过90%的DNA序列是被转录并生成或短或长的非编码RNA,这类RNA 缺乏启动子序列,因而不能进一步翻译成蛋白质。其中 LncRNA 是一类长度大于200 nt的非编码RNA 转录本,曾被认为是转录“垃圾”。然而随着研究的深入,越来越多的报道认为LncRNA 可参与调控许多重要的生物学过程,包括细胞分化、增殖、凋亡、多能干细胞重编程等。LncRNA 具有类型多、数量多和作用机制多等特点[11-12]。随着高通量转录组测序技术的不断发展,越来越多的LncRNA 被陆续发现,但目前大部分LncRNA 确切生物学功能及作用机制并不清楚[13]。LncRNA 可以通过招募相关蛋白,改变染色质结构来调控某个或某些基因表达,也可以通过顺式或反式机制来沉默或激活一个基因或基因家族甚至整条染色体。如LncRNA Xist介导的X 染色体失活,Xist转录后可招募多梳蛋白复合体(Polycomb repressive complex 2,PRC2) 并可覆盖X 染色体导致X 染色体发生大量组蛋白H3K27甲基化,从而导致X 染色体转录沉默,最终造成其失活。
LncRNA 广泛存在于真核动物转录组中。它们具有mRNA 样结构,但缺乏开放的阅读框,不编码蛋白质[14]。研究[15,16]表明,LncRNA 可参与调节细胞的多种生理过程,包括X 染色体沉默、基因组印记及染色质修饰、转录激活及干扰、核内运输等。近年来,随着研究的深入,已证实长链非编码RNA 与多种恶性肿瘤发生发展密切相关,可作为预测肿瘤进展的新型生物标志物。
本研究采用生物信息学及细胞实验分析MALAT1在肠癌中的表达水平、生物学功能及其与患者预后的关系。qPCR 结果显示,相比正常组织,MALAT1在肠癌组织中的表达水平明显高于癌旁组织。同时 Oncomine数据库中,结直肠癌患者癌组织中MLAT1表达水平高于癌旁组织。肠癌细胞系中(SW620、LOVO、HCT116) MALAT1的相对表达量显著高于正常人肠上皮细胞(NCM460)。无论从患者肿瘤组织中、肠癌细胞系还是数据库中,MALAT1在癌组织中的表达水平均明显升高,说明MALAT1在结直肠癌的发生发展中可能发挥重要作用。功能学研究显示,抑制MALAT1 表达可明显抑制SW620细胞的划痕迁移与小室侵袭能力,提示MALAT1的表达与肠癌的侵袭能力和增殖能力有关。预后分析提示,MALAT1 高低表达组患者OS差异无统计学意义(HR=1.2,P=0.35),而高低表达组DFS 差异有统计学意义(HR=1.6,P=0.023),MALAT1高表达组总生存期显著低于低表达组。
因此,MALAT1 在肠癌组织中表达水平明显上调,并与肠癌细胞迁移能力增强有关。高表达患者预后较差,并有望成为肠癌预后分子标志物和靶向治疗的新靶点。
