尖吻蝮蛇毒抑瘤组分Ⅰ体外抑制人口腔鳞癌HN6细胞作用的研究
2020-11-04刘方兴祖璨璨
刘方兴,邓 超,祖璨璨,柴 琳,
(1.皖南医学院 a.病理生理学教研室;b.口腔学院,安徽 芜湖 241002;2.暨南大学 口腔医学院,广东 广州 510632)
口腔癌是头颈部常见的恶性肿瘤,约占全身恶性肿瘤的3%,5年生存率保持在50%左右[1]。绝大多数早期口腔癌应首选手术治疗[2],晚期口腔鳞癌术后行同期联合放化疗可提高疗效和患者的生存率[3]。近年来,大量学者致力于口腔鳞癌发病机制以及诊疗方案的研究,不断丰富口腔鳞癌治疗的途径[4-6],而药物治疗是一个重要研究方向。尖吻蝮蛇毒抑瘤组分Ⅰ(Agkistrondonacutusvenom antitumor component-Ⅰ,AAVC-Ⅰ)是从尖吻蝮蛇毒粗毒中分离纯化的一种抑瘤组分。前期研究表明AAVC-Ⅰ可抑制慢性粒细胞白血病(CML)K562细胞、人肺癌细胞A549细胞以及人口腔鳞癌Tca8113细胞的增殖,并能诱导其凋亡[7-11]。本实验在前期研究的基础上,通过体外细胞培养观察口腔鳞癌HN6细胞的增殖、迁移和侵袭等活动,探讨AAVC-Ⅰ抑制HN6细胞的增殖,缩小肿瘤体积,进而抑制肿瘤的浸润生长及远处转移的作用,为其应用于口腔鳞癌的药物治疗提供一定的理论支持。
1 材料与方法
1.1 细胞 口腔鳞癌细胞HN6(ATCC,美国)。
1.2 主要试剂 AACV-Ⅰ冻干粉由皖南医学院蛇毒研究所提供,细胞培养液DMEM/F-12(Thermo Scientific,美国),Phosphate-Buffered saline(PBS)磷酸盐缓冲液(碧云天生物,中国),无支原体胎牛血清(四季青,中国),胰酶液(Hyclone,美国),青霉素-链霉素(Gbico,美国),兔抗Ki-67单克隆抗体(迈新生物,货号:MAB-0672,中国)、DAB显色液(迈新生物,中国)。
1.3 方法
1.3.1 细胞培养 对口腔鳞癌HN6细胞株进行复苏,在37℃的含5%CO2的细胞培养箱进行培养,培养液选择10%胎牛血清的DMEM/F-12,胰酶消化后1∶2传代,隔日换液、传代直至细胞呈现对数增长。实验分为对照组和AAVC-Ⅰ实验组。
1.3.2 细胞增殖检测 取培养成熟的HN6细胞,制备成悬液,使其浓度为2×105个/mL,在96孔板中配置0.1 mL悬液,分为4组,每组3个复孔,在培养箱中培养24 h,直至所有细胞都已经贴壁生长,洗涤细胞,向培养板中加入0.1 mL含AAVC-Ⅰ终浓度为0.1 mg/mL的培养液,每组分别处理0、24、48、96 h,0 h设为对照组。对每孔滴加0.01mL CCK8液,2 h后通过酶标仪检测450 nm处光度值并记录。
1.3.3 细胞迁移检测 重悬HN6细胞以5×105个细胞浓度接种于6孔板中,每组3个复孔,对AAVC-Ⅰ实验组每个样本中滴加0.1 mL的浓度为0.1 mg/mL的AAVC-Ⅰ,对照组滴加不含AAVC-Ⅰ的等体积的DMEM/F-12,培养48 h后,使用微量枪头做划线,PBS冲洗3次,在不含血清的DMEM/F-12中培养12、24 h后光学显微镜下观察划痕愈合情况。进行拍照记录。
1.3.4 细胞侵袭检测 选取8 μm孔径的小室,按1∶8配置Matrigel胶和空白培养基,包被于上室后待其凝固。配置0.1 mL浓度为1×106个/mL的细胞悬液进行接种,吸取含血清或趋化因子的培养基加在实验组小室孔外周围,配置0.1 mL浓度为1×106个/mL的细胞悬液进行接种,滴加含或不含浓度为0.1 mg/mL的AAVC-Ⅰ的DMEM/F-12培养液,将含有10%FBS的培养基放置在下室。在37℃,含5%CO2的细胞培养箱中培养24 h。清理小室上部细胞,并对下室细胞进行甲醛固定,结晶紫染色15 min,洗涤,随机选择5个视野拍摄计数。

2 结果
2.1 AAVC-Ⅰ抑制HN6细胞体外增殖 实验结果表明,与对照组相比,AAVC-Ⅰ实验组在24、48和96 h HN6细胞增殖均受到抑制,差异有统计学意义(P<0.05)(见表1)。

表1 AAVC-Ⅰ随时间变化抑制HN6细胞体外增殖
2.2 AAVC-Ⅰ对HN6细胞迁移的影响 利用细胞划痕实验观察细胞迁移能力,实验结果显示,与对照组相比,AAVC-Ⅰ作用后,AAVC-Ⅰ实验组12和24 h细胞划痕愈合划痕百分比下降(P<0.05),肿瘤细胞的迁移能力降低(图1、表2)。

图1 AAVC-Ⅰ对肿瘤细胞迁移的影响

表2 AAVC-Ⅰ处理12和24 h后划痕愈合百分比/%
2.3 AAVC-Ⅰ对HN6细胞侵袭的抑制 Transwell实验检测细胞侵袭情况,侵袭至小室下方的肿瘤细胞可被结晶紫染色,实验结果表明,HN6经过AAVC-Ⅰ处理24 h后,视野中仅有少量细胞紫染(图2)。统计视野内侵袭细胞数显示,实验组侵袭细胞数目百分比[(50.833±1.543)%]小于对照组[(100.000±0.000)%],差异有统计学意义(t=55.191,P=0.000)。
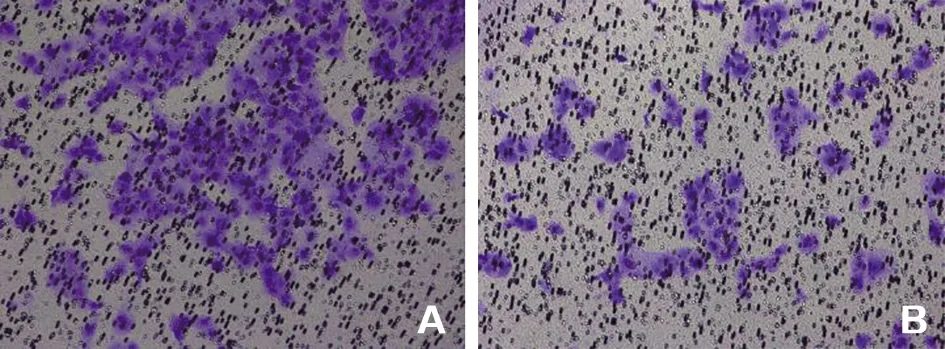
A.NC;B.AAVC-Ⅰ。
3 讨论
已有研究表明,从蛇毒中获取的某些活性成分具有显著的体外抗癌效应,其机制可能与增加活性氧的生成和诱导癌细胞凋亡有关[8],实验室前期工作也发现尖吻蝮蛇毒抑瘤组分在人胃癌细胞SGC-7901的体外培养中可抑制肿瘤细胞的增殖,诱导肿瘤细胞的凋亡[9];亦有学者发现AAVC-Ⅰ具有抑制卵巢癌细胞A2780增殖及黏附能力[10],可诱导人口腔鳞癌Tca8113细胞内质网应激[11],抑制口腔鳞状细胞癌肿瘤生长。口腔鳞癌的临床治疗关键点在于抑制其增殖,诱导其凋亡。
本实验应用体外实验方法进一步探索了AAVC-Ⅰ对人口腔鳞癌细胞HN6的增殖、迁移、侵袭的影响。结果显示,0.1 mg/mL剂量的AAVC-Ⅰ在24、48、96 h对口腔鳞癌HN6细胞的增殖均有明显的抑制作用;细胞划痕实验和Transwell实验的结果也表明,AAVC-Ⅰ可明显降低细胞划痕愈合百分比和HN6细胞的迁移、侵袭能力。AAVC-Ⅰ这种体外抑制口腔鳞癌HN6细胞增殖、迁移和侵袭的作用机制比较复杂,可能涉及多个环节。AAVC-Ⅰ可能作为细胞毒素,干扰膜转运机制从而破坏质子泵,进而细胞肿胀裂解,达到细胞杀伤效应,亦可上调cyt-C表达可促进激活联级反应,激活下游的Caspase表达,从而通过线粒体途径促进细胞凋亡[12]。细胞周围基质蛋白可通过RGD受体与细胞结合,以去整合素效应,竞争性与蛋白表面受体结合,从而降低其细胞黏附性[13],AAVC-Ⅰ处理后的HN6细胞的迁移与侵袭均受到抑制,其原因可能在于AAVC-Ⅰ作为去整合素发挥了受体阻断效应。AVCC-Ⅰ对口腔鳞癌细胞HN6的抑制作用可能与其解离素类蛋白和细胞毒性密切相关,其具体机制还有待探索。
