免疫球蛋白基因重排在B细胞非霍奇金淋巴瘤诊断中的意义*
2020-11-04卢峰罗志刚李甫罡王钢陈涛郭晓兰
卢峰,罗志刚,李甫罡,王钢,陈涛,郭晓兰
(1.简阳市人民医院中心实验室,四川简阳 641400;2.川北医学院附属医院检验科,四川南充 637100)
B细胞非霍奇金淋巴瘤(B-NHL)是非霍奇金淋巴瘤中常见的一种类型(约占80%)[1]。B-NHL的组织类型多样,临床上通过形态学结合免疫组化染色可确诊70%~80%的病例,但仍有20%~30%的患者与反应性淋巴组织增殖疾病(例如淋巴结炎、传染性单核细胞增多症等)难以区别[2]。免疫球蛋白(Ig)的克隆性基因重排是B-NHL的特征之一,利用分子生物学技术检测基因重排是临床上检测B-NHL的主要手段之一。研究证实,使用BIOMED-2引物系统检测病理组织和骨髓样本Ig基因重排具有重要的临床应用价值[2-3]。目前,国内外关于外周血标本Ig基因重排的相关研究主要集中于滤泡淋巴瘤(FL)及部分T细胞淋巴瘤[4-5],而将外周血与骨髓标本Ig基因重排进行比较的报道较少。本研究拟采用多重聚合酶链反应(mPCR)技术及标准化BIOMED-2引物系统对B-NHL患者骨髓或(和)外周血标本进行Ig基因重排检测,比较其阳性率,以期探讨外周血标本检测Ig基因重排的可行性。
1 材料和方法
1.1研究对象 收集2017年1月至2018年12月于简阳市人民医院血液科及肿瘤科就诊的103例B-NHL患者作为研究对象,其中男58例,女45例,年龄27~78岁,中位年龄61.2岁。均根据2016年世界卫生组织《造血和淋巴组织肿瘤分类》明确诊断[6]。排除标准:治疗期间出院、病历资料不全或者伴有其他系统恶性肿瘤的患者。按组织学分类分为慢性淋巴细胞白血病(CLL)/小B细胞淋巴瘤(SLL)59例,套细胞淋巴瘤(MCL)9例,弥漫大B细胞性淋巴瘤(DLBCL)14例,滤泡淋巴瘤(FL)5例,边缘区淋巴瘤(MZL)4例,淋巴浆细胞淋巴瘤(LPL)7例,其余5例B-NHL类型未定。另收集同期就诊的20例临床明确诊断为反应性淋巴组织增生(包括淋巴结炎、传染性单核细胞增多症等)的患者作为对照组,其中男12例,女8例,年龄15~62岁,中位年龄52.3岁。本研究经医院医学伦理学委员会批准(批准文号:简医伦理2017041),各研究对象均知情同意。
1.2主要试剂和仪器 Ezup柱式血液基因组DNA抽提试剂盒、PCR Mix、DNA Marker、BIOMED-2引物系统(上海生工公司)。C1000 Touch PCR仪、电泳仪、ChemiDoc XRS+成像系统(美国Bio-Rad公司),Nano Drop超微量分光光度计(美国Thermo Scientific公司)。
1.3标本采集 收集两组患者入院时空腹外周血标本3~5 mL,置于EDTA-K2抗凝管中待测;骨髓标本采集由临床医师行髂后上棘穿刺抽取3~5 mL,置于肝素抗凝管中待测。样本均置于4 ℃保存,24 h内完成DNA提取。
1.4方法
1.4.1DNA提取 按照Ezup柱式血液基因组DNA抽提试剂盒说明书提取骨髓及外周血标本DNA。采用Nano Drop超微量分光光度计检测提取DNA样本的纯度与浓度,取吸光度(A260/280 nm)值在1.8~2.0的DNA样本用于后续实验,对不纯或浓度不足的样本重新提取DNA。DNA样本短期置于-20 ℃保存,或置于-80 ℃长期冻存。
1.4.2引物设计及PCR反应 引物设计根据BIOMED-2引物系统[3],将48条引物组合在7组引物管中,具体分组见表1。PCR总反应体系为25 μL,包括PCR Mix 12.5 μL,DNA模板0.5 μL,100 μmol/L引物0.5 μL,ddH2O补足体积。PCR循环参数:95 ℃预变性7 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃延伸10 min,4 ℃保存。取上述扩增产物10 μL,行20 g/L琼脂糖凝胶电泳,4S Green Plus核酸染料染色,并于ChemiDoc XRS+成像系统上扫描并分析。结果判读:PCR扩增产物经电泳后,电泳条带清晰,边缘整齐,宽度<1 mm,条带在预期的范围以内判断为克隆性重排。如果PCR扩增产物出现片状弥散性条带,且片段大小不在引物设计所预期的范围以内,为非克隆性重排。

表1 BIOMED-2引物系统
1.5统计学分析 采用SPSS 21.0统计学软件进行分析,定性数据以率表示,各组之间比较采用卡方检验。以P<0.05为有统计学意义。
2 结果
2.1B-NHL患者Ig基因单克隆重排检测 CLL/SLL与非CLL/SLL型B-NHL患者两组间IgH、IgK、IgH和IgK联合检测的阳性率差异均具有统计学意义(χ2=6.62,P=0.01;χ2=8.26,P=0.004;χ2=21.6,P=0.00)。MCL与DLBCL型的IgH、IgK、IgH和IgK联合检测的阳性率差异亦有统计学意义(χ2=6.66,P=0.01;χ2=4.41,P=0.036;χ2=6.63,P=0.01)。MCL与FL、MZL、LPL型比较,IgH和IgK重排阳性率差异均无统计学意义(P>0.05)。20例反应性淋巴组织增生患者均未检出Ig重排。见图1、表2。

表2 B-NHL患者Ig基因单克隆重排检测[n(%)]
2.2骨髓和外周血标本Ig基因重排检测 70例患者外周血Ig基因重排阳性32例(45.7%),骨髓Ig基因重排检测阳性38例(54.3%),两者差异无统计学意义(χ2=1.03,P=0.31)。其中CLL/SLL患者外周血与骨髓标本Ig基因重排阳性率差异无统计学意义(69.2% vs 80.8%,χ2=0.92,P=0.34);非CLL/SLL的B-NHL患者外周血与骨髓标本Ig基因重排阳性率差异亦无统计学意义(31.8% vs 38.6%,χ2=0.45,P=0.50)。见表3。
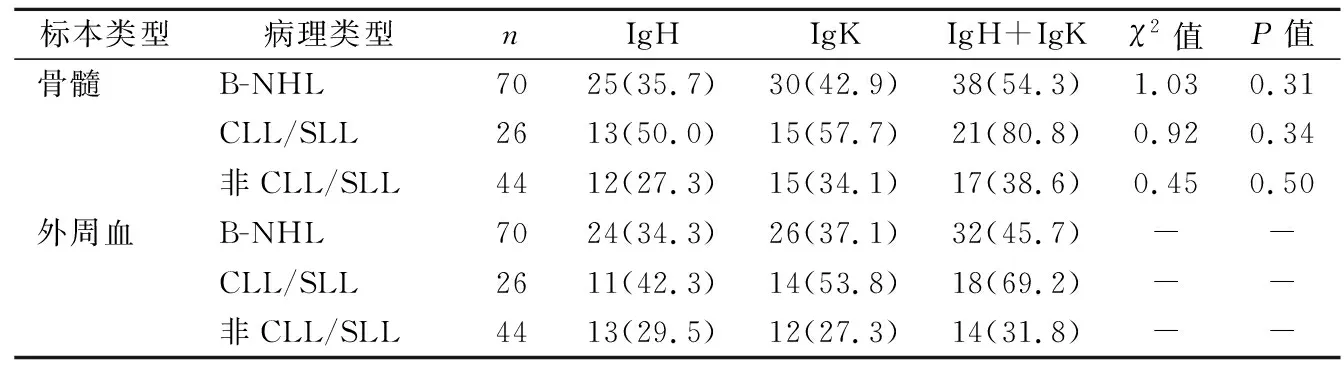
表3 骨髓和外周血标本Ig基因重排检测[n(%)]
3 讨论
B淋巴细胞免疫球蛋白基因由可变区(variable region,V)、多变区(diversity region,D)、铰链区(joining region,J)、恒定区(constant region,C)组成。在B淋巴细胞分化发育过程中,VDJ区染色体分布呈不连续状态,片段之间可有单核苷酸随机插入的过程。通常情况下正常人体淋巴细胞和反应性淋巴组织增生病变中Ig重排方式多样(即为多克隆重排)。而B-NHL患者体内肿瘤细胞起源于同一克隆,表现为Ig单克隆重排。因此Ig克隆性重排检测可用于B-NHL的辅助诊断[7-8]。
本研究发现,103例B-NHL患者中IgH基因重排阳性率为41.7%,IgK基因重排阳性率为50.5%,IgH和IgK联合检出率为64.1%。这与肖颖等[9]报道的阳性率(65.7%)一致,但低于张岩等[2]报道的联合检测率(81.6%)。考虑到B-NHL的异质性,不同亚型的B-NHL增殖、播散特点不同,除CLL/SLL以外的B-NHL早期病变可能局限于淋巴结,到进展期或者晚期才出现结外或骨髓浸润,导致骨髓Ig基因重排检测阳性率存在差异。本研究中20例反应性淋巴组织增生患者未检测出Ig基因重排,说明BIOMED-2引物系统检测Ig基因重排具有较高的特异性。本研究还发现,生发中心来源的DLBCL其IgH单克隆重排阳性率低于生发中心以前来源的MCL的IgH单克隆重排,差异具有统计学意义。同时也观察到FL、MZL、LPL等生发中心以后来源的B-NHL其IgH单克隆重排阳性率低于MCL,但差异无统计学意义。研究表明,生发中心V区基因体细胞高频突变(somatic hypermutation,SHM)可降低引物的退火效率,影响引物与基因的有效结合,导致PCR扩增失败,而来源于生发中心以前的MCL几乎不会受到SHM影响[10]。本研究中MCL患者IgH单克隆重排阳性率明显高于DLBCL、FL、MZL、LPL,分析原因可能是由于MCL患者的肿瘤细胞来源于生发中心以前,并未与抗原接触,较少受SHM影响,因此检出率较高。此外,BIOMED-2引物系统同时包含了IgH和IgK检测,IgK很少受体细胞超突变的影响[11],在一定程度上可以弥补SHM带来的缺陷。两者联合检测可以提高Ig基因重排的检出率。
以创伤性更小的血液标本代替骨髓标本Ig基因重排检测是现今研究的目标。研究表明,淋巴组织中的正常淋巴细胞有归巢现象,淋巴结组织中的淋巴细胞可以不断地进入血液循环中,然后又回到淋巴组织,因此,B-NHL肿瘤细胞与正常细胞一样,亦具有归巢现象[12-13]。另有研究发现,治疗后的B-NHL患者骨髓中残留的肿瘤细胞并不高于外周血,这可能是由于使用造血刺激因子后造血干细胞被动员到外周血,而肿瘤细胞也随之进入外周血循环[14]。本研究中骨髓与外周血标本Ig基因重排的阳性率差异无统计学意义,表明外周血标本检测Ig基因重排在B-NHL诊断中的价值与骨髓标本检测Ig基因重排基本相当。临床上有些病例高度怀疑淋巴瘤,但又没有浅表的病理组织可取或者患者不愿意做诊断性穿刺而导致诊断困难, 此时骨髓和外周血标本Ig基因重排检测可以为淋巴瘤的诊断提供重要的依据。而外周血标本Ig基因重排检测相对无创、方便取材、患者痛苦少、便于随访,易于临床推广,可以作为骨髓标本检测Ig基因重排的有效补充。
综上所述,应用BIOMED-2引物系统检测Ig基因重排可作为B淋巴细胞来源的良、恶性疾病的辅助诊断手段。外周血与骨髓标本Ig基因重排检测在B-NHL临床诊断中的价值相当。但是本研究未能将病理组织样本纳入检测范围,对外周血、骨髓标本基因重排阳性吻合度存在的差异也没有进一步深入探讨,后续研究会将病理组织和穿刺液标本纳入探讨范围,分析不同样本来源的Ig基因重排检测结果的差异。
