超声引导下颈动脉窦阻滞在颈动脉支架植入术中的应用价值
2020-11-04刘庆华刘雪平程国兵
刘庆华 刘雪平 程国兵 陆 炜
作者单位:324000 浙江省衢州市人民医院超声科
脑卒中具有高发病率、高致残率及高病死率等特点,我国脑卒中发病率高达1.23%[1]。缺血性卒中占全部脑卒中患者的80%左右,而25%~30%的缺血性脑卒中由颅外颈动脉狭窄引起[1-2]。颈动脉支架植入术(carotid stenting,CAS)是目前临床治疗颈动脉狭窄的重要手段,具有创伤小、恢复快、疗效确切等优点,临床应用广泛。由于颈动脉窦压力感受器的特殊性,术中球扩或支架植入时极易刺激颈动脉窦引起血压降低、心动过缓等低血流动力学改变(hemodynamic instability,HDI),增加了围手术期缺血性脑卒中、心跳停搏等严重心脑血管意外风险[3-4]。研究[5]表明术中行颈动脉窦阻滞可有效拮抗颈动脉窦刺激效应。本组旨在探讨在超声引导下颈动脉窦阻滞预防CAS术中HDI的可行性及安全性。
资料与方法
一、临床资料
选取2017年1月至2019年6月我院收治的颈动脉狭窄患者145例,男98例,女47例,年龄45~83岁,平均(65.7±3.9)岁。纳入标准:①术前经超声、CTA等提示颈动脉狭窄,其中有症状颈动脉狭窄程度>50%,无症状颈动脉狭窄程度>70%;②颈动脉狭窄位于颈内动脉起始部。排除标准:①有抗凝血、抗血小板禁忌;②1个月内曾发生大面积脑卒中或心肌梗死;③慢性颈动脉完全闭塞;④Ⅲ度房室传导阻滞。按照随机数字法进行分组:A组73例,术前于超声引导下行颈动脉窦阻滞;B组72例,术前无特殊处理。两组在年龄、性别、病史、心率、血压及颈动脉狭窄程度比较,差异均无统计学意义。本研究经我院医学伦理委员会批准,手术前告知患者及家属治疗方案,并签署知情同意书。
二、仪器与方法
1.仪器:使用Philips EPIQ 5彩色多普勒超声诊断仪,L12-5探头,频率5~12 MHz。颈动脉窦阻滞使用山东威高集团生产的洁瑞5 ml一次性使用无菌注射器。
2.阻滞方法:A组患者在术前30 min内由固定的超声介入医师行患侧颈动脉窦阻滞。患者取仰卧位,头偏向健侧,局部消毒铺巾,于纵切、横切等多切面反复扫查颈动脉,确定颈内动脉及颈外动脉分叉处位置,然后使用5 ml注射器抽取甲磺酸罗哌卡因(扬子江药业集团有限公司,国药准字:H20070232)5 ml(10 ml∶119.2 mg),在超声引导下垂直进针至肌肉深面颈内、颈外动脉分叉处,回抽无血确定位置后缓慢注射罗哌卡因,根据药物分布情况决定药物用量,直至药物完全包绕在颈动脉窦部。操作过程中严密观察患者生命体征,若有明显不适症状立即停止。
3.手术过程:患者取仰卧位,局部浸润麻醉后穿刺股动脉置入6F动脉血管鞘。进入MPA导管选择进入患侧颈动脉造影明确狭窄部位和狭窄程度,进入抗栓塞远端保护装置(Emboshield NAV6,美国),将保护伞放置在颈动脉狭窄远端3~5 cm管径无明显弯曲处。打开保护伞后沿保护伞导丝进入球囊(Viatrac 14 Plus,美国)进行逐级预扩,球扩后使用与狭窄部位近段正常管径匹配的支架(Acculink,雅培公司)。术中行DSA准确定位后释放支架,再次造影观察支架定位与残余狭窄情况。术中严密监测患者生命体征,一旦发现心率低于50次/min,或血压低于90/60 mm Hg(1 mm Hg=0.133 kPa),则立即对症处理。术后腹股沟穿刺点常规加压包扎24 h。所有患者出院前常规复查头颅MRI。
4.观察指标:记录颈动脉窦阻滞相关并发症、颈动脉窦阻滞时间、所需麻醉药物用量;监测术中患者心率降低值和收缩压降低值;记录发生心动过缓、低血压患者例数;术后发生心脑血管缺血事件例数。
三、统计学处理
应用SPSS 25.0统计软件,对计量资料进行正态性检验,符合正态分布的计量资料以表示,行t检验;计数资料以例或百分比表示,行χ2检验和Fisher精确概率法。P<0.05为差异有统计学意义。
结 果
A组73例患者行颈动脉阻滞均获得成功,成功率100%,见图1。阻滞操作平均时间(10.1±2.3)min;甲磺酸罗哌卡因平均用量(3.4±0.7)ml,自颈动脉阻滞后至CAS术中行颈动脉狭窄球囊扩张的平均时间(70.3±8.6)min。仅1例患者阻滞后出现患侧上眼睑下垂,休息1 h后好转。
两组患者均顺利完成CAS手术。术中均出现HDI事件,但A组术中血压、心率平均降幅均小于B组,发生低血压和心动过缓例数均少于B组,差异均有统计学意义(均P<0.01),见表1。A组患者术中无心脏停搏;B组患者有1例术中出现心脏停搏,经立即予阿托品和胸外按压后恢复。
在术后脑血管事件发生方面,A组所有患者无脑卒中事件发生,仅1例术后2 h出现嗜睡,上肢查体不配合,头颅MRI提示患侧颞枕部脑回略增粗,提示脑肿胀,考虑缺血再灌注损伤,经甘露醇降颅压等对症治疗后好转。B组有3例患者术中及术后均存在HDI,其中2例术后常规复查头颅MRI提示新发点状腔隙性脑梗,但患者均无明显不适,未予特殊处理;1例术后6 h出现对侧下肢肌力下降,头颅MRI提示靶病变同侧的额顶叶及半卵圆中心急性脑梗塞灶,对症处理后肌力逐渐恢复。A组围手术期心脏停搏和脑卒中事件总发生率低于B组,差异有统计学意义(χ2=4.171,P<0.05)。
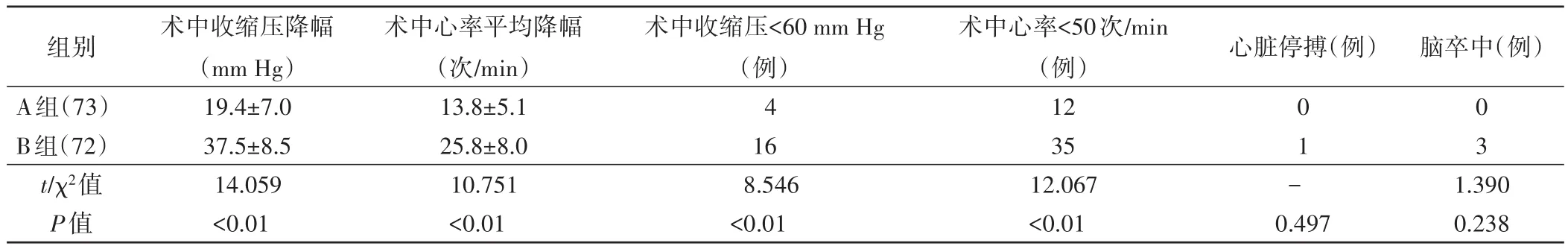
表1 两组患者术中低血流动力学改变事件及严重并发症发生情况
讨 论
脑卒中是导致人类残疾和死亡的主要病因之一,外科手术可降低颈动脉狭窄患者发生缺血性脑卒中风险已成为共识。2017年中国颈动脉狭窄诊治指南[2]推荐在治疗颈动脉狭窄时,CAS可作为颈动脉内膜剥脱术(carotid endarterectomy,CEA)的重要替代手段。但随着该技术应用的增多,其引起的并发症也逐渐增加。CAS围手术期并发症包括HDI、脑梗死、高灌注综合征、支架内血栓形成等[6],以HDI最常见,表现为心动过缓(心率<50次/min)或低血压(收缩压<90 mm Hg)[3-4]。Obeid 等[7]发现围手术期发生HDI患者脑卒中和死亡风险是未发生HDI患者的3.4倍。CAS相关HDI的发生主要与患侧颈动脉窦压力感受器术中受到球囊扩张、支架置入等机械刺激有关[8]。颈动脉窦阻滞通过对颈动脉窦局部浸润麻醉抑制窦神经反射来预防颈动脉术中发生HDI,既往多应用于CEA。本组旨在探讨超声引导下颈动脉窦阻滞预防CAS术中HDI的可行性及安全性。
本组结果显示,A组患者CAS术中发生HDI比例及程度均少于B组,且术中和术后发生心脏停搏及脑卒中事件发生率均低于B组,差异均有统计学意义(均P<0.05)。表明术前在超声引导下行颈动脉窦阻滞在一定程度上能够抑制窦神经,进而减少CAS术中HDI的发生,降低术中和术后发生心脏停搏及脑卒中事件的风险。
在颈动脉窦阻滞操作本身安全性方面,本组中A组73例患者中仅1例患者阻滞后出现上眼睑下垂,考虑交感神经麻痹可能,休息1 h后逐渐恢复,并未影响CAS手术进行。笔者总结了开展该技术的注意要点:①熟练的超声技术。超声引导下颈动脉窦阻滞虽然操作比较简单,但操作者需了解操作过程中可能存在的并发症及其对症处理方法,本组中该操作均由固定的超声介入组医师完成;②阻滞范围的把握。因超声无法显示颈动脉压力感受器位置,术中应尽量使麻醉药物包绕颈动脉窦,以达到较好的浸润麻醉效果;③阻滞过程中监测患者生命体征。阻滞过程中需严密观察患者生命体征,如有明显不适应立即停止,并予对症处理;④麻醉药物的选择。目前关于阻滞麻醉药物的选择尚无统一标准,文献[5]报道利多卡因在颈动脉内膜切除术中的临时阻滞效果良好。本组选用甲磺酸罗哌卡因原因是其半衰期较长,可达4 h,能够满足从颈动脉阻滞后到手术进行球囊扩张的时间窗,也并未出现麻醉药物过敏等不良反应。笔者认为麻醉药物的选择应根据手术团队对阻滞有效持续时间的要求和医师个人经验决定。尽管本组结果证实术前在超声引导下行颈动脉窦阻滞在一定程度上能够抑制窦神经,进而减少CAS术中HDI的发生,但部分患者行患侧颈动脉阻滞成功后CAS术中仍发生HDI,其原因尚不清楚,考虑可能与不同患者窦神经对局麻药物的敏感程度不同有关。
综上所述,CAS术前行超声引导下患侧颈动脉窦局部阻滞能够有效抑制术中窦神经压力反射,减少HDI发生,降低围手术期发生心脏停搏及脑卒中事件的风险。该技术操作简便,安全可行,值得临床进一步推广应用。
