三腔连续负压引流管在感染性坏死性胰腺炎外科治疗中的临床疗效
2020-11-03MuhammadSalmanAzhar孙吉春聂晚频李志强朱红伟刘云飞余枭李霞
Muhammad Salman Azhar,孙吉春,聂晚频,李志强,朱红伟,刘云飞,余枭,李霞
(中南大学湘雅三医院 肝胆胰外科Ⅱ,湖南 长沙,410013)
急性胰腺炎(acute pancreatitis,AP)是常见的消化系统疾病之一,主要因胰腺腺泡细胞内的酶原被异常激活而引发的胰腺局部自身消化,部分患者可继续发展为重症急性胰腺炎(severe acute pancreatitis,SAP)[1-2]。SAP常常伴有器官衰竭和局部并发症,其中器官衰竭又很容易发展为多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),其主要包括呼吸衰竭、肾衰竭和休克等,而局部并发症常以局部坏死、假性囊肿和局部脓肿为多见,局部和全身并发症以及侵入性干预导致SAP病死率为13%~30%[3-4]。临床表明约20%的AP患者会演变为坏死性胰腺炎,这种坏死可以是无菌性或感染性的。其中,感染性坏死性胰腺炎(infected necrotizing pancreatitis,INP)常为AP患者需要接受外科治疗的重要指征之一,INP所继发的更严重的炎性反应可以进一步延长AP病程,大幅提高MODS、出血及其他并发症的发生率,甚至于出现腹腔室隔综合征(abdominal compartment syndrome,ACS),使得这些患者的病死率进一步增加。因此,本研究主要探讨三腔负压连续引流技术对于INP患者外科治疗效果。
1 资料与方法
1.1 一般资料
回顾性分析2009年1月至2019年12月就诊于中南大学湘雅三医院的60例SAP合并INP患者的临床资料,60例患者在最佳保守治疗14 d后,30例接受手术治疗,30例继续保守治疗。纳入标准:患者年龄≥18岁,诊断符合修订的亚特兰大标准[1],其腹腔内压力(IAP)>20 mmHg(1 mmHg=0.133 kPa),根据标准胰腺炎处理方案和SAP的实践指南,患者接受最佳保守治疗14 d[5]。排除标准:孕妇、17岁以下的儿童、70岁以上的老年患者,以及慢性胰腺炎患者。最佳保守治疗14 d后行手术干预为手术组,继续接受保守治疗的患者为保守治疗组。所有患者治疗均由中南大学湘雅三医院同一(MDT)团队(包括肝胆胰外科、重症监护病房、内分泌科、消化内科、放射科)实施,该研究经中南大学湘雅三医院伦理委员会审议通过,所有患者或其法定代表人在治疗前均签署知情同意书。
1.2 手术方法
手术干预包括全层腹膜中线造口术、全层双侧肋骨下横切口造口术、白线皮下筋膜切开术和腹腔镜腹膜后引流术。手术组患者术后均采用三管持续负压引流导管引流(如图1所示)。如图2所示,三管持续负压引流导管有三根管,分别为冲洗管1、负压引流管2和调压管3。手术时,三管持续负压引流导管的一端伸入死腔,冲洗管的另一端与外置液体装置相连。另外,负压引流管的另一端与外部装置连接,产生负压。最后,调节管的另一端与外部直接连接。由于壁内靠近负压引流管,调压管与一对敞开的排水孔(01,02)相连,可与外界连接,以保持内外压力平衡。此外,其还可以解决位于坏死区一端的高真空室而造成的密封问题。
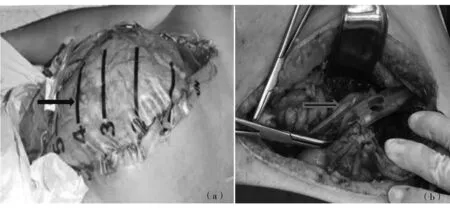
图1 (a) 无菌3-L泌尿生殖器冲洗袋;(b) 三腔持续负压冲洗导管Fig.1 (a) Sterile3-Lgenitourinaryirrigationbag;(b) Triplelumen continuous negative pressure irrigation catheter
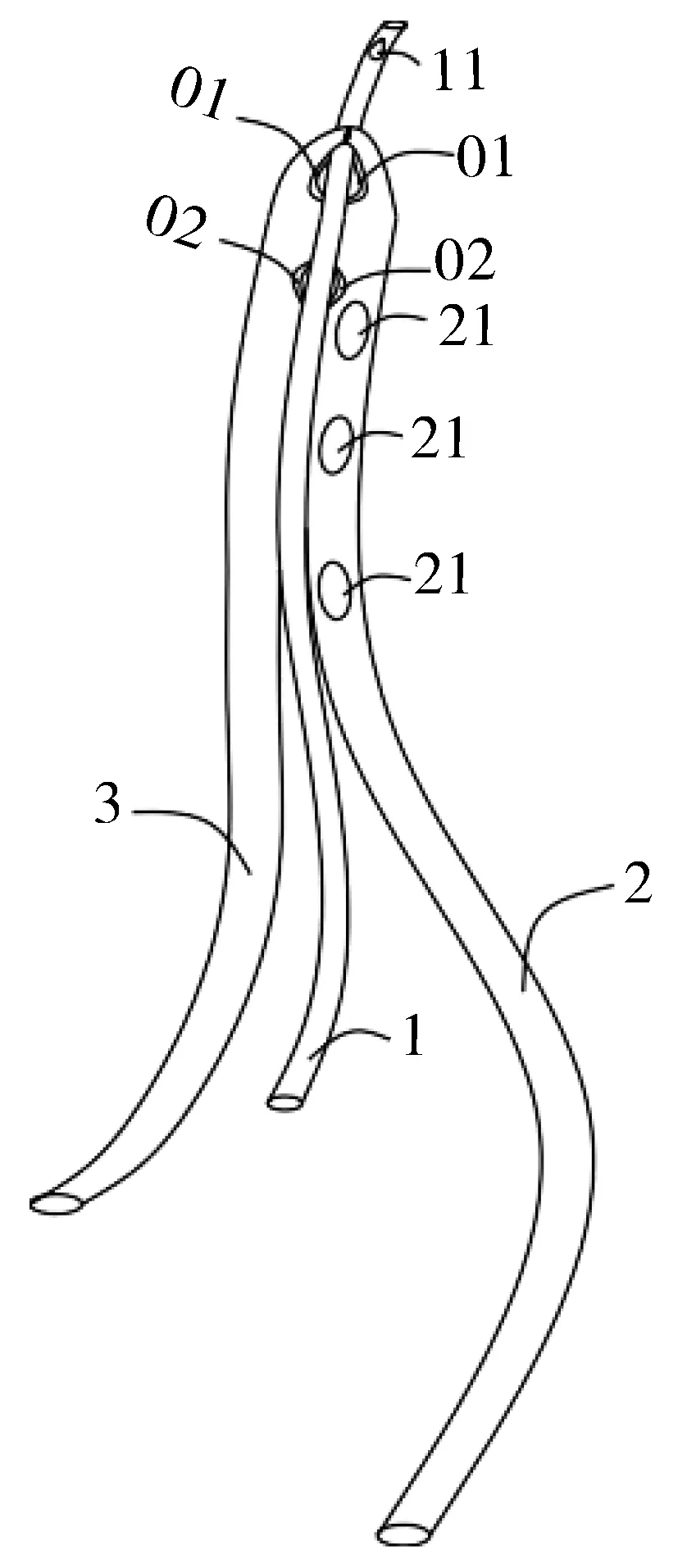
1—冲洗管;2—负压引流管;3—调压管;01,02—负压排水管2和调压管3中靠近墙内侧的一对排水孔;11—清洗管1末端的排水孔;21—负压排水管2壁上的排水孔图2 三管连续负压引流导管示意图Fig.2 Schematic diagram of 3-tube continuous negative pressure drainage catheter
1.3 观察指标
(1)比较早期手术和保守治疗后INP的病死率;(2)术前和术后的血流动力学及其他生理参数,包括心率(HR)、平均动脉压(MAP)、中心静脉压(CVP)、尿量(UO)、气道峰压(PAP)、动脉二氧化碳分压(PaCO2)、改良呼吸指数(MRI)[以动脉血氧分压(PaO2)与吸入氧分数(FiO2)之比表示]、动脉pH、动脉基础缺损(BE)和动脉乳酸(Lac)。
1.4 统计学处理

2 结果
2.1 一般资料情况
60例SAP合并INP患者在最佳保守治疗14 d后,30例接受手术治疗,30例继续保守治疗。两组患者一般资料对比研究,包括人口学(年龄、性别)、起病日、病因学和用于识别胰腺炎严重程度和器官功能障碍的评分系统,经统计检验分析,两组患者一般资料均无统计学差异(P>0.05),见表1。采用以下4种最常见的评分系统来识别胰腺炎和器官功能障碍的严重程度:CT严重程度指数(CTSI,范围0~10)[6];多器官功能障碍评分(MODS,范围0~24)[7];序贯器官衰竭评估(SOFA,范围0~24)[8];以及急性生理学和慢性健康评估Ⅱ(APACHE-Ⅱ,范围0~67)[9]。

表1 60例SAP合并INP患者的临床特点Table 1 Characteristics of the 60 patients with severe acute pancreatitis combined with infected necrotizing pancreatitis
2.2 2组患者死亡情况
手术组有11例(36.7%)行全层腹膜中线吻合术,9例(30%)行双侧肋骨下横切口,6例(20%)行白线皮下切开术,4例(13.3%)行腹腔镜腹膜后引流术。本研究中未发生与手术相关的并发症。手术组胰腺出血6例(20%),死亡3例;发生MODS 5例(16.7%),死亡3例;4例(13.3%)发生瘘(2例胰腺、1例小肠、1例结肠),死亡1例;发生肺动脉栓塞2例(6.7%),死亡1例。手术组术后病死率为26.7%(8/30),保守治疗组病死率为36.7%(11/30),与保守治疗组相比,手术组病死率明显降低(P<0.05)。
2.3 手术前后血流动力学等生理指标的变化
SAP合并INP患者手术前后的血流动力学和其他生理参数见表2,紧急有创减压术在减压后24 h内,除中心静脉压外,其余生理指标均有显著改善。减压前患者IAP平均为(34.63±5.63)mmHg,三腔持续负压冲洗导管手术减压使IAP显著下降至(16.21±3.15)mmHg(P<0.05)。减压后患者其他一般生理状况也得到显著改善,表现为血清pH,BE,PaO2/PaCO2,动脉血乳酸,MAP和UO明显改善,前后差异具有统计学意义(P<0.05)。

表2 AP合并INP患者三腔持续负压冲洗导管手术减压前后临床资料比较(n=30)Table 2 Comparison of clinical data before and after surgical decompression with triple lumen continuous negative pressure irrigation catheter in acute pancreatitis patients infected necrosis(n=30)
3 讨论
相关研究证实SAP合并INP患者常常预后较差[10-12],保守治疗策略是降低IAP和改善远端器官灌注的基石。然而,对于患有INP的SAP患者,仍然需要通过减压手术来降低IAP,并在非侵入性治疗选择后改善多器官功能障碍[13],但临床医生何时采取减压手术对这些患者最有利仍不清楚。
本研究中,60例合并INP的SAP患者接受了14 d的最佳保守治疗。在60例患者中,30例患者接受了急诊手术,其余30例患者继续接受保守治疗。研究发现三腔持续负压冲洗导管手术减压组的病死率明显低于保守治疗组,提示SAP合并INP患者在最佳保守治疗14 d后,有必要行三腔持续负压引流管减压手术。
为了探讨SAP合并INP患者手术后的疗效,本研究对这些患者手术前后的生理指标进行了统计学分析。研究发现减压前患者IAP明显升高,为(34.63±5.63)mmHg。急诊手术后IAP降至(16.21±3.15)mmHg,前后差异具有统计学意义(P<0.05)。相关报道表明,腹内高压(intra-abdominal hypertension,IAH)可导致呼吸紊乱和严重的外周组织缺氧,其特征是低氧血症并伴有Lac水平升高[14-16]。采用三腔持续负压引流管急诊有创减压术,手术前后患者生理参数改善有统计学意义,如PAP由减压前的(43.12±11.98)cmH2O降低至减压后的(23.56±4.63)cmH2O(P<0.05)。此外,术后PaO2/PaCO2也有明显改善,提示及时减压可较好地逆转SAP对肺功能的不良影响。此外,UO由减压前的(15.76±14.12)mL/h提高至减压后的(89.63±19.53)mL/h,表明减压后患者肾功能也有明显改善(P<0.05)。总之,本研究结果提示减压术使患者IAP明显降低,对患者血流动力学、呼吸和肾脏参数均具有较好的影响,本研究结果与其他学者的报道一致[17]。
ACS是SAP病程中最致命的并发症,主要症状包括IAP水平升高、少尿和PAP升高等。世界ACS学会认为SAP新发器官衰竭或现有器官衰竭的急性恶化与ACS有密切关系[18-20]。测量和监测IAP是ACS患者诊断和治疗的关键,长期以来,手术减压一直被认为是ACS的最终治疗方法。只有当非侵入性治疗方法不能降低IAP并且器官衰竭持续存在时,才推荐实施减压术[21]。即使在成功实施减压后,患者病死率仍然高达49%[22]。因此,还需要进一步研究减压手术的使用情况,以了解如何使患者受益最大。本研究发现:在最佳治疗14 d后IAP超过30 mmHg的患者手术减压效果较好。
在SAP和器官功能恶化的患者中,IAH在MODS进展中的作用机制尚未完全清楚。虽然IAP已被证明与SAP患者的急性生理学和APACHE-Ⅱ评分相关[18],但SAP患者的ACS和MODS之间的因果关系尚未得到充分证实。根据目前的认识,MODS的发展是多因素的,但其发病机制中的一个主要原因是炎性反应[19]。相关实验模型表明:IAH可以将促炎细胞因子释放到循环中,并在循环中激活中性粒细胞导致急性肺和肝损伤[23-24]。在SAP患者中,循环中性粒细胞和单核细胞的激活是一个早期事件[25]。考虑到这些因素,ACS的发展可能进一步增加促炎反应,进而促进SAP器官衰竭的发展。因此,及早认识ACS并对其进行充分、及时的治疗,可防止MODS患者病情进展,甚至死亡。
综上所述,当改善IAH的保守治疗对SAP患者无效时,可尝试手术减压的治疗方法。在本研究中,手术前后患者均未发现伤口愈合不良、出血、脓毒症等并发症。通过比较不同生理参数和病死率,三腔持续减压术有明显疗效。本研究为AP合并INP的治疗提供了一个新的思路,以期为临床治疗提供参考。
