一阶导数分光光度法同时测定水样中Cr(Ⅲ)和Cr(Ⅵ)
2020-11-03徐红纳靳立国由丽梅程艳
徐红纳, 靳立国, 由丽梅, 程艳
(1.牡丹江医学院, 黑龙江 牡丹江 157011;2.黑龙江省第一地质勘查院, 黑龙江 牡丹江 157011)
铬是第四周期第VIB族元素,广泛分布在自然界中,常用于电镀业和鞣革业,还可用作纺织品的媒染剂和金属清洁剂。随着工农业生产的快速发展,含铬废气、废水的不合理排放,加重了水资源环境的污染[1-4]。铬污染对人类的健康生存造成威胁,越来越受到人们的关注[5]。水中的铬主要是以Cr(Ⅲ)和Cr(Ⅵ)的形式存在,目前的研究发现,不同价态铬的生理功能迥然不同,Cr(Ⅲ)是生物体维持正常的生理活动所必需的,它的生物功能主要是参与机体的糖代谢和脂肪代谢,并且具有胰岛素加强剂的作用,临床上已经应用Cr(Ⅲ)盐和富含Cr(Ⅲ)的啤酒酵母治疗糖尿病和冠状动脉硬化症。而Cr(Ⅵ)的生物毒性较大,中毒时会使肝、肾、血液系统和神经系统的发生严重病变,甚至造成死亡,皮肤长期接触Cr(Ⅵ)或吸入含Cr(Ⅵ)粉尘会诱发癌变[6-9]。国际癌症研究机构(IARC)在2013年已将Cr(Ⅵ)列为人类致癌物[10-11]。安全的水质保障对人类健康至关重要,因此,对水样中不同价态的铬进行定量分析具有重要的研究意义。
目前,国内外对Cr(Ⅲ)和Cr(Ⅵ)同时检测的研究主要集中在药品[12]、玩具[13-14]、食品[15-16]、化妆品[17-18]、饮用水[19]等领域。同时检测Cr(Ⅲ)和Cr(Ⅵ)或检测Cr(Ⅵ)的方法有原子吸收光谱法[20-25]、分光光度法[26-29]、离子色谱法[30-31]及色谱-质谱联用法[32-33]等。这些方法大多数是先分离再测定,或先测出Cr(Ⅲ)或Cr(Ⅵ),然后氧化或还原测定铬的总量,再差减法计算出另一价态铬的含量。操作复杂费时,并且在处理过程中会导致价态的改变,误差大,精确度不易保证。卢菊生等[22]将水样中的Cr(Ⅲ)和Cr(Ⅵ)先用一种微乳相萃取分离富集,然后用原子吸收光谱法测定,该方法操作比较繁琐。巢静波等[31]用离子色谱法对环境水样中的Cr(Ⅲ)和Cr(Ⅵ)进行同时测定,但是Cr(Ⅲ)和Cr(Ⅵ)准确定性要依赖其保留时间,对淋洗液的浓度和衍生液流速的控制要准确,并且分析测定时会被其他高含量的共存离子干扰。本文研究了采用一阶导数分光光度法对水样中Cr(Ⅲ)和Cr(Ⅵ)进行测定,可满足废水样中Cr(Ⅲ)和Cr(Ⅵ)的分析测定要求。
1 实验部分
1.1 实验主要原理
根据比耳定律:
(1)
式中:I0为入射光强度,I为透射光强度,ε为摩尔吸光系数,c为样品浓度(mol/L),b是吸收池厚度(cm)。
如果在整个波长范围内入射光强度I0保持不变,将式(1)两边对波长求导数:
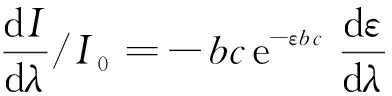
(2)
整理得:
(3)
从上式(3)可以看出,试样的浓度与一阶导数信号呈线形关系,其分析测定试样的灵敏度与摩尔吸光系数ε对波长的变化率有关,一阶导数的灵敏度在其吸收光谱的拐点处最高[34]。
1.2 仪器和主要试剂
UV-2600型紫外可见分光光度计(尤尼柯仪器有限公司)。上海雷磁pHS-25型酸度计。
Cr(Ⅲ)标准储备液(1000mg/L):精确称取1.0000g金属铬(纯度99.95%)放入烧杯中,加10mL 6mol/L盐酸溶解完全,加热至近干,再往烧杯中加入少许硝酸,加热溶解,转移到1000mL容量瓶中稀释至刻度,摇匀备用[35],测定时其他所需Cr(Ⅲ)溶液均由此标准储备液稀释配制。
Cr(Ⅵ)标准储备液(1000mg/L):准确称取已烘干的基准重铬酸钾2.8300g,加去离子水完全溶解后,移入1000 mL容量瓶中定容,摇匀,备用。
乙二胺四乙酸二钠溶液(0.05mol/L):准确称取乙二胺四乙酸二钠(EDTA-2Na,分析纯)9.3060g,放入烧杯中加去离子水完全溶解后,稀释至500mL容量瓶中,备用。
实验用水均为去离子水。
1.3 实验方法
把一定量的Cr(Ⅵ)和Cr(Ⅲ)标准溶液加入25mL比色管中,再加入0.05mol/L的EDTA-2Na溶液4mL ,调节溶液pH为3~3.5,在70℃恒温水浴中加热15min。冷却,定容,以空白溶液作参比,用石英比色皿(1cm),在波长300~400nm范围内测定吸光度,波长间隔10nm求一阶导数,得到波长330nm的最大一阶导数值,由标准曲线求出Cr(Ⅵ)浓度。在543nm波长处测定溶液吸光度,由标准曲线求出Cr(Ⅲ)的浓度。
1.4 标准曲线
1.4.1Cr(Ⅲ)标准曲线的绘制
用吸量管分别量取5mL 100mg/L Cr(Ⅵ)标准溶液移入8支25mL比色管中,然后分别加入不同浓度的Cr(Ⅲ)标准溶液,再加入EDTA-2Na,得到一系列Cr(Ⅵ)浓度为20mg/L和Cr(Ⅲ)浓度为0.5、1、5、30、50、70、90、120mg/L的混合溶液。按实验方法,在波长543nm处测定混合溶液的吸光度A。得到A与Cr(Ⅲ)浓度关系的线性回归方程为:A=0.0036ρ-0.0002(r2=0.9999)。
1.4.2Cr(Ⅵ)标准曲线的绘制
用吸量管分别量取5mL 100mg/L Cr(Ⅲ)标准溶液移入8支25mL比色管中,然后分别加入不同浓度的Cr(Ⅵ)标准溶液,得到一系列Cr(Ⅲ)浓度为20mg/L和Cr(Ⅵ)浓度为0.5、1、5、10、30、50、70、100mg/L的混合溶液。按实验方法,分别在波长300~400nm范围内测定混合溶液的吸光度,波长间隔10nm求一阶导数。得到波长330nm处的一阶导数值D与Cr(Ⅵ)浓度关系的线性回归方程为:D=0.00072ρ-0.00013(r2=0.9996)。
2 结果与讨论
2.1 吸收光谱和一阶导数光谱
在波长300~600nm内每隔1nm分别测定Cr(Ⅲ)-EDTA络合物和Cr(Ⅵ)溶液的吸光度,吸收光谱见图1a,分别对其吸光度求一阶导数值,结果见图1b。从图1a可看出,在波长543nm处,Cr(Ⅲ)-EDTA络合物有最大吸收而Cr(Ⅵ)在此处无吸收;在波长350nm处,Cr(Ⅵ)有最大吸收而Cr(Ⅲ)在此处也有吸收。因此,在波长543nm处可对Cr(Ⅲ)直接测定,而Cr(Ⅲ)会影响Cr(Ⅵ)的直接测定。由图1b可知,在波长330nm处Cr(Ⅵ)吸光度一阶导数有最大值,而在此波长处Cr(Ⅲ)-EDTA络合物吸光度一阶导数值为0,可以使重叠峰完全分开。因此,通过测定溶液在波长330nm处吸光度的一阶导数值,可测定Cr(Ⅵ)的含量。
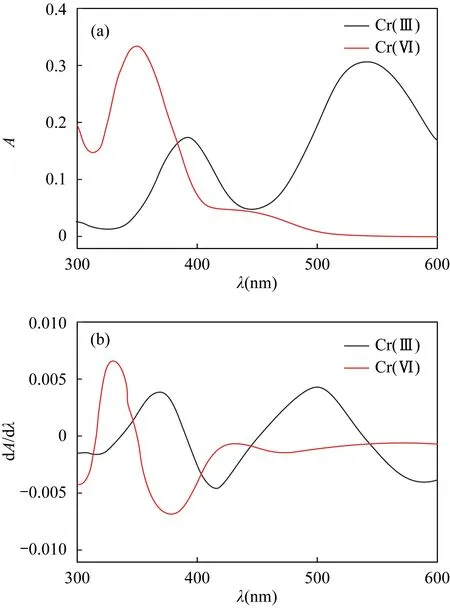
图1 Cr(Ⅵ)和Cr(Ⅲ)-EDTA络合物的(a)吸收光谱图和(b)一阶导数光谱图Fig.1 (a)Absorption spectra and (b) first derivative spectra of Cr(Ⅵ) and Cr(Ⅲ)-EDTA complex
2.2 导数间隔因子的选择
用吸量管移取5mL浓度为200mg/L的Cr(Ⅵ)标准溶液于25mL容量瓶中,调节pH至3~3.5,定容,摇匀,在波长300~400nm范围内,分别以10、20、40nm不同波长间隔求Cr(Ⅵ)吸光度的一阶导数值,结果如图2所示。由图2可知,当波长间隔为10nm求导时,Cr(Ⅵ)有适宜的一阶导数值。因此,本实验选择10nm作为一阶导数的求导间隔。
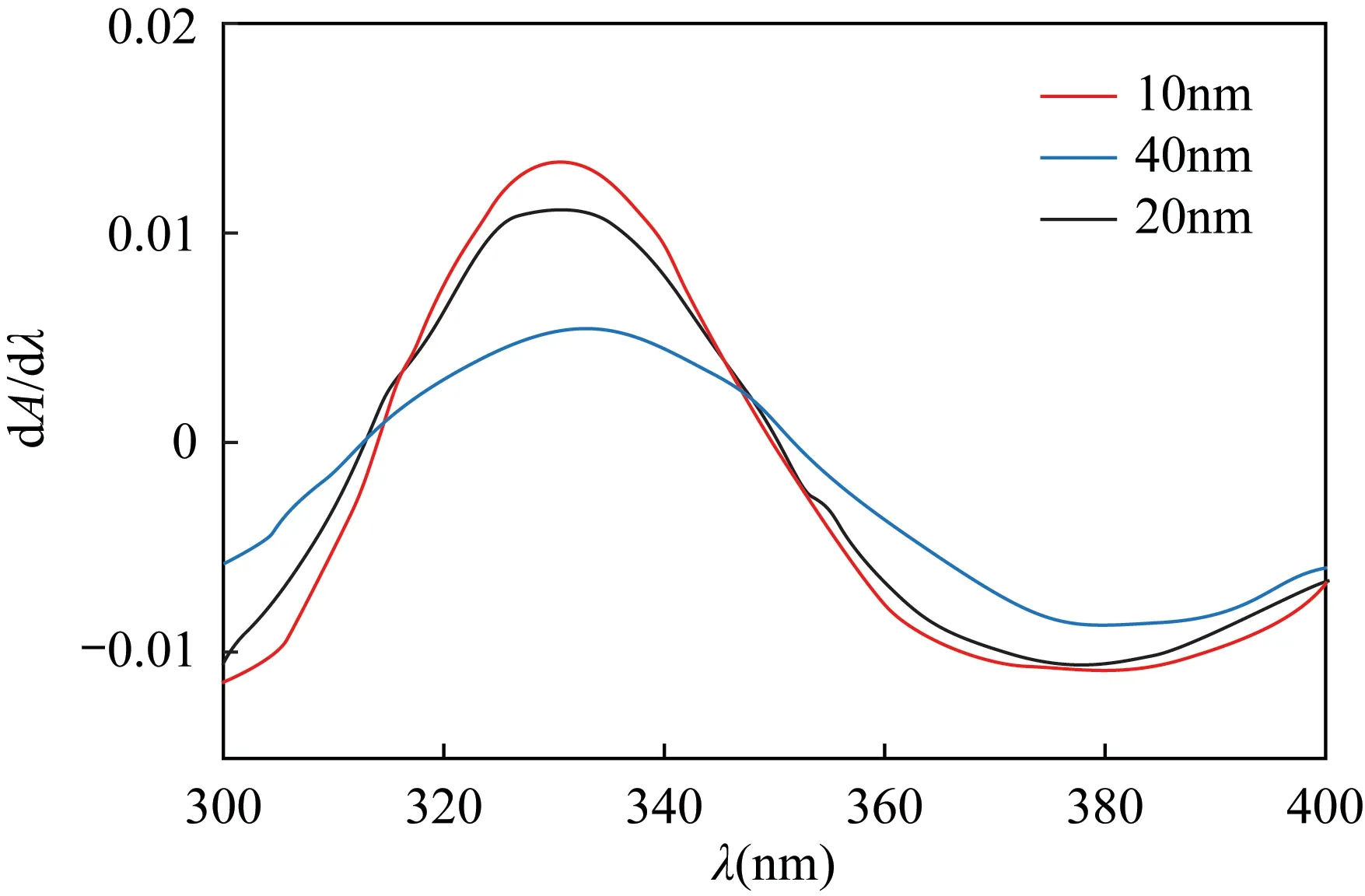
图2 导数间隔因子的确定Fig.2 Determination of derivative interval factor
2.3 实验条件对铬吸光度测量的影响
2.3.1溶液的酸度
用吸量管移取5mL浓度为100mg/L的Cr(Ⅲ)标准溶液至25mL色管中,加入EDTA-2Na显色剂,调节不同的pH值,70℃恒温水浴中,保持加热15min后冷却,定容,测定吸光度。用吸量管吸取50mg/L Cr(Ⅵ)标准溶液5mL至25mL色管中,调节不同的pH,定容摇匀,测定吸光度,结果见图3。Cr(Ⅲ)-EDTA络合物的吸光度在pH 3~4之间基本不变;Cr(Ⅵ)的吸光度在pH 2~4之间基本不变。因此,本实验试样溶液的pH值选择在3~3.5。
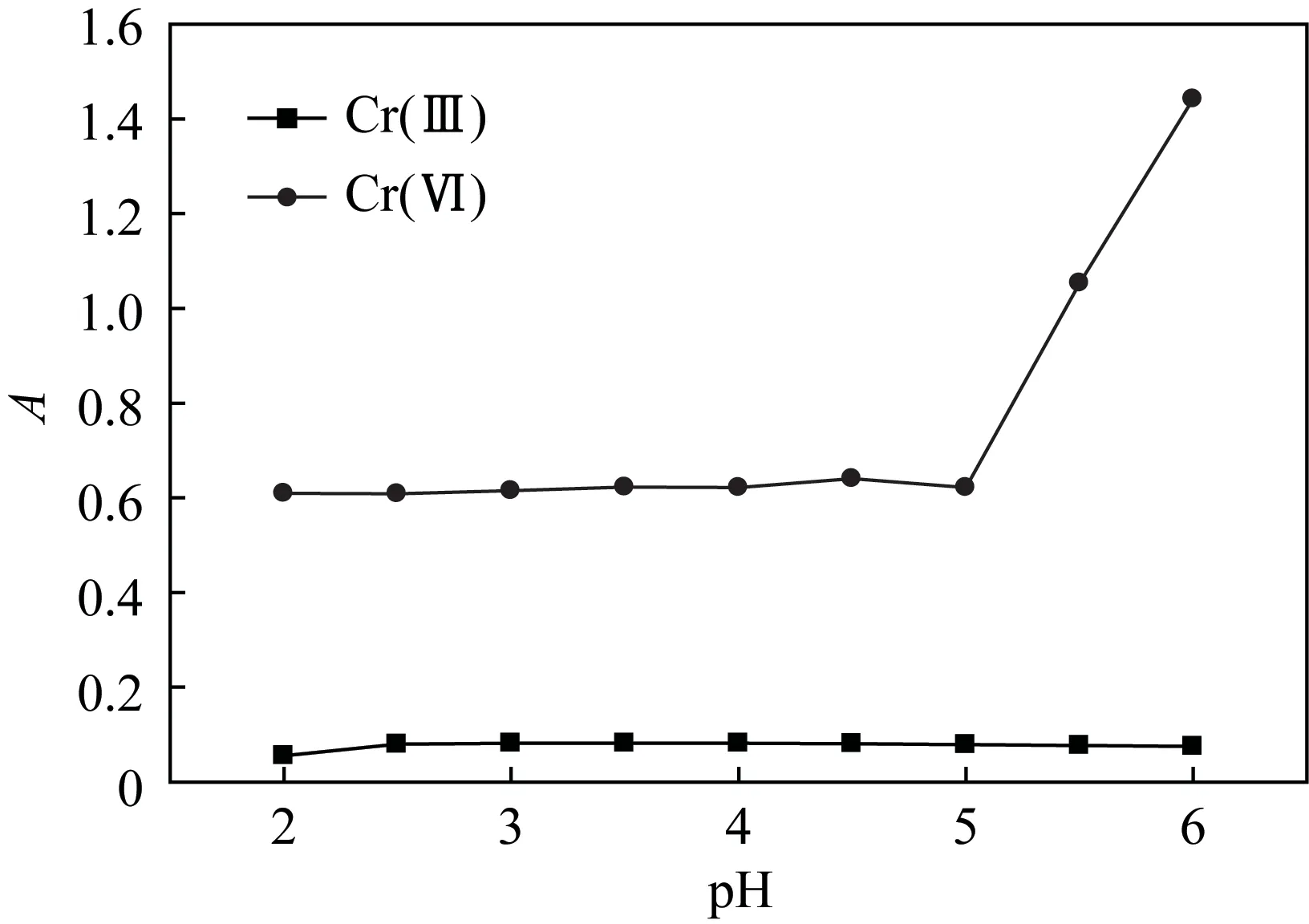
图3 溶液pH值对Cr(Ⅵ)和Cr(Ⅲ)-EDTA络合物吸光度的影响Fig.3 Effect of pH of solution on the absorbance of Cr(Ⅵ) and Cr(Ⅲ)-EDTA complex
2.3.2EDTA-2Na溶液的加入量
用吸量管移取5mL浓度为100mg/L的Cr(Ⅲ)溶液至25mL比色管中,调节pH为3~3.5,分别加入0.2、0.5、1.0、2.0、2.5、3.0、…、10.0mL的EDTA-2Na溶液,在70℃恒温水浴中,保持加热15min后冷却,定容,在波长543nm处测定Cr(Ⅲ)的吸光度。图4结果表明:加入过量的EDTA对吸光度影响非常微小,为了使络合反应完全, EDTA和Cr(Ⅲ)的物质的量比例需大于7∶1。本实验选择加入4mL的EDTA-2Na溶液。
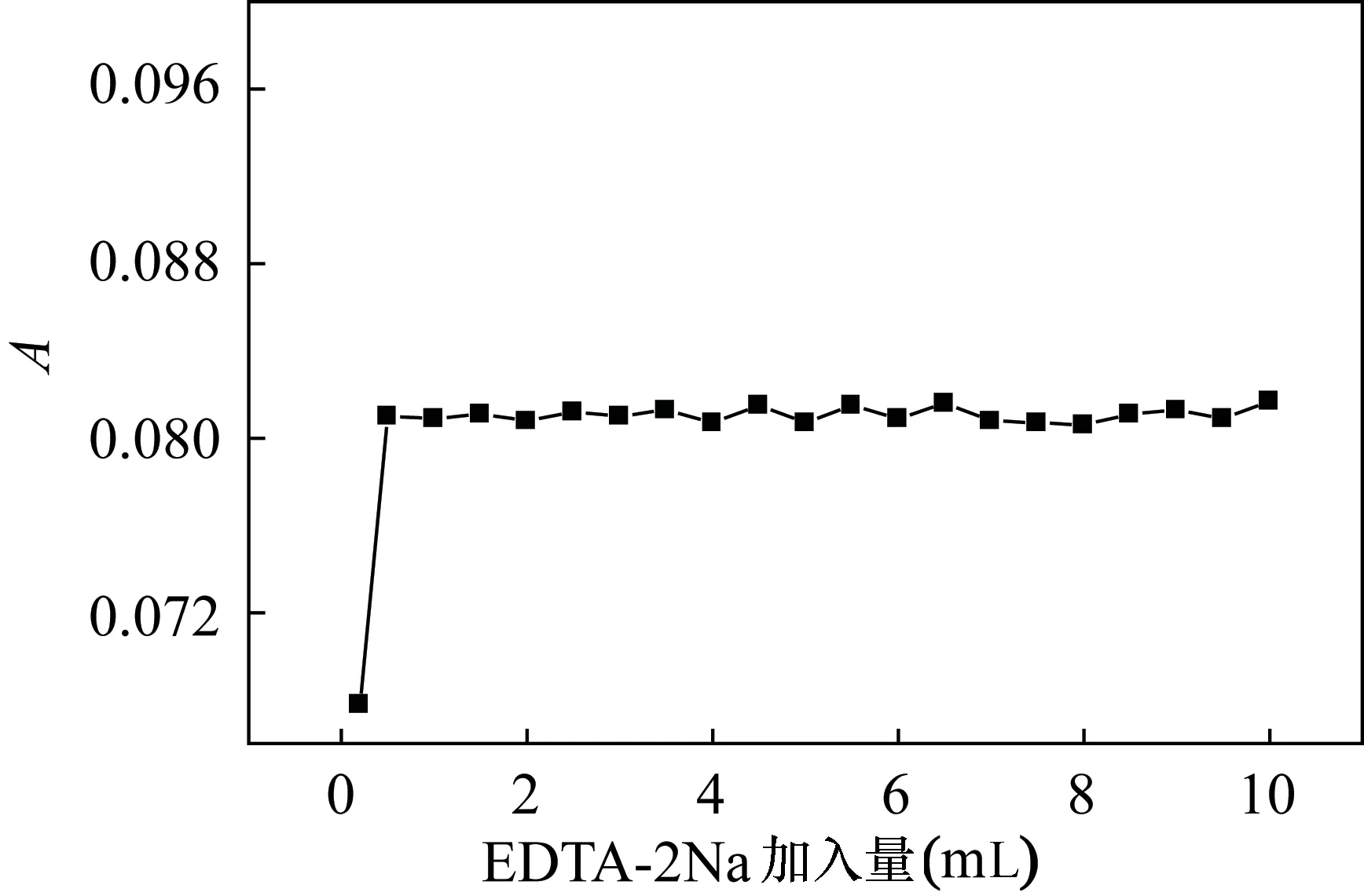
图4 EDTA-2Na加入量对Cr(Ⅲ)吸光度的影响Fig.4 Effect of additions of EDTA-2Na on the absorbance of Cr(Ⅲ)
2.3.3反应时间及温度
用吸量管移取5mL浓度为100mg/L的Cr(Ⅲ)溶液至25mL比色管中,加入EDTA-2Na溶液,调节pH至3~3.5,测定不同时间和不同温度下的吸光度,结果如表1所示。在70℃恒温水浴中,保持加热10min,Cr(Ⅲ)和EDTA即络合完全。本实验选择的反应温度和时间是70℃和15min,在此温度和时间条件下Cr(Ⅵ)溶液的吸光度不发生变化。Cr(Ⅲ)与EDTA-2Na形成络合物后,在3h内吸光度值未发生变化,所以可稳定3h以上。

表1 反应时间及温度对Cr(Ⅲ)吸光度的影响Table 1 Effect of reaction time and temperature on the absorbance of Cr(Ⅲ)
2.4 方法检出限和精密度
按照优化的实验方法,进行11次空白实验,计算测定结果的标准偏差σ,得出Cr(Ⅲ)检出限为0.006mg/L,Cr(Ⅵ)检出限为0.005mg/L。配制8份浓度、比例各不相同的Cr(Ⅲ)和Cr(Ⅵ)混合溶液,按实验方法,每份溶液平行测定6次。实验结果表明,Cr(Ⅲ)和Cr(Ⅵ)的相对标准偏差(RSD)最大值分别为1.24%、0.57%。
2.5 共存离子的影响
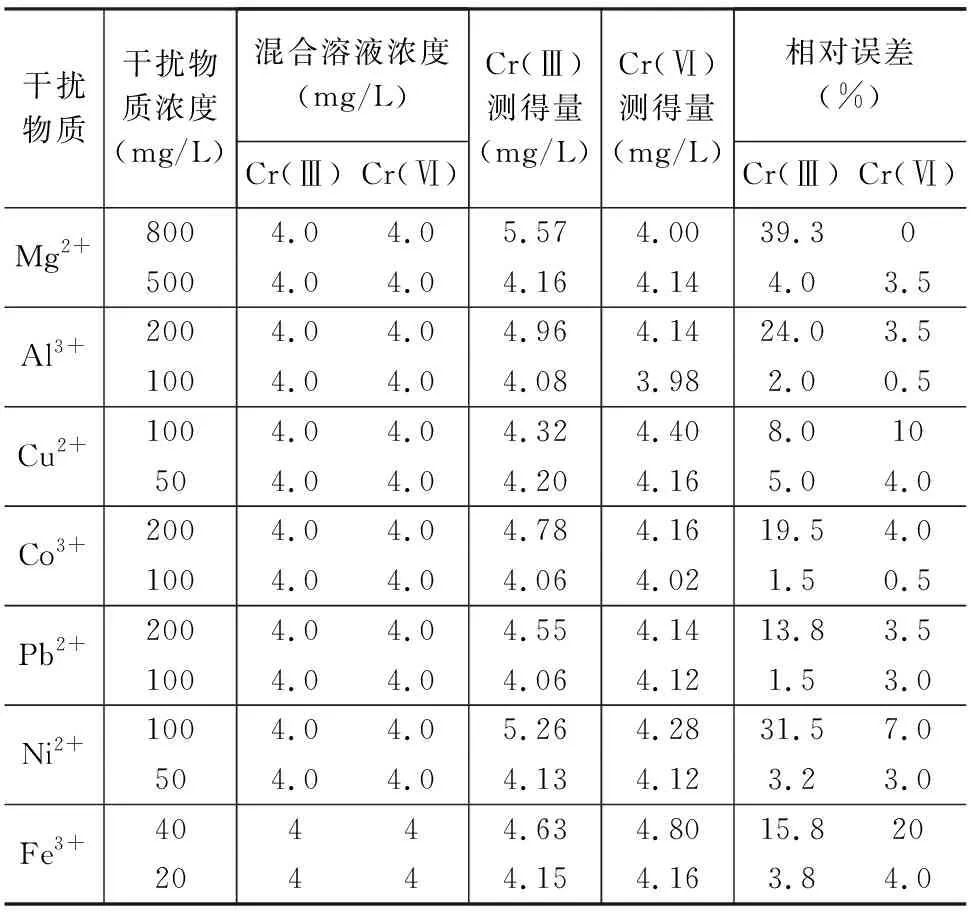
表2 干扰离子对Cr(Ⅲ)和Cr(Ⅵ)测定的影响Table 2 Effect of interferencing ions on the determination of Cr(Ⅲ) and Cr(Ⅵ)
2.6 实际样品分析
取废铬酸洗液及电镀废液2份,先静置澄清,取上清液并用石英砂过滤,除去大的悬浮物及颗粒杂质等,按实验方法测定吸光度和一阶导数值,计算试样中Cr(Ⅲ)和Cr(Ⅵ)含量。然后按标准加入法,加入Cr(Ⅲ)和Cr(Ⅵ)标准溶液,计算加标回收率。由表3测定结果可知,废水中Cr(Ⅲ)和Cr(Ⅵ)加标回收率为97.8%~102.6%,结果满意。
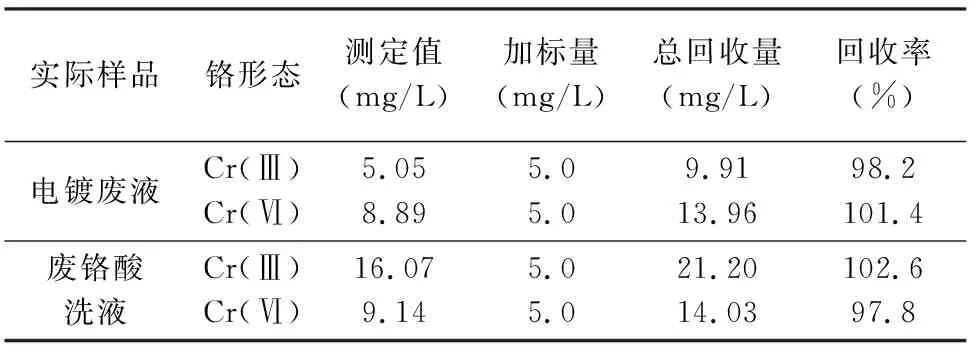
表3 样品中Cr(Ⅲ)和Cr(Ⅵ)的测定结果及加标回收率Table 3 Analytical results and spiked recovery of Cr(Ⅲ) and Cr(Ⅵ) in samples
3 结论
研究结果表明,在波长543nm处Cr(Ⅲ)-EDTA络合物有最大吸收而Cr(Ⅵ)在此处无吸收,在波长350nm处Cr(Ⅵ)有最大吸收而Cr(Ⅲ)-EDTA络合物在此处也有吸收。在波长330nm处Cr(Ⅵ)吸光度一阶导数有最大值,而在此波长处Cr(Ⅲ)-EDTA络合物吸光度一阶导数值为0,可以使重叠峰完全分开。因此,本文用一阶导数分光光度法分别在波长543nm和330nm处对水样中Cr(Ⅲ)和Cr(Ⅵ)进行同时分析测定,其标准曲线线性关系良好,方法的检出限低,精密度高,抗干扰能力强。
一阶导数光谱成功地消除了Cr(Ⅲ)对Cr(Ⅵ)的干扰,为水样中Cr(Ⅲ)和Cr(Ⅵ)的同时分析测试提供了一种简捷、快速、准确的方法。但此方法只能对液态水样的Cr(Ⅲ)和Cr(Ⅵ)进行直接测定,而对固态样品如食品、化妆品和玩具等样品中的Cr(Ⅲ)和Cr(Ⅵ)还需要进行前处理成液态样品才能测定,这类固态样品在前处理过程中可能会造成铬形态之间的相互转化,会使结果出现偏差。项目组将进一步研究固态样品中Cr(Ⅲ)和Cr(Ⅵ)的同时直接测定方法,重点关注前处理过程造成的偏差。
