双向电泳分离水稻叶片蛋白实验教学的改进
2020-11-02王琳杨晓勤陈云
王琳 杨晓勤 陈云
[摘 要] 为了改进水稻叶片蛋白的双向电泳分离方法,采用双向电泳法分离水稻叶片蛋白,比较和分析了两种上样量对实验的影响。改进的上样量灵敏度高,分离条带多且清晰,表明改进的实验方法可以得到更为灵敏、清晰的图谱,能更好地适应和促进实验教学工作。
[关键词] 实验教学;改进;双向电泳;叶片
[中图分类号] Q503 [文献标识码] A [文章编号] 1674-9324(2020)41-0383-02 [收稿日期] 2020-04-02
目前,双向电泳技术是研究蛋白组学十分重要的技术手段,特别是以固相pH梯度等电聚焦为第一向的双向电泳技术是当前分辨率最高,信息量最大的电泳技术。它具有结果直观,分辨率较高,信息量大,技术成熟等优点,因此,此实验也成为本科生生物化学实验中的基础性实验,是生物化学实验教学的重要内容。
在双向电泳中,上样量大小取决于样品中蛋白质的种类、数目、检测方法的灵敏度及胶条的pH梯度范围和长度。不同样品中蛋白的种类、数目有一定差异,所以在检测方法相同,一向IPG胶条pH梯度范围和长度相同的条件下,不同样品的蛋白上样量有差异。为了获得一个分辨效果好和重复性好的双向电泳图谱,得到质量高的水稻叶片蛋白电泳分离效果,找出合适的蛋白上样量很重要。作者在使用双向双向分离水稻叶片蛋白实验的传统方法时发现,根据原来的蛋白上样量分离的蛋白斑点较少且模糊。为了提高水稻叶片蛋白的电泳分离效果,本文对此进行了探讨。
一、方法
(一)常规实验方法
首先采用三氯乙酸-丙酮法提取水稻叶片蛋白。将叶片研磨至叶片成粉末状,加入溶液A(10%三氯乙酸(TCA)和0.07%β-巯基乙醇的预冷丙酮溶07%β-巯基乙醇的冰预冷丙酮溶液)悬浮沉淀。4℃,11000rpm离心15min,弃上清,重复两次,将最终得到的沉淀真空冷冻干燥,然后用Bradford法测定蛋白质含量,最后通过双向聚丙烯酰胺凝胶电泳分离水稻叶片蛋白。称取一定量的水稻叶片冻干样品,溶于裂解液中(7mol/L尿素,2mol/L硫脲,4%CHAPS,2%IPG buffer 4-7,1%DTT),样品超声波处理五次,每次3-5s,间隔3s,于冰水中裂解30min,14000rpm离心20min,取上清,再离心,取上清,以充分去除杂质,获得的蛋白样品除少量用作浓度测定外,其余进行分装,于-80℃保存。每次用之前,将分装的蛋白样品取出,室温下解冻,根据所需总的蛋白质质量取一定体积的蛋白样品,分别加入相应水化液(7mol/L尿素,2mol/L硫脲,2%CHAPS,0.4%DTT,0.5%IPG buffer pH4-7或pH3-10),终体积为350μL,再加入微量溴酚蓝振荡混匀,2000rpm离心1min,将含样品的水化液均匀地加到水化盘中。第一向等电聚焦时,取pH4-7L,18cm干胶条,去掉保护膜,准备水化。把干胶条胶面朝下置于水化盘中水化,加入IPG覆盖液使整个IPG strip被覆盖。水化时间為10-12小时,温度20℃。取出水化好的胶条,胶面朝上置于持胶槽中,胶条正负极与持胶槽正负极要一致,并使胶条与持胶槽两端电极充分接触,加适量IPG覆盖液覆盖整个IPG strip。水化前把样品液加入水化液中。再根据合适的电泳参数进行等电聚焦。等电聚焦结束后,取出胶条,加入平衡液A(6mol/L尿素,0.05mol/LTris-HCI,2%SDS,30%甘油,0.1%DTT,0.002%溴酚蓝)振荡平衡15 min,再换平衡液B(6 mol/L尿素,0.5mol/L Tris-HCl,2%SDS,30%甘油,0.4%碘乙酰胺,0.002%溴酚蓝)振荡平衡15 min,取出胶条轻轻润洗,并去除多余的平衡液,准备第二向电泳。采用分离胶浓度为12.5%的连续SDS-PAGE垂直平板电泳。将已平衡好的第一向胶条置于第二向凝胶的上方,排除气泡,使二者紧密接触。用1%琼脂糖凝胶封固胶条,接通电源,以15℃循环水浴冷却。15mA/块胶恒流电泳30min,待溴酚蓝前沿移至分离胶中后,再增大电流至30mA/块胶,待溴酚蓝前沿距凝胶板底0.5-1cm处,终止电泳。电泳结束后,将凝胶浸泡于固定液(40%无水乙醇,10%冰乙酸)中固定30min或过夜,倒去固定液,以双蒸水洗4次,每次15min,然后在染色液(0.12% CBB G-250,10% ammonium sulfate,10% phosphoric acid and 20% methanol)中染色3~4小时,用蒸馏水漂洗数次,再用脱色液脱色30min,然后用蒸馏水漂洗数次直至背景颜色浅淡,蛋白质点清晰即可,扫描仪扫描胶图。具体方法参照王[5]等。
(二)实验方法的改进
常规的实验方法中的蛋白质样品上样量为100ug。改进的实验方法中蛋白质样品上样量为150ug。
二、结果与分析
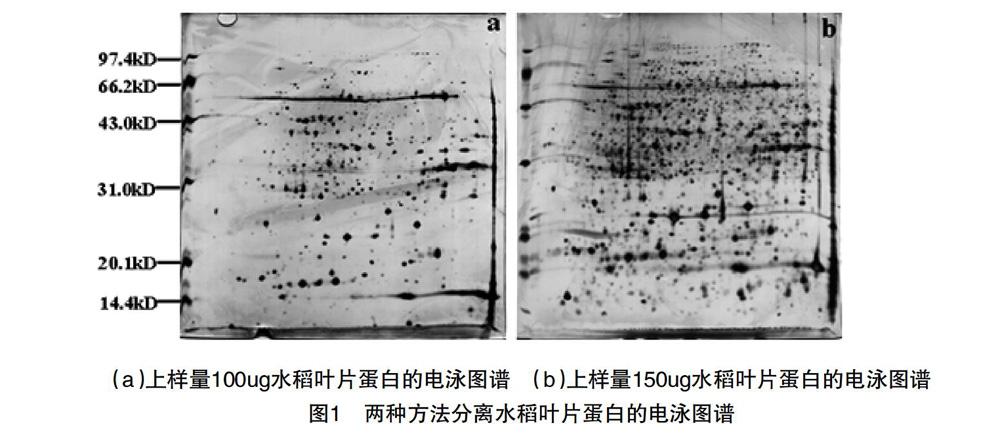
本实验比较了100μg和150μg两个上样量的双向电泳分离水稻叶片蛋白效果,图1(a)上样量为100μg,图1(b)上样量为150μg,虽然图1(a)的背景较浅,但蛋白斑点明显少于图1(b),很多低丰度蛋白在图1(a)中无法检测到,而图1(b)中蛋白斑点相对较多,图1(a)中清晰的蛋白斑点在图1(b)中进一步加深,有些图1(a)中检测不到的点在图1(b)中检测到了。因此150μg的上样量比100μg的上样量更适合水稻叶片蛋白的双向电泳分离。
三、讨论
上样量大小对双向电泳总的蛋白质的覆盖率有很大的影响。控制好上样量,可以得到令人满意的双向电泳图谱,提高重复性,并有利于后续的进一步分析。上样量太小会造成蛋白点稀少,上样量太大会造成一向等电聚焦时电流太大,使得第一向电泳无法达到最佳分离效果;第二向电泳中出现严重拖尾等现象,对结果分析有很大影响。改进的上样量更有利于获得蛋白数量多、背景清楚、灵敏度高的凝胶图像,更适合双向电泳分离水稻叶片蛋白的实验教学。
四、结论
本实验方法克服了双向电泳分离水稻叶片蛋白传统方法的一些不足,如用100ug的上样量改进为150ug的上样量,得到了更为灵敏、清晰的实验结果,更好地适应和促进实验教学工作,也有利于其他老师从中得到启发。
参考文献
[1]陈文静,何海洋,邓秋菊,等.薄壳山核桃蛋白质测定方法比较以及双向电泳体系的建立[J].分子植物育种,2017,15(5):1874-1880.
[2]张鹏飞,黄愉淋,耿双双,等.水牛睾丸曲精细管蛋白质组双向电泳方法的建立及优化[J].基因组学与应用生物学,2019,38(4):1474-1479.
[3]郭尧君.蛋白质电泳实验技术[M].第二版.北京:科学出版社,2005.
[4]梁宋平主编.生物化学与分子生物学实验教程[M].北京:高等教育出版社,2003.
[5]王琳,范云峰,粱建生.双向电泳中不同样品裂解液对水稻叶片疏水蛋白溶解效果比较[J].江苏农业科学,2017,45(18):54-56.
[6]陈凌艳,赖金莉,张力等.适用于花叶唐竹叶片总蛋白的双向电泳体系的建立[J].分子植物育种,2019,17(7):2303-2311.
