应用超高效液相色谱-四极杆-飞行时间质谱建立茶叶中农药残留的筛查与确证方法
2020-11-02乔勇升王俊虎仇雅静钱忠义
乔勇升, 王俊虎, 仇雅静, 钱忠义, 胡 慧, 陈 伟, 王 萍
(泰州市食品药品检验所, 江苏 泰州 225300)
茶是世界上广受欢迎的消费饮料。由于茶多酚、咖啡因和氨基酸等许多功能性成分的存在,茶对人类健康具有广泛的益处[1,2]。但是,茶树在种植和生长中不可避免地要使用农药来保护自身免受杂草、真菌或昆虫的侵害[3],这些农药化合物的残留可以通过食物链进行积累和放大,如果超过一定水平,将会增加对人类健康造成损害的风险[4]。各国政府和国际机构对合法授权的各种农药化合物的最大残留限量(MRLs)制定了严格的法规[5]。这些法规被视为贸易标准,以确保进出口食品、食用农产品的消费安全,降低对健康造成危害的风险。但是法规规定的有害化合物数量有限,评估各类农药在食品的生产、加工及流通等环节的暴露风险迫在眉睫。因此,在最短的时间内,以合理的成本通过一次分析获得样品中尽可能多的农药残留信息,对于检验实验室来说变得越来越重要。
大多数用于监控农药残留的分析方法依赖于气相色谱-质谱(GC-MS)和液相色谱-串联质谱(LC-MS/MS)[6-8]。由于极性、非挥发性和热不稳定等因素[9],液相色谱与质谱联用技术,特别是联用三重四极杆质谱仪被认为是分析各种基质中农药残留最广泛应用的技术。但是这些方法在一次运行中监控的化合物数量有限,并且为了准确定性和定量,必须获得大量的参考标准物质,预设置质谱采集参数。同时意味着它不能检测样品中存在但前期未设置采集参数的化学污染物。因此,针对有毒害的化学污染物质大规模的定向或非定向筛查,迫切需要引入新技术。
高分辨率质谱(HRMS)凭借质量范围广、分辨率和质量精度高、分析速度快等特点,现已成为检验检测扩大分析范围和降低错误率的首选。其主要优点之一是能够以全扫描模式记录无限数量的化合物,使回顾性分析成为可能。并且由于高分辨率、高灵敏性等数据采集特性,HRMS可以对没有参考标准的化合物进行定性筛查分析。质谱仪的数据获取方式包括信息依赖型数据采集模式(data dependent acquisition, DDA)与非信息依赖型数据采集模式(data independent acquisition, DIA),其中DIA模式是指不需对样品中的化合物进行预选择,而是采集所有从色谱中分离出的化合物质谱信息。目前应用最多的是Waters公司开发的MSE扫描模式和Thermo Fisher公司轨道离子阱Orbitrap仪器中的全离子碎片扫描模式(AIF)[5]。基于QTOF-MS/MS技术的MSE全信息串联质谱采集模式,仅需运行一次分析,即可记录所有化合物信息,包括高质量精度的母离子及其碎片离子信息等,从而极大地提高了筛查效率和准确度,特别适合用于定向和非定向筛查与鉴定复杂样品中的有毒有害化合物[6-13]。
茶叶是一种基质成分复杂的样品,本文探索建立针对茶叶样品的大规模定向筛查检测方法。通过对购置的农药认证标准物质(CRM)分析,建立农药质谱数据库。以固相萃取法为净化手段,采用高效液相色谱-四极杆飞行时间质谱(UPLC-QTOF-MS)结合UNIFI软件进行筛查分析。进行定性方法学验证,确定每种农药在茶叶样品中的筛查检出限(SDL)。最后,应用建立的方法分析了流通市场上部分茶叶的农药残留情况。本文建立的方法快速、准确、符合成本效益,适用于茶叶中农药残留快速筛查分析,也为化学污染物残留的高通量筛查检测提供了参考。
1 实验部分
1.1 仪器、试剂与材料
Xevo G2-QTOF四极杆飞行时间质谱仪、Acquity UPLC超高效液相色谱仪、MassLynx V4.1数据处理操作平台,UNIFI 1.7.0科学信息学系统(美国Waters公司); Allegra 64R台式冷冻高速离心机(美国Beckman Coulter公司); Milli-Q Reference超纯水机(美国Millipore公司); XS204型电子分析天平,感量为0.000 01 g(瑞士Mettler Toledo公司); JP-100超声波清洗器(深圳市洁盟清洗设备有限公司)。Cleanert TPT(Triple Phase of Tea SPE)茶叶农残检测专用固相萃取柱(1 g/6 mL,天津Agela公司)
农药混合标准物质(批号CRM42227(含30种农药)、CRM42202(含33种农药)、CRM42230(含21种农药)、CRM42209(含28种农药),浓度均为100 μg/mL,溶剂为乙腈,Sigma-Aldrich贸易有限公司)均为认证标准物质。甲醇、乙腈均为色谱纯(西班牙Scharlau公司),甲苯为色谱纯(美国Tedia公司),乙酸、乙酸铵均为LC-MS级试剂(美国Anaqua公司)、无水硫酸钠为分析纯(国药集团化学试剂有限公司)。尼龙66针式滤膜(0.22 μm,天津津腾公司)。氮气、氩气(>99.999%)。实验用水由Milli-Q超纯水机制备。
样品来源与准备:茶叶样品从流通市场抽取采集,种类包括绿茶、红茶、白茶、乌龙茶、普洱茶等。样品采集后即密封置于4 ℃冰箱中,实验前放至室温粉碎。
1.2 仪器分析条件
1.2.1UPLC-QTOF-MS条件
UPLC条件 色谱柱Waters Acquity UPLC BEH C18(100 mm×2.1 mm, 1.7 μm);柱温45 ℃;流动相A为10 mmol/L乙酸铵溶液(pH 5.0),流动相B为含10 mmol/L乙酸铵的甲醇。洗脱程序:0~0.25 min, 2%B; 0.25~12.25 min, 2%B~99%B; 12.25~13.00 min, 99%B; 13.00~13.01 min, 99%B~2%B; 13.01~15.00 min, 2%B。流速为0.40 mL/min;样品进样量为10 μL。
QTOF-MS条件 离子源温度:120 ℃;脱溶剂气温度:550 ℃;脱溶剂气流速:1 000 L/h;锥孔气流速:50 L/h;毛细管电压:0.8 kV;锥孔电压:20 V;电离模式:ESI正离子模式;扫描模式:分辨率模式。采集模式:MSE模式;质量扫描范围:m/z50~1 200;扫描时间:0.1 s;碰撞能量:低碰撞能量(LE)为4 eV,高碰撞能量(HE)为10~45 eV。LockSpray溶液:亮氨酸脑啡肽(m/z556.277 1),扫描时间0.1 s,间隔30 s。数据的采集通过MassLynx V4.1数据处理操作平台完成。
1.2.2UNIFI软件筛查条件
高能量下响应阈值:20.0;低能量下响应阈值:100.0;背景噪声过滤强度:高;保留时间最大偏差:0.1 min;精确质量偏差阈值:5×10-6;可识别的化合物加合峰形式包括+H、+Na、+K、+NH4峰。碎片(同位素、加合物)质量偏差阈值:10 mDa。
1.3 实验步骤
1.3.1农药质谱数据库的建立
采用UPLC-QTOF-MS对农药化合物的混合标准溶液(2.0 mg/L)进行分析,在MSE模式下从低碰撞能量扫描获得质子化分子、相应同位素及加合物的信息,从高碰撞能量扫描获得主要碎片离子信息。MassLynx软件采集精确质量数、保留时间等数据。将每个化合物的名称、分子式、精确质量数、保留时间、碎片离子、同位素及加合物等信息制成Excel表格,合并各个化合物结构式的mol文件导入UNIFI软件,构建农药化合物质谱数据库。
1.3.2样品前处理
称取粉碎后的试样10 g(精确至0.01 g)于50 mL具塞离心管中,加人30 mL乙腈溶液,在均质机上以15 000 r/min均质1 min, 4 200 r/min离心5 min,收集上清液。残渣重复提取一次,合并上清液入鸡心瓶中,45 ℃旋蒸至近干,加入1 mL乙腈溶解残余物,待净化。
在Cleanet TPT柱中加入约2 cm高无水硫酸钠,并用5 mL乙腈-甲苯(3∶1, v/v)活化固相萃取柱,液面达硫酸钠顶部时,加入样品提取液并收集流出物。以25 mL乙腈-甲苯(3∶1, v/v)洗脱目标物,合并洗脱液,45 ℃旋蒸至近干,以1 mL初始流动相溶解残渣,0.2 μm微孔滤膜过滤后供仪器测定。
1.3.3农药化合物的筛查与鉴定
净化处理后的样品在1.2.1节条件下分析,将采集的数据导入UNIFI软件进行自动谱峰匹配识别,与自建的农药数据库完成比对。筛查参数如保留时间、精确质量数的设置参考SANTE/11813/2017指南《食品和饲料中农药残留分析的方法验证和质量控制程序》[14]。对筛查检测给出的可疑阳性化合物进行人工鉴定确证,考察其碎片离子等相关信息,并在网络数据库上进行检索比对。
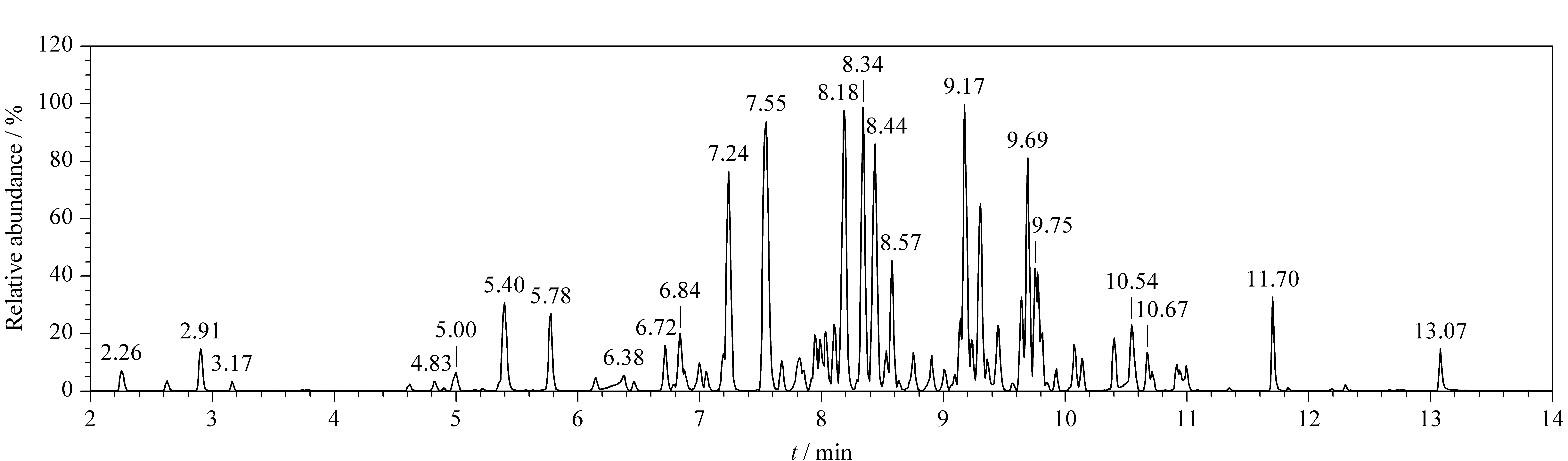
图 1 有机溶剂中农药混合标准溶液(2.0 mg/L)的总离子流色谱图Fig. 1 Total ion chromatograms (TICs) of pesticide mixture standard solution at 2.0 mg/L in organic solvent
1.3.4方法学验证
参考SANTE指南[14]对建立的筛查方法完成方法学验证,筛查方法的置信度以SDL表示。SDL在指南中定义为已证明在至少95%的样品中可以检测到某种分析物(不一定符合明确的鉴定标准)的最低浓度(即接受5%的假阴性率)。
选取21份茶叶空白样品(其中包括14份绿茶、3份红茶、2份乌龙茶和2份白茶),分别添加混合标准溶液至4个水平(0.01、0.05、0.10、0.20 mg/kg)后进行前处理和仪器分析。
1.4 实际样品筛查检测
选取22份茶叶样品(其中包括9份绿茶、7份红茶、4份乌龙茶、1份白茶和1份普洱茶), 应用本文建立的方法进行筛查检测。每批实际样品检测前,运行质量控制程序,依次分析标准添加样品、试剂空白、实际样品、试剂空白、标准添加样品。根据标准添加样品中随机挑选的10种农药检测情况判断筛查系统是否正常运行。
2 结果与讨论
2.1 数据库的建立
由于农药数据库是为同时进行多种类化合物筛查而创建的,因此尽可能多地涵盖农药品种非常重要。根据Krauss等[15]的观点,使用高分辨质谱分析化合物有3种思路:1.有参考标准的定向分析;2.无参考标准的可疑半定向分析;3.非定向分析。本文在第一种思路下进行分析,使用农药参考标准物质建立质谱数据库。
本文共收集112种标准物质(均为CRM认证),品种涵盖杀真菌剂、杀虫剂、除草剂等农药及农药代谢产物。配制质量浓度为2.0 mg/L的农药混合标准溶液,QTOF-MS在预设的低碰撞、高碰撞能量下完成数据采集,总离子流图如图1所示。收集每个化合物的精确质量数、保留时间、碎片离子等信息,并与PubChem、MassBank等网络数据库进行比对。将每个农药化合物的信息汇总导入到UNIFI软件中。在112种农药中,有23种农药暂时不能在本实验条件下进行分析,其余91种农药化合物的分子式、单一同位素质量、保留时间和主要诊断离子等数据见表1。
由表1可知,91种农药化合物中有72种(占总数的79.1%)采用质子化分子作为诊断离子,18种(占总数的19.8%)采用碎片离子作为诊断离子,1种化合物(杀线威)(占总数的1.1%)采用钠加合物作为诊断离子。在大多数情况下,质子化分子丰度最高;少数情况,无论在低碰撞能量还是高碰撞能量下,目标物碎片离子丰度比质子化分子的丰度高很多,选用碎片离子作为诊断离子;个别情况下,钠加合物为丰度最高的离子。2017年Patricia等[16]对食品中630种污染物进行多残留筛查方法研究,发现约20%的化合物在诱导碰撞解离(CID)产生的碎片比相应的(去)质子化分子更丰富,少数化合物(4%)中钠或铵加合物被确定为最丰富的离子。
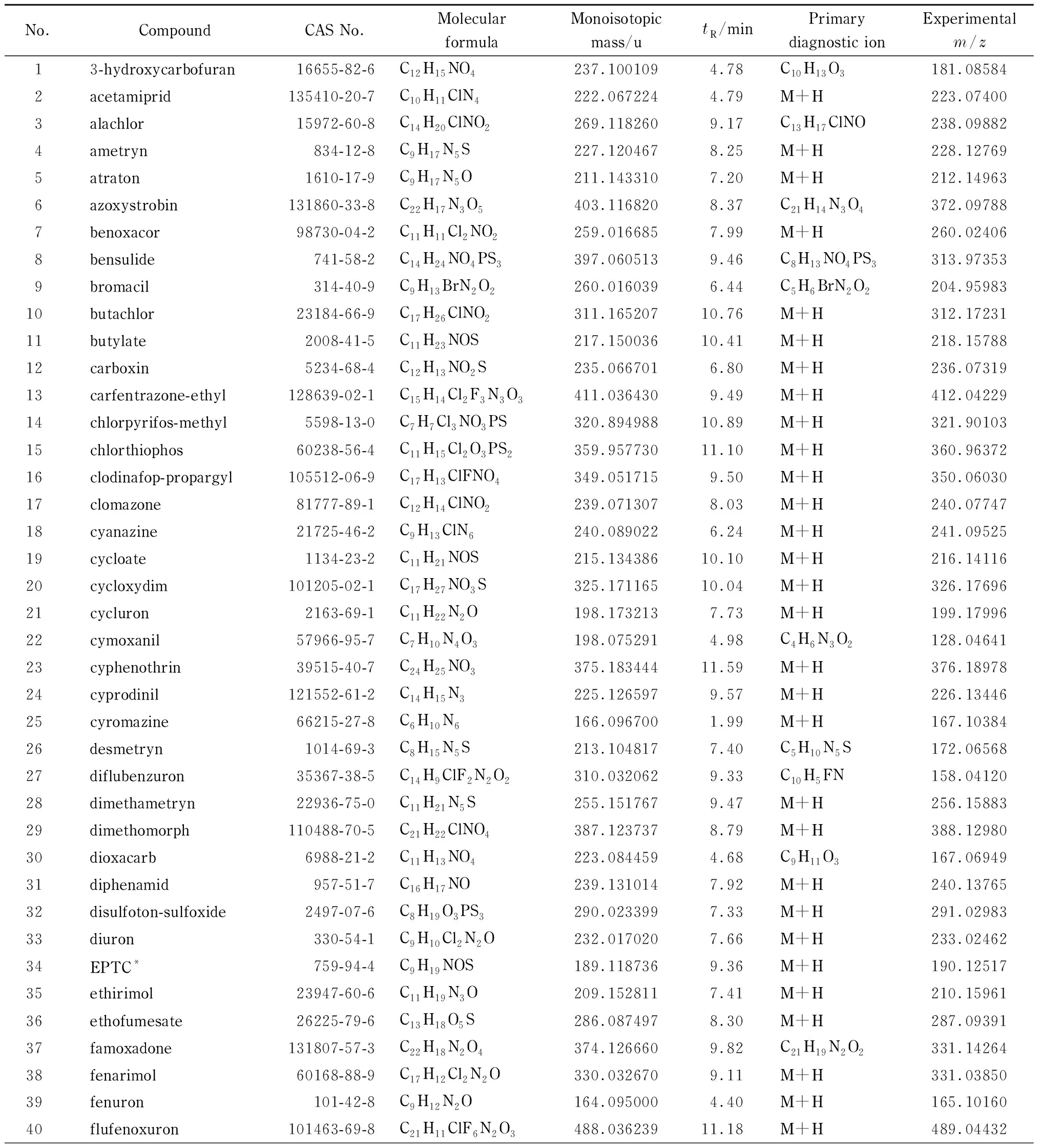
表 1 农药化合物的准确质量数据库(包括元素组成、单一同位素质量、保留时间和主要诊断离子及其质荷比实验值)
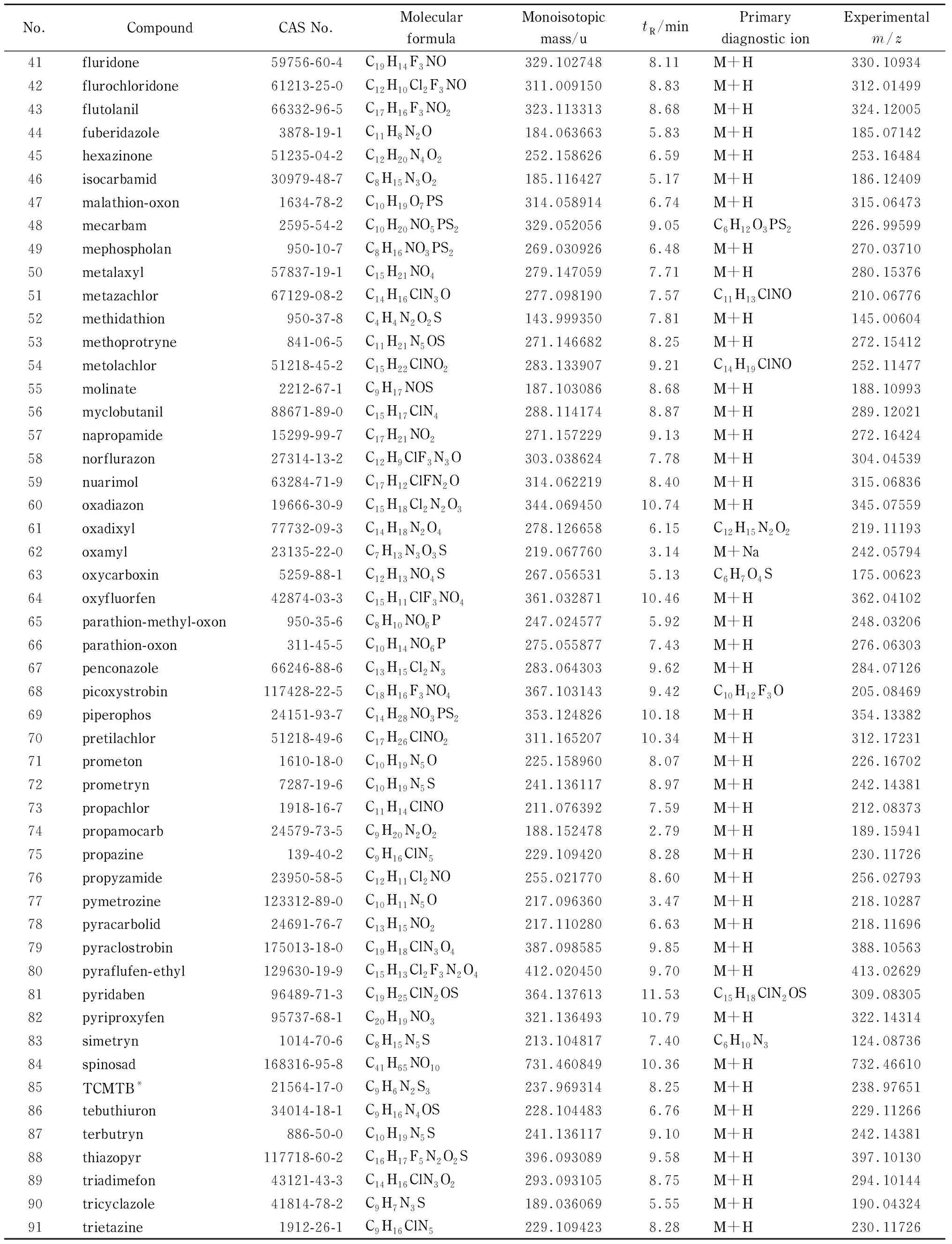
表 1 (续)

2.2 自动筛查参数的设置、优化
在使用数据处理软件进行自动筛查分析时,参数的优化设置对于报告结果中假阳性和假阴性之间的适度平衡是至关重要的。假阳性的存在意味着软件报告了检出,但随后无法通过人工验证程序,其出现会触发后续的鉴定确证流程,造成检测资源的浪费,影响筛查方法的有效性。假阴性是指化合物在样品中存在,但未通过筛查与确证程序检出目标残留的情况,其出现造成检测结果的漏判,影响真实性。在定性筛查工作中,应尽可能降低假阳性误报的数量,并保证假阴性的数量可接受(<5%)[17]。与此同时,如何在流程中尽量减少人工干预,也对参数的设置提出了更高的要求。
基于DIA的采集模式获取完整且不受限制的大量数据集,其中包括高度卷积的MS/MS谱,这需要用合适的软件来提取有用的信息。本文使用UNIFI软件完成这一复杂任务,其数据处理分两步进行:首先进行峰值检测,然后应用目标筛查参数匹配识别[18]。本文设置的筛查参数主要有保留时间最大偏差、目标物(和碎片)精确质量偏差阈值、化合物加合峰形式(M+H、M+Na、M+K、M+NH4),具体参数设置参照1.2.2节。在实际工作中,对筛查参数的优化是一个工作量很大,并且在一定程度上难以取舍的过程。
保留时间是筛查检测的重要参数。保留时间偏差窗口设置太宽可能会产生假阳性误报,反之,可能会产生假阴性误报。在筛查过程中发现,与Gómez-Ramos等[19]、Mol等[17]描述一致,在正常适应情况下,色谱系统具有一定的稳定性,保留时间的偏差通常不大(小于0.1 min),个别情况下,保留时间会有较大偏差(大于0.1 min)。保留时间产生较大偏差很可能受到基质的影响[19],另一方面,色谱环境也能影响目标物的保留时间,这对仪器设备的使用及维护保养提出了更高的要求。
精确质量偏差阈值是筛查检测的关键参数,为明确的鉴定提供高度的特异性和选择性。与较低分辨率的质谱仪器相比,HRMS精确的质量测量可以更加准确地鉴定复杂基质中的目标分析物。多数研究认为,鉴定所要求的质量偏差阈值应不超过5×10-6,甚至应更低。2010年Bienvenida等[20]使用LC-TOF-MS测定水果软饮料中的35种多种农药,其中超过90%的农药质量偏差低于2×10-6。在本文研究范围内,观察到有约50%的农药质量偏差低于2×10-6。因此基于本文实验条件,选择5×10-6作为精确质量偏差阈值更为合适。随着现代仪器设备精度的快速发展,相信可以用更窄的质量偏差阈值分析更多的化合物。除了质量偏差和保留时间外,其他参数(例如加合物、同位素模式)的使用也有助于提高选择性、降低错误检测率。
2.3 鉴定与确证
分析物的鉴定与确证是对假阳性的评估。SANTE指南[14]中描述“鉴定与确证”需要满足以下条件:1)至少两个精确质量离子(其中至少有一个碎片离子)质量偏差不超过5×10-6; 2)母离子和碎片离子的提取色谱图保留时间完全重合(基质匹配条件下); 3)试样与标准溶液中离子相对丰度的偏差最好不超过30%。在UNIFI软件筛查参数的设置中已经涵盖了鉴定条件的前两条,并且还增加了加合物离子、同位素模式等参数。
在软件给出的筛查结果中,我们还需手动对可疑检出化合物进行鉴定与确证。首先,考察可疑检出化合物的色谱峰形。其次,计算样品与参考标准的离子相对丰度。另外,除了与参考标准比对外,还可以与PubChem、MassBank等数据库进行检索比对。
2.4 方法学验证
对于筛查检测的定性验证工作非常繁重,也经常被忽视,其验证过程侧重于可检测性[14],主要目的是在给定的水平下识别阴性和阳性样品,确认筛查方法的边界。本文以SDL作为主要验证参数。目前很多国家和国际组织对于茶叶的农残都设定了MRLs,比如日本规定与茶叶有关的农药种类有276种,MRLs为0.10~50.0 mg/kg;欧盟规定的有453种,MRLs为0.01~30.0 mg/kg;我国限量标准GB 2763-2019《食品中农药最大残留限量》规定了483种农药在356种(类)食品中的农残限量。其中有65种涉及茶叶中农药MRLs的规定,MRLs为0.01~50 mg/kg。本文设置方法学验证的最低浓度水平为0.01 mg/kg。
茶叶是基质复杂的样品,频繁筛查分析时须进行充分的验证[14]。本文从流通市场选取21份茶叶样品作为空白基质样品进行方法学验证。在21份茶叶样品中分别添加混合标准溶液至4个水平(0.01、0.05、0.10、0.20 mg/kg),然后参照1.3.2节和1.3.3节进行筛查检测,通过对筛查结果的分析确定91种农药的SDL,实验结果见表2。实验中要保证≤5%的假阴性率,同一浓度水平需要≥20个样品检出阳性方可确定为SDL值。
由表2可知,通过对1 911种农药/样品组合的评估,发现有66种农药的SDL为0.01 mg/kg, 8种农药的SDL为0.05 mg/kg, 1种农药的SDL为0.10 mg/kg, 3种农药的SDL为0.20 mg/kg,共有13种农药的SDL大于0.20 mg/kg。
在本文的考察范围内,SDL高于0.01 mg/kg的25个农药品种中,哒螨灵的SDL为0.05 mg/kg, GB 2763规定的MRLs为5 mg/kg,本方法SDL低于GB 2763的MRLs;氟虫脲、吡蚜酮的SDL都大于0.20 mg/kg, GB 2763规定的MRLs分别为20、2 mg/kg,这两个农药品种的SDL还需进一步确定。
部分农药品种的SDL大于0.20 mg/kg,原因可能是由于目标化合物在前处理时损失较大,如灭蝇胺、苯醚氰菊酯、氟虫脲等。其次,部分目标物在本实验条件下不能很好地电离,在质谱上的响应信号较弱,如茵草敌、苯噻硫氰、乙氧氟草醚、丁草敌等。在本文的考察范围内观察到,在质谱上的响应比较弱的化合物(不仅限于以上提到的几种化合物),多数具有在水中溶解度低的化学特性。比如,根据PubChem数据,苯噻硫氰的水中溶解度为5.24×10-4mol/L,乙氧氟草醚的水中溶解度为2.98×10-7mol/L,丁草敌的水中溶解度为2.07×10-4mol/L。
2.5 基质效应
基质效应普遍存在于质谱分析中,质谱分析中的基质效应由目标分析物的共提取组分互相作用,影响分析物电离所致,表现为离子增强或抑制作用[21]。针对定性筛查方法,SANTE指南[14]并没有给出基质效应的评价方法。通常,定量检测的基质效应评价方法主要有柱后注射法与提取后添加法[22],本文参考2003年Matuszewski等[23]提出的提取后添加法对定性筛查方法的基质效应进行初步评价。选取质谱信号较低的3个茶叶样品作为空白基质,按照1.3.2节进行前处理净化,获得空白基质提取液。分别使用初始流动相和空白基质提取液配制4个质量浓度(0.1、0.5、1.0、2.0 mg/L)的混合标准工作溶液,每个浓度样品分别平行制备2份,按照1.3.3节进行筛查分析。
结果显示,在91种农药化合物中仅发现乙氧氟草醚农药有较明显的基质效应。其在流动相溶剂中的质量浓度为0.5 mg/L时即可被筛查系统确认检出,在空白基质中需添加标准至2 mg/L才能被筛查系统确认,存在基质抑制效应。本文考察基质效应的样品数量较少,之后还需要在更多样品基质中进行验证。2014年,Rajski等[24]的研究认为绿茶样品提取物会产生信号抑制问题,可能会对灵敏度产生负面影响。一般来说,减轻基质效应的影响,通常采用稀释样品提取液或减少进样体积等方法[25]。使用离子淌度质谱分析也可以有效降低基质效应的影响,碰撞截面(CCS)值可用于复杂基质的筛查检测,并且更好地降低了假阳性的出现率[16,26]。
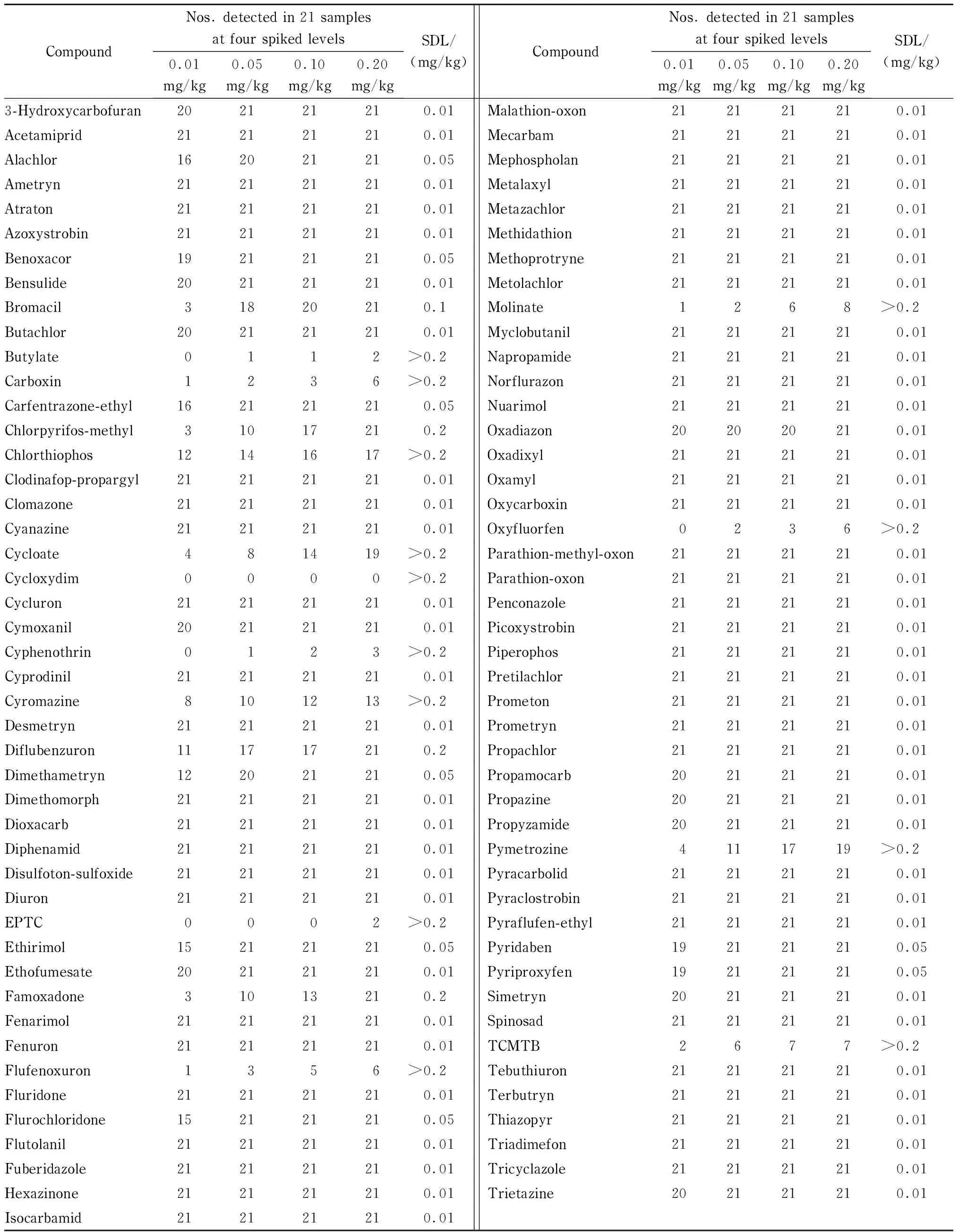
表 2 91种农药在21份不同茶叶样品中进行定性筛查检测的方法学验证结果
2.6 实际样品的分析
参考2015年Wang等[9]的方法,在每批实际样品分析前,进行系列质量控制以检查筛查系统是否正常运行。以0.01 mg/kg水平的基质标准添加样品作为标准添加样品、提取过程空白样品作为试剂空白,按照1.4节描述的顺序,分别在实际样品序列前后进样检测。选取非草隆、地胺磷、氟酰胺、吡草醚等10种农药化合物作为验证参考靶标,同批进入筛查系统分析。确保在前处理过程中没有引入实验室污染,筛查系统正常运行。


图 2 绿茶样品中吡唑醚菌酯的UPLC-QTOF-MS色谱图Fig. 2 UPLC-QTOF-MS chromatograms of pyraclostrobin in green tea samples a. [M+Na]+; b. [M+H]+; c. fragment ion m/z 356.07895; d. fragment ion m/z 296.05830; e. fragment ion m/z 194.08195. Acquisition mode: MSE mode; collision energy: LE (low energy) 4 eV; mass extraction window: ±5×10-6.

表 3 绿茶阳性样品中吡唑醚菌酯的鉴定数据
图2与表3为某品牌碧螺春样品中吡唑醚菌酯的鉴定与确证结果。吡唑醚菌酯的分子式为C19H18ClN3O4,在电喷雾正离子模式下可获得稳定的[M+H]+和[M+Na]+加合离子峰,在低碰撞能量下即可裂解成若干碎片离子。由图2观察到,吡唑醚菌酯可裂解成3个片段(m/z356.078 95,296.058 30和194.081 95)。[M+H]+离子可脱去CH4O形成m/z356.075 25 [M+H-CH4O]+,或脱去C3H8O3形成m/z296.058 30 [M+H-C3H8O3]+,并进一步裂解形成m/z194.081 95的碎片离子。本文观察的吡唑醚菌酯裂解情况与MassBank数据库中LC-ESI-QTOF谱图中描述一致。由图2可知,[M+H]+离子在色谱图上的保留时间为10.36,与加钠离子和3个碎片离子的提取色谱图完全重叠。诊断离子及碎片离子的精确质量和离子相对丰度的偏差见表3, 3个碎片离子精确质量的偏差均不超过5×10-6。
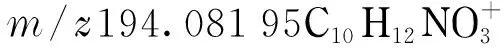
3 结论
本研究介绍了使用UPLC-QTOF-MS对茶叶中91种农药残留进行定向筛查方法的开发和验证,并将其应用于流通市场上茶叶样品的农残筛查检测。收集农药参考标准物质,在MSE模式下进行全信息采集,建立QTOF精确质量质谱数据库。使用软件完成自动筛查工作,结合准确质量数、保留时间、碎片离子信息、同位素模式与加合物等信息进行识别,降低错误识别出现的风险。参照SANTE指南[14]完成定性筛查方法学验证。检查21种不同茶叶中91种农药的筛查可靠性,评估了1 911种农药/商品组合,确定了78种农药的SDL,剩余13种农药SDL大于0.20 mg/kg。在实际样品测定中发现流通市场上的部分样品检出农药残留,并进行了鉴定确证。之后的工作中使用三重四极杆质谱仪将筛查出的污染物纳入定量分析的监测程序中。这个例子清楚地表明,如果没有全面筛查方法,可能会导致低估食品中存在的农药及代谢物残留总量的风险。
本文在质谱的正离子模式下考察部分农药化合物,之后还将在负离子模式下建立分析方法。如今,分析仪器技术的飞速发展,对分析的准确度与灵敏度都提出了更高要求。HRMS提供高分辨率、高全扫描灵敏度和选择性,使其对食品中的污染物的残留分析极具吸引力。更多的实验工作使HRMS的研究范围扩展到其他类型的污染物,或是进行非目标残留物筛查,但随之也必须匹配适当和切实可行的质量控制程序。规模化的筛查、鉴定与量化终将在单次常规分析中融合。
