抑制曲霉菌的乳酸菌分离及鉴定
2020-10-30李利红刘海荣贺莹
李利红 刘海荣 贺莹

摘要:以萝卜、酸黄瓜和泡椒3种市售腌制酱菜为试验材料,采用溶鈣圈法分离纯化疑似乳酸菌,采用革兰氏染色、过氧化氢酶和双层平板等方法筛选抑菌性菌株,采用生化鉴定和糖发酵鉴定其种属。结果表明:从3份酱菜样品中分离到40株疑似乳酸菌,筛选出3株(S1、S6、P5)对黑曲霉菌具有抑制性,2株(S6、S7)对黄曲霉具有抑制性,发现菌株S1、S7为发酵乳杆菌,菌株S6、P3为植物乳杆菌。
关键词:乳酸菌;曲霉菌;抑菌;分离鉴定
中图分类号 S816.3 文献标识码 A 文章编号 1007-7731 (2020) 16-0040-03
霉菌是一种能形成分枝菌丝的真菌,是对一类丝状真菌的统称。黄曲霉素是一种致癌物,致癌力居首位,是目前已知最强致癌物之一,在食品中污染非常广泛[1]。黑曲霉可以分泌葡萄糖苷酶等蛋白,也可吸附重金属离子,对动物肾脏造成不可逆的致死毒害,并可导致孕妇流产甚至死亡[2]。有研究表明,乳酸菌有抑制杂菌作用,但是从发酵型食品中筛选具有抑菌菌株的研究较少。乳制品中常见的菌种有保加利亚乳杆菌、干酪乳杆菌、双歧杆菌和嗜热链球菌[3-4],而发酵类蔬菜中常见的菌种有植物乳杆菌和发酵乳杆菌等[5]。每天摄入定量的活菌乳酸菌,可有效地预防和缓解微量元素引发疾病。更为重要的是,乳酸菌为兼性厌氧菌,缺氧环境利于其快速生长,间接对致病杂囷形成抑制,有效控制肠道内菌种,减少有害菌引发疾病[6-7]。目前,化学防腐剂的应用有效地控制了腐败变质,但化学防腐剂具有副作用,如致癌等,国家对有害食品添加剂发布禁令,限制或限量使用。因此,筛选广谱高抑菌活性的乳酸菌,且应用于食品的生产及保存,具有重要的实践意义[8-9]。
1 材料与方法
1.1 试验材料
1.1.1 分离样品 市售腌制酱菜酸黄瓜、萝卜、泡椒。
1.1.2 指示菌 标准霉菌:黑曲霉ATCC16404(上海鲁微科技有限公司);黄曲霉AS3.3950(上海鲁微科技有限公司)。
1.1.3 培养基 MRS培养基、PDA培养基,实验室自配[10-11]。
1.1.4 主要试剂 革兰氏染色液:上海海博生物;对二甲氨基甲醛:天津致远试剂有限公司;明胶:上海制成化学试剂有限公司;30%过氧化氢:天津风船化学试剂科技有限公司。
1.1.5 主要仪器 高压蒸汽灭菌锅(LDZX-50KBS):上海申安医疗器械厂;超净工作台(ZHJHC1112B):上海智城分析仪器制造公司;恒温培养箱(SPX-250):上海跃进医疗器械有限公司;生物显微镜(SMART):重庆奥特;涡旋振荡器(MS3 basic): IKA;电子天平(CPA225D):赛多利斯科学仪器有限公司;电热鼓风干燥箱(BGI-146):上海博讯实业有限公司;紫外分光光度计(UV-31OOPC):上海美普达仪器有限公司。
1.2 试验方法
1.2.1 乳酸菌分离 乳酸菌富集:在超净工作台中,用无菌操作方法,取少量酱菜样品于MRS液体培养基,37℃恒温厌氧(放入干燥器中,点燃酒精灯后密闭)培养24h。梯度稀释:将培养液充分震荡,取培养液1 mL,加入含9mL无菌水的干净试管中,则浓度为10-1;充分振荡混匀后,再从10-1稀释液中取1mL加入另一支含9mL无菌水干净试管中,则浓度为10-2;依此类推稀释到10-6,应注意无菌操作,试管和移液枪枪头都应灭菌,且每次更换移液枪枪头。乳酸菌分离:将含3%CaC03的MRS琼脂培养基灭菌冷却至50℃,倾倒入无菌培养皿15mL,待其凝固后,吸取稀释液10-3、10-4、10-5、10-6各0.1 mL于培养基中,涂布均匀,37℃恒温厌氧培养24h,待其长出菌苔后观察,平板菌落数20~20()[12]。
1.2.2 乳酸菌初步鉴定
1.2.2.1 革兰氏染色鉴定 参见文献[13]。
1.2.2.2 过氧化氢酶活性鉴定 用接种环挑取一环革兰氏染色为阳性(紫色)的菌落到干净载玻片,滴加一滴3 %过氧化氢,产生气泡为阳性,不产生为阴性。过氧化氢酶阴性菌落可初步确定为乳酸菌。
1.2.3 分离菌落纯化 将初步鉴定为乳酸菌的菌株,在MRS琼脂培养基反复划线,得到单个菌落,转接至试管斜面,4℃冷藏保存以备后续实验使用[14]。
1.2.4 抑制霉菌活性的乳酸菌筛选
1.2.4.1 霉菌孢子液制备 取冷藏保存菌种,PDA试管斜面划线活化,28℃恒温培养5d,至大量孢子产生,向试管中加入5mL无菌水,用接种环轻轻刮取,充分振荡,经无菌纱布过滤菌丝残体后倒出。取1mL孢子悬浮液,10倍浓度梯度稀释,取10-2、10-3、10-4各0.1 mL涂布于PDA平板,28℃恒温培养2d,察生长密度,菌落数适宜浓度30~300。
1.2.4.2 抑菌菌株筛选 双层平办法:倒入MRS琼脂培养基作为下层平板,将分离得到的乳酸菌在MRS平板划2条长2cm的平行直线,37℃恒温培养24h,至长出菌苔,再倒入含有霉菌孢子的PDA琼脂培养基作为上层平板,28℃恒温培养2d,以接种霉菌孢子但不接种乳酸菌为空白对照,观察霉菌生长面积,测量计算抑菌率。计算公式如下:
抑菌率(%)=(S-SM1)/(S-SM0)×100 (1)
式中:S为平板总面积,cm2;SM1为试验组霉菌生长面积,cm2; SM0为对照组霉菌生长面积,cm2。
1.2.5 抑菌乳酸菌理化鉴定
1.2.5.1 明胶液化试验 将斜面保藏的菌株2次传代培养后,按照1%的接种量接种于明胶基础培养基中,每个菌株接10支试管,每支以不接种的试管为空白对照。在37℃恒温厌氧培养,每隔2d分别取2支试管和空白组进行观察。先将试管置于冰箱冷冻至空白组凝固,若空白组培养基凝固而试验组培养基不凝同,则为明胶液化阳性,否则为阴性。
1.2.5.2 产生试验 将滤纸剪成约0.5~0.6cm寬的纸条,长度根据试管而定,用80g/L乙酸铅溶液浸润,烘干。将斜面保藏的菌株2次传代培养后,按照1%的接种量接种于硫化氢培养基中,镊子子夹取1 一条乙酸铅纸条,悬挂于接种试管内,下端靠近培养液,以上部分不接触,用棉塞塞紧,37℃恒温厌氧培养48h,在不接种的试管内悬挂纸条作为空白对照。观察纸条是否有黑色物质产生,若有为阳性,否则为阴性。
1.2.5.3 吲哚试验 将斜面保藏的菌株2次传代培养后,按照1%的接种量接种于H2S液体培养基中,并设置空白对照。37℃恒温厌氧培养4d后,沿管壁缓慢加入吲哚试剂数滴,观察分界处若有红色产生,则为阳性,否则为阴性。
1.2.5.4 淀粉水解试验 将斜面保藏的菌株2次传代培养后,用无菌生理盐水稀释105倍,吸取0.1 mL涂布于淀粉培养基上,并设空白对照。37℃恒温厌氧培养2d长出菌苔后,向平板上滴加碘液,观察颜色变化。若空白组明显变蓝,而试验组无明显颜色变化,则为淀粉水解酶阳性,否则为阴性。
1.2.5.5 V-P试验(乙酰甲基甲醇试验)将斜面保藏的菌株2次传代培养后,按照1%的接种量接种于V-P试验培养基中,并设空白对照。37℃恒温厌氧培养24h后,取2mL培养液加入等体积的40%氢氧化钠溶液混匀,再加入1mg肌酸,充分振荡后静置30~60min,观察颜色变化,若颜色变红,则为阳性,否则为阴性。
1.2.5.6 乳酸菌碳水化合物发酵试验 将斜面保存的乳酸菌菌种接种至MRS液体培养基,2次传代培养后,去0.05mL培养液接种至碳水化合物发酵培养基,37℃恒温厌氧培养(表1)。结果判定:阳性结果为培养基中的颜色变黄;弱阳性结果为培养基的颜色部分变黄;阴性结果为颜色不变,与不含糖类的对照管相同。
2 结果与分析
2.1 乳酸菌分离结果 根据菌落生长情况,稀释浓度为10-5,选择该浓度进行后续试验。菌落为乳白色,表面光滑,呈圆形,酸黄瓜和泡椒中菌株为杆状,萝卜中菌株为球状。3种样品中的菌落,萝卜中菌株没有溶钙圈,泡椒中有20株,酸黄瓜中有25株。对具溶钙圈菌株进行革兰氏染色,结果共有40株G+、5株G-。再对40株G+菌株进行接触酶试验,结果都为阴性,可初步确定为乳酸菌,分别编号为P1~16,S1~24,转接至试管斜面保存。
2.2 菌株筛选结果 通过观察涂布霉菌孢子的平板菌落数,霉菌孢子悬浮液1 mL稀释100倍,涂布0.1 mL菌落数较为合适。通过双层平办法,结果显示共有3株菌株(S1,S6, P5)对黑曲霉菌抑制效果较显著,2株菌株(S6,S7)对黄曲霉抑制作用较显著,S1对黑曲霉抑菌率为26%,S6对黑曲霉抑菌率为36%,P5对黑曲霉抑菌率为28%,S6对黄曲霉抑菌率为24%,S7对黄曲霉抑菌率为23%。
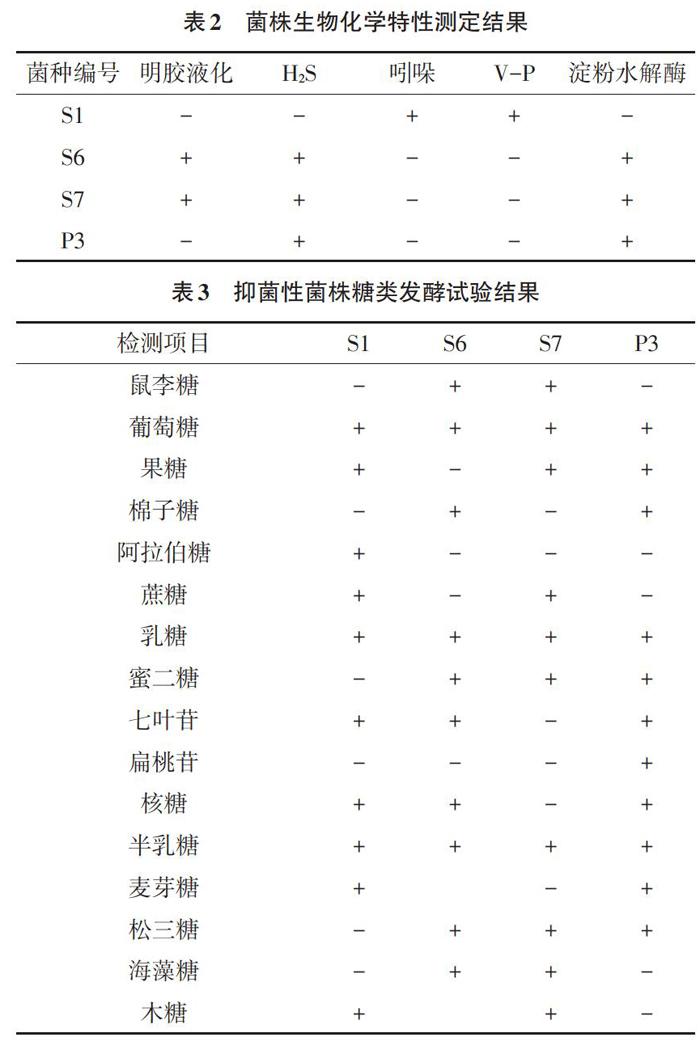
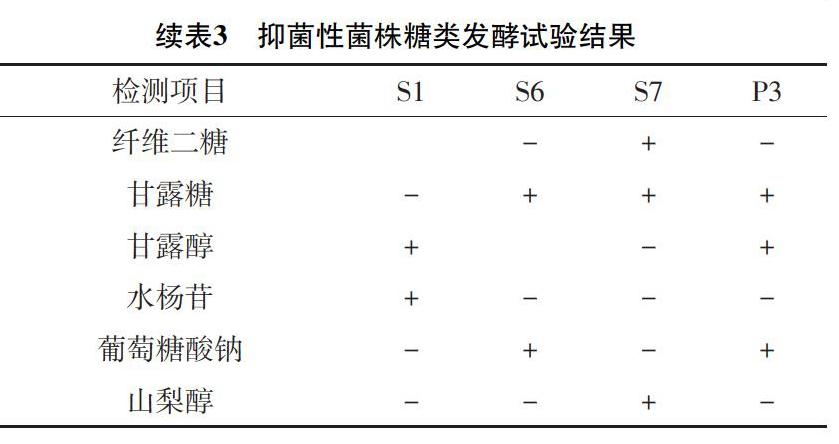
2.3 生理生化鉴定结果 由表2和表3可知,根据《常见细菌系统鉴定手册》鉴定,菌株S1、S7为发酵乳杆菌,S6、P3为植物乳杆菌。
3 结论
本试验以3份市售酱菜为材料,分离得到45株疑似乳酸菌;经形态学和生理生化鉴定,其中40株菌株初步确定为乳酸菌;以黑曲霉菌和黄曲霉菌为指示菌,采用双层平办法筛选出4株具有抑制霉菌活性菌株;通过生理生化鉴定和糖发酵试验,鉴定菌株分别为发酵乳杆菌和植物乳杆菌。
参考文献
[1]石金鑫.抗霉菌乳酸菌的筛选及其应用研究[D].渤海:渤海大学,2016.
[2] 周康,陶光灿,李勇,等.酶联免疫吸附法检测伺料中赭曲霉毒素A[J].湖北农业科学,2013,52(14):346-358.
[3] 钱洋.乳酸菌对食品中常见霉菌的抑制和黄曲霉素的去除[D].济南:山东大学,2012.
[4] 谢莉敏,李丹,程秀芳,等.益生菌的种类及其在人体营养保健中的应用研究[J].安徽农业科学,2013,41 (17): 74-79.
[5] 李晓忱.酸菜中乳酸菌分离鉴定的研究进展[J].品牌与标准化,2016(02):55-56,82.
[6] 赵娜,李晓东,刘滨城.保健型乳酸菌饮料的研制[J].中国乳业,2003(07):36-37.
[7] 吴正钧.益生菌及其益生作用[J].上海奶牛,1999(01 ):37-40.
[8] 华鹤良.乳酸菌的分离鉴定及其抗菌肽与发酵性能研究[D].扬州:扬州大学,2014.
[9 ]王芳,罗红霞,朱建成,等.益生菌抗癌功能及作用机制研究进展[J].食品工业科技,2009,30(12): 462-465.
[10]郭翔.降胆同醇益生乳酸菌筛选及其功能机理的研究[D].无锡:江南大学,2009.
[11]包科尔沁.具有抑菌活性乳酸菌的分离鉴定及其筛选[D].呼和浩特:内蒙古农业大学,2014.
[12] 李红娟.抗真菌乳酸菌的筛选及特性研究[D].北京:中国农业科学院,2011.
[13] 马妙莲.抑霉菌乳酸菌的分离和鉴定及抑菌物质的分析[D].合肥:安徽农业大学,2011.
[14] 陈祥奎.保证食品安全的抗菌剂[J].中国食品添加剂,1995(03):16-26.
(责编:张宏民)
基金项目:山西省高等学校科技创新项目(2019L0980);山西省高等学校教学改革创新项目(J2016114);吕梁学院大学生创新项目。
作者简介:李利红(1984-),女,山西临县人,研究方向:微生物生理。 *通讯作者
收稿日期:2020-06-30
