根袋法获取木薯根际土壤及其细菌群落特征研究
2020-10-29韦云东罗燕春郑华李军盘欢雷开文徐钏
韦云东 罗燕春 郑华 李军 盘欢 雷开文 徐钏
摘 要:為了获取木薯根际土壤并研究其细菌群落特征,加深对木薯根际微生态的认知,开展根袋试验,以粘土和砂质壤土根袋内不同土壤质量(100~500 g)为处理。结果表明,根袋内土质量影响株高,但不影响茎叶重。根袋内100 g土的速效养分受到根系强烈影响,其中铵态氮和速效钾显著高于根袋外。Illumina Hiseq高通量测序结果表明,细菌优势菌门包括变形菌门(31.272%)、放线菌门(25.753%)、酸杆菌门(12.761%)、绿弯菌门(8.799%)等。2种土壤根袋内细菌α多样性增加,粘土细菌丰度也增加。RDA分析表明,土壤速效磷与放线菌门和绿弯菌门正相关,与变形菌门负相关;速效氮、速效钾、铵态氮、硝态氮与芽单胞菌门、酸杆菌门、Parcubacteria等负相关,与厚壁菌门、蓝藻门、梭杆菌门、拟杆菌门正相关;从根袋内外土壤速效养分和土壤细菌多样性综合判定,根袋内100 g土壤时可视为根际土壤,且铵态氮和速效钾可作为判断是否根际土壤的指示指标。根际微生物多样性显著提高。鞘脂杆菌目是木薯品种SC205在不同土质下共同富集的根际细菌。发现了土壤速效养分与部分细菌门的相关性。
关键词:木薯根际;铵态氮;速效钾;微生物群落;鞘脂杆菌目
中图分类号:S141.2;S143;S533 文献标识码:A
Abstract: In order to collect cassava rhizosphere soil and study its bacteria community, and further deepen the knowledge of the micro-ecology of the rhizosphere soil, a field trial with the “root bag” method was carried out with two soil textures (clay and sandy roam) and a series of soil quantity from 100g to 500g in the root bag. Cassava plant height was significantly influenced by the soil quantity in the root bag, while cassava shoot weight was not. Soil available nutrients were strongly affected by roots when soil quantity in the root bag was only 100g, ammonium content (NH4-N) and available potassium (AK) was enriched significantly compared to bulk soil. Results from high throughout sequencing by Illumina Hiseq showed that the dominant bacterial community was Proteobacteria (31.272%), Actinobacteria (25.753%), Acidobacteria (12.761%), Chloroflexi (8.799%) et al. Results from α diversity indexes showed that the diversity of bacteria was increased in the rhizospheric soil, and the species richness was also increased in the clay. Compared to bulk soil, the soil samples collected from the inside “root bag” was relatively rich in Sphingobacteriales, Rhizobiales, Xanthomonadales, Verrucomicrobia and related phylum, class, genus and species for the clay, and for the sandy roam, rich in Sphingobacteriales and genus and species in gemmatimonadaceae. Results from Redundancy analysis (RDA) triplots demonstrated that soil available phosphorus (AP) was positively correlated to Actinobacteria and Chloroflexi, and negatively correlated to Proteobacteria; Soil available nitrogen (AN), AK, NH4-N, nitrates nitrogen (NO3-N) were negatively correlated with Gemmatimonadetes, Acidobacteria, Parcubacteria, Elusimicrobia, Armatimonadetes, TM6_Dependentiae, Chlorobi et al., and positively correlated with Firmicutes, Cyanobacteria, Fusobacteria, Bacteroidetes. In concusion, the 100g soil in the root bag could be seen as cassava rhizospheric soil according to soil nutrients and bacteria diversity. And NH4-N and AK could be regarded as the indicators as cassava rhizospheric soil. Soil microbial diversity was improved in the rhizosphere, and Sphingobacteriales was the enriched bacteria in both soil textures. Soil nutrients were correlated with some classification of soil bacterial.
Keywords: cassava rhizosphere; ammonium nitrogen; available phosphorus; microbial community; Sphingobacteri-ales
DOI: 10.3969/j.issn.1000-2561.2020.09.029
根际是植物根系与土壤紧密接触且相互影响的微生态环境,是植物和土壤进行物质、能量交换的场所,具有丰富的根际微生物种群。根际土壤微生物群落是土壤生态系统持续发挥作用的重要媒介,是反应土壤健康状态的重要指标[1]。根际土壤微生物群落的组成和变化对调节土壤肥力有重要影响。影响根际微生物群落的2个重要因素是植物种类[2-3]和土壤类型[4]。根际微生物主要来源于土壤[5],而植物对根际微生物有一定的筛选作用[6-7]。根系分泌物可以增加根际微生物的活性,吸引特异的微生物种群[8]。此外,还受植物年龄[9]、生长期[10-11]、种植模式[12-15]、施肥[16-17]以及根际内其他生物体等多种因素的影响[18-19]。
木薯是世界三大薯类作物之一,有着“地下粮仓”“淀粉之王”的美誉,也是我国南方红壤区重要经济作物,是食品、饲料、医药、化工、食用酒精、生物燃料等行业的重要原料。对木薯根际土壤微生物的研究是深入了解其根际过程包括根系分泌物、养分吸收与微生物交互作用的基礎,进而为木薯生长调节提供理论基础。目前,对木薯根际微生物的研究十分有限。唐秀梅等[20]发现木薯/花生间作可增加根际土壤细菌、真菌、放线菌及总微生物数量和微生物多样性;徐海强等[21]用“抖落法”[22-23]采集了木薯单作或与花生间作的木薯和花生根际土样进行分析,发现木薯块根形成期细菌、真菌数量达到最大值,间作有利于根际土壤向细菌型转化,且可改变根际土壤细菌和真菌的群落结构。
木薯养分最大吸收期在植后约90~120 d,此时地下部块根属于快速膨大期,且木薯根毛少,采用传统“抖落法”采集根际土壤十分困难。“根袋法”[24-25]是研究根际土壤较常用的方法,可能是获取木薯根际土壤的较好的方法。由于植物根系影响根际土壤的范围很小,一方面需要确保根袋内的土壤明确受到了根际影响,另一方面则需要获取尽可能多的土壤重量,以便测试与分析。因此,根袋内土壤重量是一个重要的参数。本研究采用“根袋法”,设置2种不同质地土壤,及根袋内不同土壤重量,并测定土壤速效养分和细菌多样性,以探讨根袋法采集木薯根际土壤的最佳参数和根际细菌群落特征,以及根际细菌与速效养分的关系,从而为深入认知木薯根际微生态提供基础。
1 材料与方法
1.1 材料
试验于2018年在广西壮族自治区亚热带作物研究所木薯试验基地(225404.59N, 1082003.41E)开展,试验地土壤为红壤。袋内所试土壤(大袋和小袋)分别为粘土(取自南宁市武鸣区)和砂质壤土(取自合浦县)。其中粘土的粘粒(<0.002 mm)、砂粒(2~0.05 mm)、粉(砂)粒(0.05~0.002 mm)含量分别为58.49%,33.00%,8.51%;砂质壤土则分别为15.25%,78.64%,6.10%。土壤的基本理化性质:粘土pH、全氮、全磷、全钾、速效氮、速效磷、缓效钾分别为5.7、1.410 g/kg,2.65 g/kg,4.39 g/kg,122.0 mg/kg,154 mg/kg,65.7 mg/kg;砂质壤土对应指标分别为6.0、0.699 g/kg,0.84 g/kg,2.13 g/kg,56.4 mg/kg,135 mg/kg,90.4 mg/kg。参试土风干过2 mm筛。供试木薯品种为‘华南205(SC205)。根袋材质为300目尼龙网,分为大袋和小袋。大袋为50 cm×30 cm×15 cm的长方体,上部中间有长13 cm,高7 cm的一条开口,方便放入小袋。小袋为长30 cm,直径5 cm,正中间有高10 cm,直径5 cm的T型凸起,凸起上下均开口,用于种植木薯种茎。
1.2 方法
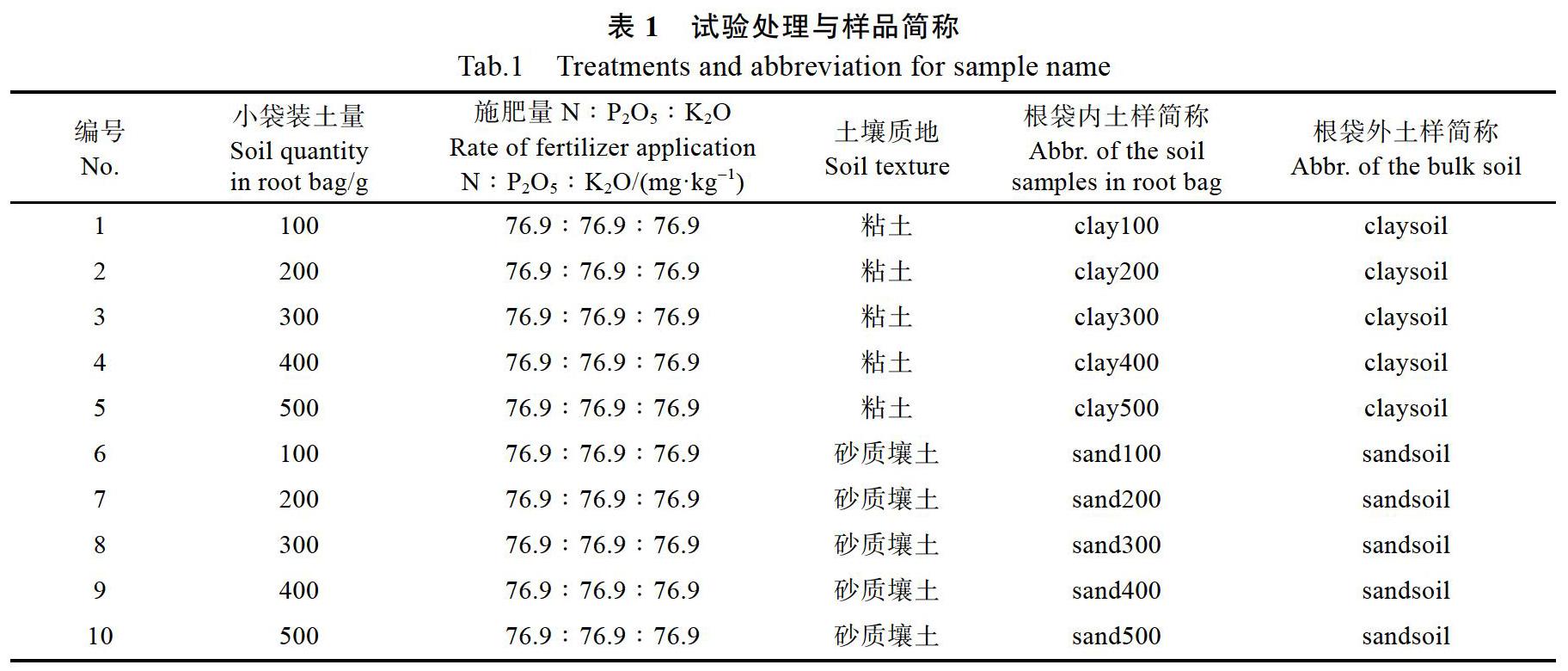
1.2.1 试验设计 试验共10个处理,包括2种土壤质地、不同肥料处理、根袋内不同土壤重量等(表1),每个处理4个重复。种植时先将大袋装满参试混过肥料的土壤(粘土22.5 kg,砂质壤土25.0 kg)并埋入田间地下10 cm,再把小袋置于大袋内,小袋按处理内置不同重量和质地参试土壤,木薯种茎由小袋开口处垂直插入种植。各大袋埋于田间位置按株行距为80 cm×90 cm随机区组排列。2018年4月10日种植木薯,试验地采取滴灌,所用滴头流速为4 L/h。
2018年8月8—9日(植后120~121 d)按处理号顺序采样。采样时测量木薯株高、茎叶重。取样时分别取大袋内的土壤和根袋(小袋)内的土壤,其中相同土质的根袋外土壤视为根袋外重复。每个样品通过四分法分为3份:一份质量约10 g,取样后迅速用锡纸包裹放入液氮中速冻,之后保存在40 ℃冰箱;第2份取样后迅速放入4 ℃冷藏箱,之后保存于4 ℃冰箱中;第3份取样后风干过20目筛。土壤样品测试铵态氮、硝态氮、速效氮、速效磷、速效钾。选取处理1、3、5、10、11、13的根袋内外样品进行细菌(16S)和AMF真菌多样性高通量测序。
1.2.2 采样与测试方法 土壤速效氮(碱解氮)按照碱解扩散法,速效磷碳酸氢钠浸提钼锑抗比色法,速效钾采用NH4OAc浸提火焰光度计法测定,土壤铵态氮和硝态氮采用氯化钾浸提 AA3-A001-02E型流动注射分析仪方法测定[26]。将保存在40 ℃的样品在液氮下使用玛瑙研钵磨碎,使用干冰运输(约40 ℃)送检,进行细菌(16S)高通量测序,其包括DNA提取和PCR扩增、测序、数据处理等过程,与Li等[27]相同,都是由Illumina Hiseq 2500平台进行测序。
LEfSe(LDA EffectSize)首先使用non-pa-rametric factorial Kruskal-Wallis (KW) sum-rank test(非参数因子克鲁斯卡尔—沃利斯和秩验检)检测具有显著丰度差异特征,并找到与丰度有显著性差异的类群。然后,LEfSe采用线性判别分析(LDA)来估算每个组分(物种)丰度对差异效果影响的大小。LDA值分布柱状图中展示了LDA Score大于设定值(默认设置为4)的物种,即组间具有统计学差异的Biomarker。展示了不同组中丰度差异显著的物种,柱状图的长度代表差异物种的影响大小(即为LDA Score)。考虑到分析需要和部分处理进入分析会导致整体差异不显著,仅选择部分处理进行该分析,包括:两种土壤比较(claysoil和sandsoil)、粘土各处理根袋内外土壤(claysoil,clay100,clay300)、砂质壤土根袋内外土壤(sandsoil,sand100)。
1.3 数据处理
土壤速效养分数据采用Microsoft office 2010软件进行统计分析,方差分析采用RStudio Version 1.1.463(基于R Version 3.5.2)软件中的ANOVA进行,多重比较采用SSR法;非参数秩和检验用boxplerk.R函数完成,采用Bonferroni Holm方法校正P值。细菌α多樣性采用Qiime程序计算(在百迈克云平台完成)。细菌门水平Heatmap图和聚类分析采用(Pheatmap包进行作图)LEfSe(LDA EffectSize)按照Segata等[28]中的方法计算,LDA值分布柱状图中展示了LDA Score大于4的物种,即组间具有统计学差异的Biomarker,该分析和作图均在百迈克云平台中进行(www.biocloud.net)。
2 结果与分析
2.1 木薯生长状况
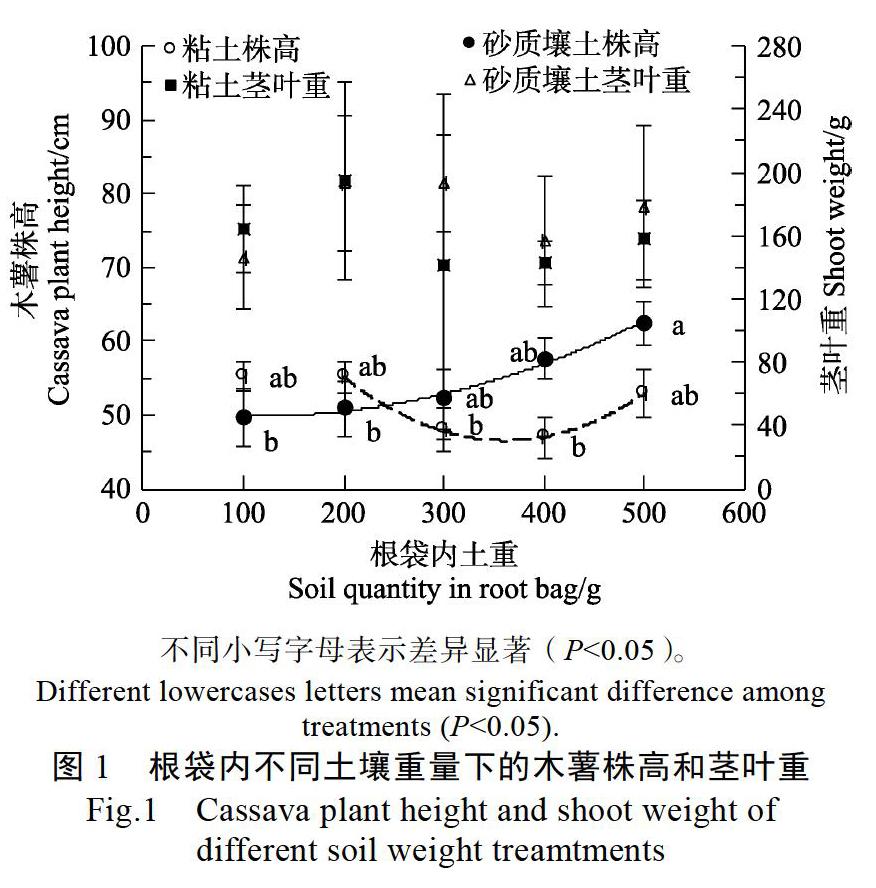
随着根袋内砂质壤土重量减少,木薯株高有逐渐降低的趋势,并可用一元二次方程极显著拟合(图1)。并且根袋内有500 g土时(处理10)比根袋内仅有100 g(处理6)和200 g土(处理7)显著增加。说明根袋内砂质壤土的重量对木薯株高影响极显著。粘土木薯株高在各处理之间无显著差异,但随着根袋内土壤重量减少呈现先降低后升高的趋势,且根袋内500~200 g时还可以用抛物线显著拟合。
2.2 土壤速效养分
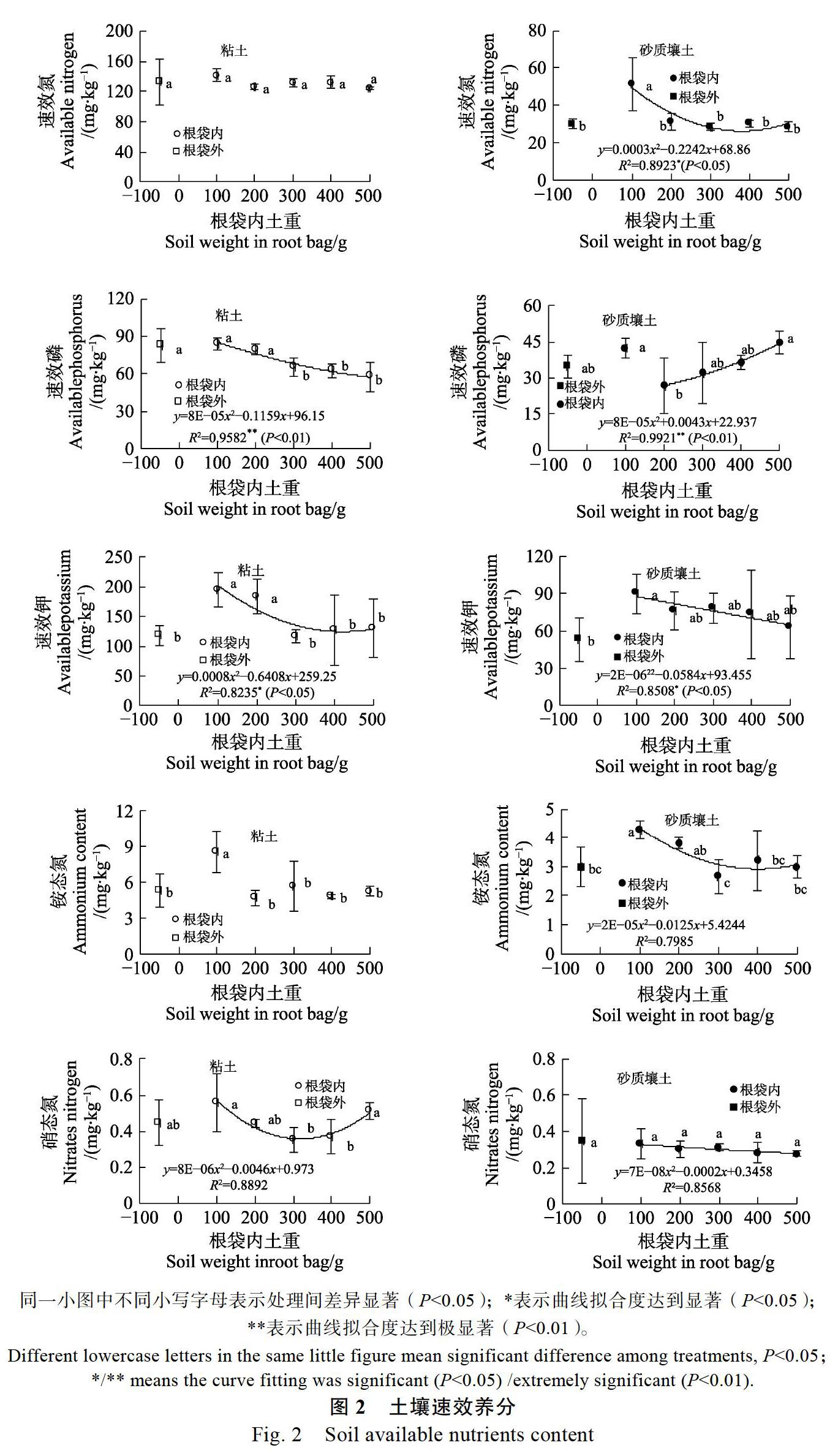
砂质壤土速效氮、速效磷、速效钾、铵态氮、硝态氮显著低于粘土(P<0.05,图表略,参考图2)。从2种土壤的硝态氮和铵态氮的绝对值大小(图2)可以看出,在本试验条件下,铵态氮显著高于硝态氮。硝态氮与铵态氮在土壤中受到肥料释放、硝化作用和反硝化作用、作物吸收等过程的影响。本试验肥料中铵态氮释放后,在土壤水分含量较高的条件下土壤中反硝化作用可能比较明显,导致铵态氮含量高于硝态氮。
根袋内速效养分各指标随着根袋内土壤重量从500 g减少到100 g,有不同的趋势,可以分为3类:第1类为无明显趋势,包括粘土速效氮、砂质壤土硝态氮;第2类为逐渐上升或者忽然上升,包括粘土速效磷、速效钾、铵态氮,砂质壤土速效氮、速效钾、铵态氮;第3类为先降低后上升,如砂质壤土速效磷、铵态氮、粘土硝态氮。根袋内土壤一方面受到根系的吸收作用,速效养分会减少;另一方面其与根系直接接触,根系分泌物和微生物相互作用,会对土壤速效养分产生一定的“活化”作用,导致速效养分增加。第1类可能保持二者的平衡;第2类可能表现为随着根袋内土壤减少,根系的“活化”作用逐渐得以体现;第3类则更体现出了两种作用的动态变化:根袋内土壤较多时,根系吸收作用是主要作用,根袋内土壤较少时,“活化”效果明显。根袋内外有显著差异的速效养分包括砂质壤土速效氮,粘土和砂质壤土速效钾、铵态氮,均表现为根袋内显著高于根袋外。土壤速效养分与木薯株高和茎叶重均无显著相关性。
2.3 土壤细菌群落结构
细菌测序中,32个样品测序共获得1 797 928对Reads,双端Reads拼接、过滤后共产生1 465 507条Clean tags,每个样品至少产生26 416条Clean tags,平均产生45 797条Clean tags。
可准确注释细菌门有27个门(图3),其中平均相对丰度超过1%的有10个,平均值最大的是变形菌门(Proteobacteria,34.86%7.25%),其次为放线菌门(Actinobacteria,20.29%±7.51%),酸杆菌门(Acidobacteria,12.54%±3.46%),绿弯菌门(Chloroflexi,6.50%±2.50%),拟杆菌门(Bacteroidetes,6.27%±3.86%),厚壁菌门(Firmicutes,5.86%±3.23%),芽单胞菌门(Gemmatimonadetes,4.42%±3.89%),蓝细菌(Cyanobacteria,2.88%±5.35%),疣微菌门(Verrucomicrobia,2.46%±0.85%),螺旋体菌门(Saccharibacteria,1.20%±0.64%)。clay100和sand100合计的优势细菌菌门为变形菌门(37.016%,从图3计算,此段下同)、放线菌门(18.215%)、酸杆菌门(12.847%)、拟杆菌门(7.583%)、绿弯菌门(6.482%)、厚壁菌门、芽单胞菌门等;claysoil和sandsoil合计的细菌优势菌门为变形菌门(31.272%)、放线菌门(25.753%)、酸杆菌门(12.761%)、绿弯菌门(8.799%)、厚壁菌门,芽单胞菌门、拟杆菌门(2.691%)等。拟杆菌门的相对丰度和排序有较大差异,非参数秩和检验(图表略)的结果为clay100(大小排序1)大于claysoil,且clay300(大小排序2)大于sandsoil(最小),数据综合起来表现出上述差异。
聚类分析表明,claysoil可以单独分为一个一级分类(图3),与其他所有土样均有差异。而clay500有2个样在二级分类单独存在。砂质壤土大部分的样品被分类到了三级分类之一,且所有样均未与粘土混合分类,表明2种土壤细菌分布存在明显差异。
由表2可以看出,粘土(claysoil)和砂质壤土(sandsoil)根袋外的细菌α多样性各指标均无显著差异。粘土的细菌种水平的α多样性各指标均表现出了显著差异。Shannon指数大小顺序为clay100>clay300≈clay500>claysoil,同时考虑了物种丰富度以及均匀度。一般来说,Shannon指数值越大,物种多样性越高。Simpson指数顺序为claysoil>clay300≈clay500>clay100,该指数同样考虑了物种丰富度以及均匀度,但与Shannon指数相比,它更受均匀度的影响,该指数越大,表示均匀度越高,反之,表示多样性越高。ACE指数则表现为clay100最高,claysoil最低;Chao1指数为clay100最高,clay500次之,二者都显著高于claysoil。ACE和Chao1指标均是度量物种丰富度的指标,值越大,丰富度越高。从α多样性指标可以看出,粘土根袋内细菌多样性和丰度均高于根袋外,且clay100达到了最高值。可见粘土根袋内土壤受到根际影响,细菌生物多样性和丰度均显著增加,以根袋内土重100 g时最高。
砂质壤土细菌的Shannon指数为sand100最大,显著大于sand200和sandsoil(砂质壤土根袋外),Simpson指数为sand100最小,显著小于sand400,sand200和sandsoil。但各处理间的ACE和Chao1指数没有显著差异。说明sand100细菌多样性增加,但丰度并无影响。
2.4 土壤细菌LEfSe分析
砂质壤土4个处理之间的LEfSe分析没有找到能显著区别细菌各处理的Biomarker,但是砂质壤土(sandsoil)与sand100之间找到了2个,其中酸杆菌门-鞘脂杆菌纲(Sphingobacteriia)-鞘脂杆菌目(Sphingobacteriales)均表现为sand100显著高于sandsoil,该类细菌可能适宜根袋内的环境,或者适宜根系分泌物,或者根袋内特殊的氮、钾富集情况。而sandsoil的芽单胞菌门,uncultured_bacterium_f_Gemmatimonadaceae属,uncultured_bacterium_f_Gemmatimonadaceae種要显著高于sand100(图5),可能该属和种不适宜根袋内有机物较丰富的环境。粘土各处理细菌的LEfSe分析结果表明,clay500与其他各处理间均无显著差异(图表略)。claysoil,clay300, Clay100 3个处理中有4个细菌门,3个纲,6个目,7个科,5个属,2个种的LDA值大于4,也就是有显著差异(图4),可以作为区分各处理的Biom?arker。其中根袋外相对富集的细菌有酸热菌科(Acidot?h?e?rmaceae,放线菌纲)-热酸菌属(Acido?th?ermus)-未准确注释种、弗兰克氏菌目(Fran?kiales,放线菌纲)-弗兰克氏菌科(Frankiaceae)- Ja?trophihabitans属-未注释种、链霉菌目(Strep?tomycetales,放线菌纲)-链霉菌科(Strept?omyce?taceae)-链霉菌属(Streptomyces)、Solirubrobact?erales目(Thermoleophilia纲)-YNPFFP1科。根袋内相对富集的细菌有:鞘脂杆菌目-噬几丁质菌科(Chitinophagaceae)-Chitinop?haga属、芽胞杆菌目(Bacillales,厚壁菌门杆菌纲);根瘤菌目(Rhizobiales,变形菌门α变形菌纲)、黄色单胞菌科(Xanthomonadaceae,β变形菌纲)、疣微菌门[相对丰度范围为(1.85%±0.38%)~(3.37%± 1.06%)]。两种土壤根际共同富集的细菌为鞘脂杆菌目。
2.5 土壤微生物与速效养分的冗余分析(RDA)
细菌门水平相对丰度与土壤速效养分之间的RDA分析结果表明,土壤速效养各指标对土壤细菌的总方差的解释率为47.44%(校正R2为37.33%),其中第一典范轴(RDA1)和第二典范轴(RDA2)的解释率分别为35.22%和7.87%(图6)。对各典范轴进行置换检验,其整体F/sig为4.6939/0.001,达到极显著水平。具体到单个的典范轴,只有第一轴(RDA1)达到了显著水平(F/sig为17.43/0.001)。第二轴的F/sig为3.894/0.074,未达到显著水平。对每个环境因子进行检验,发现AN,AP,AK 3个指标的F/sig分别为16.520/0.001,2.546/0.043,2.243/0.050,均达到了显著及以上水平。
RDA三序图可以看出(图6),部分细菌门之间有正相关性,如芽单胞菌门,酸杆菌门,Parcubacteria,迷踪菌门,装甲菌门,TM6_De-pendentiae,绿菌门的向量均在第一象限,他们之间均具有正相关性,而他们与第三象限的厚壁菌门,蓝藻门,梭杆菌门,拟杆菌门之间负相关;第四象限的向量仅有变形菌门,该细菌门还与拟杆菌门,梭杆菌门,芽单胞菌门有正相关,与第二象限的向量放线菌门和绿弯菌门有负相关。
土壤速效磷向量位于第二象限,与同处于第二象限的放线菌门和绿弯菌门正相关,与第四象限的变形菌门负相关。速效养分的向量除了速效磷外,其他的均在第三象限,与第一象限的所有细菌向量有较强的负相关,与同处第三象限的拟杆菌门、厚壁菌门、梭杆菌门正相关。
2种土壤的点分布表现出了明显的差异,粘土分布在第二、三象限,其中claysoil全部分布在第二象限,其他3个粘土处理分布各有1个分布在第二象限,各有3个分布在第三象限,可见粘土根袋内外土壤细菌有一定的差异。砂质壤土分布在第一、四象限,其中sand100全部分布第四象限,sand200和sandsoil分别在第一、第四象限各2个点,sand400则在第一、四象限各1、3个点。
3 讨论
本研究中,根际(根袋土重100 g时)与非根际仅粘土速效钾,砂质壤土速效氮,砂质壤土速效钾表现出了显著差异,且均为根际富集作用。根际土壤速效养分是否富集与与植物种类密切相关。如根际土壤速效氮、有效磷、有效鉀在不同沙漠植物中有的富集,有的亏缺[29-33];而荒漠盐土5种盐生植物根际土的速效氮亏缺,而有效磷则富集[34]。樟子松根际土壤速效氮、速效钾在根际富集,速效磷则为亏缺[35]。玉米生长30 d时,根表1~2 mm处出现了钾富集,但在60 d时,根表K出现亏缺区且扩大[36]。另外,土壤速效钾或者缓效钾还受到土壤含水量、土壤类型[37]、质地[38]等因素的影响。本研究中,铵态氮和速效钾在根际土壤中富集,经相关分析,二者的相关系数高达0.739,达到极显著水平。但该根袋法并不能取得根表近距离的样品,因此木薯根际的养分富集还需要进一步研究。
粘土根袋内土壤受到根际影响,细菌α多样性和丰度均显著增加,以根袋内土重100 g时最高。砂质壤土根袋内100 g时根袋内细菌α多样性增加,但丰度并无影响。根际由于根系分泌物为微生物提供碳源,微生物生长更活跃,根际微生物表现出了更高的多样性。
其中Gem为Gemmatimonadetes(芽单胞菌门),Aci为Acidobacteria(酸杆菌门),Pro为Proteobacteria(变形菌门),Bac为Bacteroidetes(拟杆菌门),Cya为Cyanobacteria(蓝藻门),Fir为Firmicutes (厚壁菌门),Par为Parcubacteria,CHF为Chloroflexi(绿弯菌门),Fus为Fusob?acteria(梭杆菌门),Elu为Elusimicrobia(迷踪菌门),TM6为TM6_Dependentiae,Arm为Armati?monadetes(装甲菌门),CHB为Chlorobi(绿菌门),Act为Actinobacteria(放线菌门)。
综合来看,根袋内100 g土壤的土壤速效养分和细菌多样性均受到了根系影响,可视为根际土壤,2种土壤质地下,铵态氮和速效钾都明显根际富集,可以作为判断木薯根际土壤的指示指标。
可准确注释细菌门有27个门,整体上优势群落包括变形菌门,放线菌门,酸杆菌门,绿弯菌门,拟杆菌门,厚壁菌门,芽单胞菌门,蓝细菌,疣微菌门,螺旋体菌门等。根际优势菌门包括变形菌门,放线菌门,酸杆菌门,拟杆菌门,绿弯菌门,厚壁菌门,芽单胞菌门等。不同物种的根际优势菌群略有差异,如棉花根际细菌的优势菌门包括变形菌门、酸杆菌门、厚壁菌门、蓝细菌门、放线菌门、浮霉菌门、拟杆菌门和疣微菌门等[39]。人参根际土壤中相对富集芽孢杆菌、酸杆菌,非根际土壤独有且相对富集变形菌[40]。福州菌草根际土壤的优势细菌门为酸杆菌门、变形菌门、放线菌门、厚壁菌门、绿弯菌门、芽单胞菌门、硝化螺旋门、疣微菌门、浮霉菌门等[41]。
LEfSe分析表明,粘土根袋内相对富集的细菌鞘脂杆菌目、根瘤菌目、黄色单胞菌目、疣微菌门及其相关的门、纲、属、种等,砂质壤土根袋内富集的有鞘脂杆菌目和芽单胞菌科下的属和种,可以作为区别根际与非根际土的Biomarker。鞘脂杆菌目是木薯品种SC205在不同土质下共同富集的根际细菌。本研究中,鞘脂杆菌目有3个科:噬几丁质菌科(Chitinophagaceae),鞘脂杆菌科(Sphingobacteriaceae)和env.OPS_17科,本研究中这3个科分别具有10、3、0个可准确注释的属。其中鞘脂杆菌科下的3个属分别为Mucilaginibacter、Pedobacter、鞘氨醇杆菌属(Sphingobacterium)。鞘氨醇杆菌有着特殊的代谢调控机制来适应营养物质贫乏的环境,通过调整自身的生长来抵抗许多不利的环境变化;鞘氨醇杆菌能够利用的底物宽泛,从石油、氯乙烷等高聚物到简单无机物都能利用,这都是它们能在贫营养的自养环境中生长和繁殖的原因[42]。鞘氨醇杆菌在根际内活跃很可能与根系分泌物的量有关,而木薯根际分泌物与此类细菌的富集的具体机理还需要更深入的研究。
RDA分析表明,土壤速效磷与放线菌门和绿弯菌门正相关,与变形菌门负相关。速效氮、速效钾、铵态氮、硝态氮与芽单胞菌门、酸杆菌门、Parcubacteria、迷踪菌门、装甲菌门、TM6_De?pendentiae和绿菌门负相关,与厚壁菌门、蓝藻门、梭杆菌门和拟杆菌门之间正相关。这种相关性可能与物种有关,如温室番茄根际土壤的CCA(典范对应分析)结果表明:pH与酸杆菌门、疣微菌门和硝化螺旋菌门正相关,硝态氮、铵态氮和总有机碳与这3个细菌门负相关;土壤速效氮与拟杆菌门、浮霉菌门、厚壁菌门和Crenarchaeota正相关,与变形菌门、芽单胞菌门负相关[31]。高雪峰[43]发现,荒漠草原植物根系细菌群落中的Gp16、Rubrobacter、Bacillus、Iamia、Pseudomonas和Lactobacillus与土壤速效磷和速效氮正相关。变形菌门比例增多和酸杆菌门比例的减少可提高黄瓜根际土壤速效养分含量[44]。以240 kg/hm2种植密度的高粱作绿肥处理后黄瓜根际的厚壁菌门、黄色单胞菌科、红螺菌科和降低根际土壤酸杆菌门比例而促进碱解氮质量比、速效磷质量比[45]。稻田施用硅藻页岩后,水稻根际土壤速效氮、全氮、全磷、全钾与细菌群落组成有极显著相关关系,根际土壤速效磷、速效氮与真菌群落组成有极显著相关关系,土壤理化性质的改变可能间接引起土壤细菌及真菌群落结构的变化[46]。土壤养分含量与微生物之间的相关水平受到多因素复杂的影响,甚至会出现按常规推断无法解释的结果[32],需要更加深入而广泛的研究。本研究初步认知了木薯根际微生物群落结构及其与养分的关系,为进一步研究根系分泌物与根际土壤互作、木薯根际促生菌分离培养等提供了基础。
本研究虽然取得了木薯根际土壤,但是因培养期长,达120 d,植株养分缺乏,植株生长矮小。后续研究应当根据不同采样时间设置不同的根袋形状,如盘状根袋,增大根袋与土壤的接触面积,并进一步改进施肥措施。
参考文献
[1] Philippot L, Raaijmakers J M, Lemanceau P, et al. Going back to the roots: The microbial ecology of the rhizosphere[J]. Nature Reviews Microbiology, 2013, 11(11): 789-799.
[2] 李 侠, 张 丽, 杜世杰, 等. 作物种类对根际土壤可培养微生物数量的影响[J]. 园艺与种苗, 2018, 38(8): 57-60.
[3] Kowalchuk G A, Buma D S, de Boer W, et al. Effects of above-ground plant species composition and diversity on the diversity of soil-bornemicroorganisms[J]. Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology, 2002, 81(1-4): 509-520.
[4] Garbeva P, Van Elsas J D, Van Veen J A. Rhizosphere microbial community and its response to plant species and soil history[J]. Plant and Soil, 2008, 302(1-2): 19-32.
[5] Berg G, Smalla K. Plant species and soil type cooperatively shape the structure and function of microbial communities in the rhizosphere[J]. FEMS Microbiol Ecology, 2009, 68(1): 1-13.
[6] Garbeva P, Van Veen J A, Van Elsas J D. Microbial diversity in soil: Selection of microbial populations by plant and soil type and implications for disease suppressiveness[J]. Annual Review of Phytopathology, 2004, 42: 243-270.
[7] Broeckling C D, Broz A K, Bergelson J, et al. Root exudates regulate soil fungal community composition and diversity[J]. Applied and Evironmental Microbiology, 2008, 74(3): 738-744.
[8] 周文杰, 吕德国, 秦嗣军. 植物与根际微生物相互作用关系研究进展[J]. 吉林农业大学学报, 2016, 38(3): 253-260.
[9] 王学翠, 童晓茹, 温学森, 等. 植物与根际微生物关系的研究进展[J]. 山东科学, 2007(6): 40-44, 50.
[10] 赵柏霞, 潘凤荣, 韩晓日. 基于高通量测序技术的樱桃根际细菌群落研究[J]. 土壤通报, 2018, 49(3): 596-601.
[11] 颜 朗, 张义正, 清 源, 等. 马铃薯全生育期内根际微生物组变化规律[J]. 微生物学报, 2020, 60(2): 246-260.
[12] Zhang F S, Shen J B, Li L, et al. An overview of rhizosphere processes related with plant nutrition in major cropping systems in China[J]. Plant Soil, 2004, 260(1/2): 89-99.
[13] 牛倩云, 韓彦莎, 徐丽霞, 等. 作物轮作对谷田土壤理化性质及谷子根际土壤细菌群落的影响[J]. 农业环境科学学报, 2018, 37(12): 2802-2809.
[14] 聂园军, 李瑞珍, 赵 佳, 等. 西瓜连作对根际微生物群落的影响[J]. 中国瓜菜, 2019, 32(1): 6-11, 3.
[15] 郭凤仙, 刘 越, 唐 丽, 等. 药用植物根际微生物研究现状与展望[J]. 中国农业科技导报, 2017, 19(5): 12-21.
[16] 蔡秋华, 赵正雄, 左进香, 等. 有机肥配施减量化肥对烤烟青枯病及其根际微生物的影响[J]. 烟草科技, 2018, 51(11): 20-27.
[17] 艾 超. 长期施肥下根际碳氮转化与微生物多样性研究[D]. 北京: 中国农业科学院, 2015.
[18] Hartmann A, Schmid M, Wenzel W, et al. Rhizosphere 2004-Perspectives and Challenges-A Tribute to Lorenz Hiltner[M]. Munich, Germany: GSF-National Research Center for Environment and Health, 2005.
[19] Johansson J F, Paul L R, Finlay R D. Microbial interactions in the mycorrhizosphere and their significance for sustainable agriculture[J]. FEMS Microbioloy & Ecology, 2004, 48(1): 1-13.
[20] 唐秀梅, 钟瑞春, 蒋 菁, 等. 木薯/花生间作对根际土壤微生态的影响[J]. 基因组学与应用生物学, 2015, 34(1): 117-124.
[21] 徐海强, 黄 洁, 刘子凡, 等. 木薯/花生间作对其根际土壤微生物数量、群落结构及多样性的影响[J]. 南方农业学报. 2016, 47(2): 185-190.
[22] Riley D, Barber S A. Bicarbonate accumulation and pH changes at the soybean (Glycine max (L.) Merr.) root-soil interface[J]. Soil Science Society of America Journal, 1969, 33(6): 905-908.
[23] Riley D, Barber S A. Salt accumulation at the soybean [Glycine max (L.) Merr.] root-soil interface[J]. Soil Science Society of America Journal, 1970, 34(1): 154-155.
[24] Steen E. Usefulness of the mesh bag method in quantitative root studies[M]//Atkinson D. Plant Root Growth in an Ecological Perspective. Oxford: Blackwell, 1991: 75-86.
[25] 蔡昆争, 骆世明, 段舜山. 水稻根系在根袋处理条件下对氮养分的反应[J]. 生态学报, 2003, 23(6): 1109-1116.
[26] 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2005.
[27] Li P F, Zhang X C, Hao M D, et al. Effects of vegetation restoration on soil bacterial communities, enzyme activities, and nutrients of reconstructed soil in a mining area on the loess plateau, China[J]. Sustainability, 2019, 11(8): 1-16.
[28] Segata N, Izard J, Waldron L, et al. Metagenomic biomarker discovery and explanation[J]. Genome Biology, 2011, 12(6): R60.
[29] 曾曙才, 苏志尧, 陈北光, 等. 植物根际营养研究进展[J]. 南京林业大学学报(自然科学版), 2003, 27(6): 79-83.
[30] 郭朝晖, 张杨珠, 黄子蔚. 根际微域营养研究进展(二)[J]. 土壤通报, 1999(2): 38-41.
[31] Shang S, Yi Y. A Greenhouse assay on the effect of applied urea amount on the rhizospheric soil bacterial communities[J]. Indian Journal of Microbiology, 2015, 55(4): 406-414.
[32] 张士亮, 李 鹏. 施肥对土壤微生物多样性的影响[J]. 中国林副特产, 2011(1): 95-98.
[33] 李从娟, 李 彦, 马 健, 等. 干旱区植物根际土壤养分状况的对比研究[J]. 干旱区地理, 2011, 34(2): 222-228.
[34] 弋良朋, 马 健, 李 彦. 荒漠盐生植物根际土壤酶活性的变化[J]. 中国生态农业学报, 2009, 17(3): 500-505.
[35] 张学利, 杨树军, 张百习, 等. 不同林龄樟子松根际与非根际土壤的对比[J]. 福建林学院学报, 2005, 25(1): 80-84.
[36] 李贵宝, 李晓林, 曹一平, 等. 玉米田间根际微区钾养分狀况的研究[J]. 土壤通报, 1999, 30(2): 3-5.
[37] 许曼丽, 刘芷宇. 土壤-根系微区养分状况的研究Ⅱ. 钾离子的富集与亏缺[J]. 土壤学报, 1983, 20(3): 295-302.
[38] 曹一平, 徐永泰, 李晓林. 小麦根际微区钾养分状况的研究[J]. 北京农业大学学报, 1991(2): 69-74.
[39] 刘珊珊, 韦 鑫, 盛福瑞, 等. 棉花不同发育时期根际微生物的动态变化[J]. 浙江农业学报, 2019, 31(8): 1361- 1371.
[40] Ying Y X, Ding W L, Li Y. Characterization of soil bacterial communities in rhizospheric and nonrhizospheric soil of Panax ginseng[J]. Biochemical Genetics, 2012, 50(11-12): 848-859.
[41] 叶文雨, 廖海萍, 许钰滢, 等. 基于高通量测序技术分析2种菌草根际土壤细菌群落多样性[J]. 热带作物学报, 2019, 40(9): 1783-1788.
[42] 蔡训辉, 王如意, 胡胜男, 等. 鞘氨醇杆菌的研究进展[J]. 基因组学与应用生物学, 2020, 39(5): 2096-2102.
[43] 高雪峰. 短花针茅荒漠草原优势植物根系分泌物及其主要组分对土壤微生物的影响[D]. 呼和浩特: 内蒙古农业大学, 2017.
[44] 李 明, 胡 云, 黄修梅, 等. 生物炭对设施黄瓜根际土壤养分和菌群的影响[J]. 农业机械学报, 2016, 47(11): 172-178.
[45] 刘金泉, 李 明, 胡 云, 等. 高粱绿肥种植密度对设施黄瓜根系生长相关因子的影响[J]. 农业机械学报, 2018, 49(5): 323-329.
[46] 于 涵. 硅藻页岩对水稻根际土壤及微生物群落的影响[D]. 哈尔滨: 哈尔滨师范大学, 2019.
