国内橡胶树尖孢炭疽复合种种间分子系统发育及生物学特性分析
2020-10-29江涛刘先宝李博勋郑肖兰蔡吉苗冯艳丽黄贵修
江涛 刘先宝 李博勋 郑肖兰 蔡吉苗 冯艳丽 黄贵修
摘 要:为明确国内橡胶树尖孢炭疽复合种内不同种的生物学特性及种间差异情况,评价了4个代表性菌株(Colletotrichum bannanense YNML52,C. laticiphilum YNJH17109,C. australisinense GX1655,YNJP162)对不同碳源、氮源的利用情况,以及在不同温度、pH、水活度下的生长情况,并评价了这些菌株对橡胶不同品种和不同作物的致病性。结果表明:供试菌株在碳源、氮源利用,适宜生长温度、致死温度、pH和水分活度等方面均存在显著差异;致病性分析表明,供试菌株的致病谱也存在显著差异,YNML52的寄主范围较窄,具有很强的寄主专化性。通过评价生态因子对橡胶树炭疽病病原菌生物学特性的影响,为深入了解橡胶病害发生规律和制定有效防控措施提供指导依据。
关键词:橡胶树;尖孢炭疽复合种;生物学特性;致病性
中图分类号:S763.7;S794.1 文献标识码:A
Abstract: In order to clarify the biological characteristics and interspecific differences of Colletotrichum acutatum complex species from rubber trees in China, four representative strains (C. bannanense YNML52, C. laticiphilum YNJH17109, C. australisinense GX1655, YNJP162) were evaluated for the utilization of different carbon, nitrogen sources and colony growth at different temperature, pH and water activities. The pathogenicity of the strains to different rubber varieties and crops was also evaluated. There were significant differences in the utilization of carbon and nitrogen sources, suitable growth temperature, lethal temperature, pH value and water activity of the tested strains. There were significant differences in pathogenicity spectrum of the tested strains. YNML52 had a narrow host range and strong host specificity. Evaluating the effects of ecological factors on the biological characteristics of the pathogen of rubber tree anthracnose is of certain guiding significance for understanding the occurrence regularity of the disease and formulating effective control strategies.
Keywords: rubber trees; Colletotrichum acutatum complex species; biological characteristics; pathogenicity
DOI: 10.3969/j.issn.1000-2561.2020.09.019
巴西橡胶树[Hevea brasiliensis (Willd. ex A. Juss) Muell. Arg]属大戟目大戟科橡胶树属的多年生高大落叶乔木,因相较于其他产胶植物具有不可媲美的优越特性,得以在中国和世界其他适宜地区广泛种植[1]。一直以来,病害是制约我国天然橡胶生产的重要因子,由刺盘孢属(Colleto??tri?chum spp.)侵染引起的橡胶树炭疽病正是其中最为严重的叶部病害之一[2]。国内该病最早于1962年在海南大丰农场开割林段爆发流行,引起橡胶树严重落叶、枝条枯死,开割时间推迟导致干胶产量严重损失[3]。
该病病原早期一直被鉴定为胶孢炭疽(C. gloeosporioides)。1992年,在印度尼西亚和斯里兰卡首次报道了由尖孢炭疽(C. acutatum)引起的炭疽病,在印度和斯里兰卡等国家认为尖孢炭疽是优势致病种群;我国直到2008年才在西双版纳垦区首次发现尖孢炭疽为害[4-5]。最新的分类学研究将刺盘孢属划分为13个复合种,与橡胶树相关的有胶孢炭疽、尖孢炭疽和博宁炭疽3个复合种[6-7]。已有研究表明国内橡胶树炭疽病原主要属于胶孢炭疽和尖孢炭疽两大复合种,其中胶孢炭疽复合种包括暹罗炭疽(C. siamense)、果生刺盘孢(C. fructicola)和乐东炭疽(C. ledongense)3個种,尖孢炭疽复合种包括版纳炭疽(C. ban-nanense)、华南炭疽(C. australisinense)和C. laticiphilum 3个种[7-10]。据报道,复合种内在种群比例、分布范围、为害症状和为害程度等方面存在明显差异,导致这一现象的原因可能与各种间不同的生物学特性有关[4, 7, 11]。然而,先前文献报道的关于橡胶树炭疽菌生物学特性的研究还是以传统方法鉴定的胶孢炭疽和尖孢炭疽为研究对象,且多见于胶孢炭疽。在当前的分类水平下,其相关结果显得滞后且不够准确。
本研究旨在进一步明确国内橡胶树尖孢炭疽复合种内各种间的生物学特性,以期为橡胶树炭疽病病原检测和制定有效防治策略提供参考。
1 材料与方法
1.1 材料
1.1.1 供试菌株与植物品种 供试菌株:橡胶树尖孢炭疽菌株为本研究室已鉴定、发表的YNML52、GX1655、YNJP162、YNJH17109,于2017年在云南新收集的菌株。供试植物(品种):番木瓜(‘蜜红)、芒果(‘金煌芒)、番石榴(‘新世纪)和辣椒(‘辣椒309)。
1.1.2 供试培养基、试剂和仪器 供试培养基:PDA培养基参照《植病研究方法》配制[12],Czapek培养基参照《植物病理学实验技术》配制[13]。试剂:CTAB、10?Biffer、dNTPs、Taq酶、引物对、DNA Marker等。仪器:PCR仪、电泳仪、凝胶成像系统、真菌培养箱、超净工作台等。
1.2 方法
1.2.1 橡胶尖孢炭疽复合种种间分子系统发育分析 DNA提取、PCR扩增和测序:参照Liu等[7]的方法获得供试菌株基因组DNA并扩增内转录间隔区序列(ITS)、β-微管蛋白2(TUB2)、肌动蛋白(Act)、甘油醛-3-磷酸脱氢酶(GAPDH)和几丁质酶(CHS-1)等5个基因序列。
系统发育分析:参考最新的尖孢炭疽复合种系统发育研究,在NCBI网站下载模式菌株和代表菌株序列[7]。使用Mega V6.0软件手动调整,所有的空白视为数据缺失。使用MrModeltest V3.6生成核苷酸替换模型。使用Mega V6.0对数据集进行最大简约法(maximum parsimony, MP)系统发育分析,分析尖孢炭疽复合种种间的系统进化关系,进化树利用Mega V6.0进行观察和编辑。
1.2.2 生物学特性测定 碳、氮源对供试菌株菌丝生长的影响:选择Czapek培养基为基础培养基。分别用等质量的木糖、阿拉伯糖、葡萄糖、果糖、半乳糖、麦芽糖、乳糖、果胶、纤维素、可溶性淀粉、多聚半乳糖醛酸、碱性木素、柠檬酸钾和酒石酸铵[14]替代Czapek培养基中的蔗糖,配制成不同碳源的培养基,以不含碳源的Czapek培养基为空白对照。分别用等质量的硝酸铵、硝酸钾、磷酸二氢铵、硫酸铵、氯化铵、蛋白胨和天冬酰胺替换Czapek培养基中的硝酸钠,配制成不同氮源的培养基,以不含氮源的Czapek培养基为空白对照。将4株供试菌株在PDA平板上活化7 d后,用灭菌的内径5 mm的打孔器制取菌饼接种于含不同碳、氮源的平板中央,各3次重复。28 ℃恒温培养5 d后,采用十字交叉法测量菌落直径。
温度对供试菌株菌丝生长的影响:将4株供试菌株菌饼接种于PDA平板中央,各3次重复。后分别放置在12、16、20、24、28、32、36、40 ℃条件下恒温培养。5 d后,采用十字交叉法测量菌落直径。
pH对供试菌株菌丝生长的影响:PDA培养基冷却至50 ℃左右,加入1 mol/L HCl溶液或1 mol/L NaOH溶液将培养基pH分别调至4、5、6、7、8、9,制作平板。后接入4株供试菌株菌饼,各3次重复。28 ℃恒温培养5 d后,采用十字交叉法测量菌落直径。
水活度对供试菌株菌丝生长的影响[15]:水活度(Aw)代表微生物生长过程中参与生化反应的自由水的有效值。在1 L PDA培养基中分别添加0、108、198、245、313 mL甘油,然后加入dH2O定容至1 L制备成不同水活度(1.00、0.99、0.95、0.93、0.90)的培养基(甘油将附着一部分水,使其无法被病原菌利用),以水活度为1作对照。后接种菌饼,各3次重复。28 ℃恒温培养8 d后,采用十字交叉法测量菌落直径。
1.2.3 致病性测定 供试菌株对不同橡胶品种的致病性测定:采用孢子悬浮液接种离体叶片法测定。摘取PB86、PB235、PB260、IAN873、GT1、PR107、RRIC600、RRIC100、文昌11、云研77-4、热研7-33-97共11个当前各省主栽或主推橡胶品种的健康古铜期叶片,先用70%的酒精表面消毒1 min,后用无菌水清洗3次,晾干备用。取活化培养7 d的平板,用无菌水洗下孢子,配制成浓度为106 CFU/mL的孢子悬浮液。将处理好的叶片正面放置在铺有吸水纸的培养皿中,在合适位置(以半边叶片中间位置最佳)接种20 μL孢子液,各3次重复。以滴加等量无菌水为空白对照。喷洒适量无菌水于吸水纸上,封口后放置在28 ℃下恒温培养。每12 h定时观察叶片表面是否出现侵染症状,记录发病时间,4 d后拍照记录并测量病斑大小。
供试菌株对4种作物的致病性测定:采用孢子悬浮液接种离体叶片法测定。孢子悬浮液配制同上。选取番木瓜、芒果、番石榴的健康嫩叶和辣椒叶片及果实,消毒晾干后,设刺伤和健康2个处理组,按同样的方法接种孢子悬浮液,各3次重复。以无菌水为对照。封口后28 ℃下保湿培养,4~6 d后观察、测量,评价供试菌株是否能侵染其他植物。
1.3 数据处理
采用Excel 2007软件整理数据,采用SPSS 17.0软件进行差异显著性分析。
2 结果与分析
2.1 橡胶尖孢炭疽复合种种间分子系统发育分析
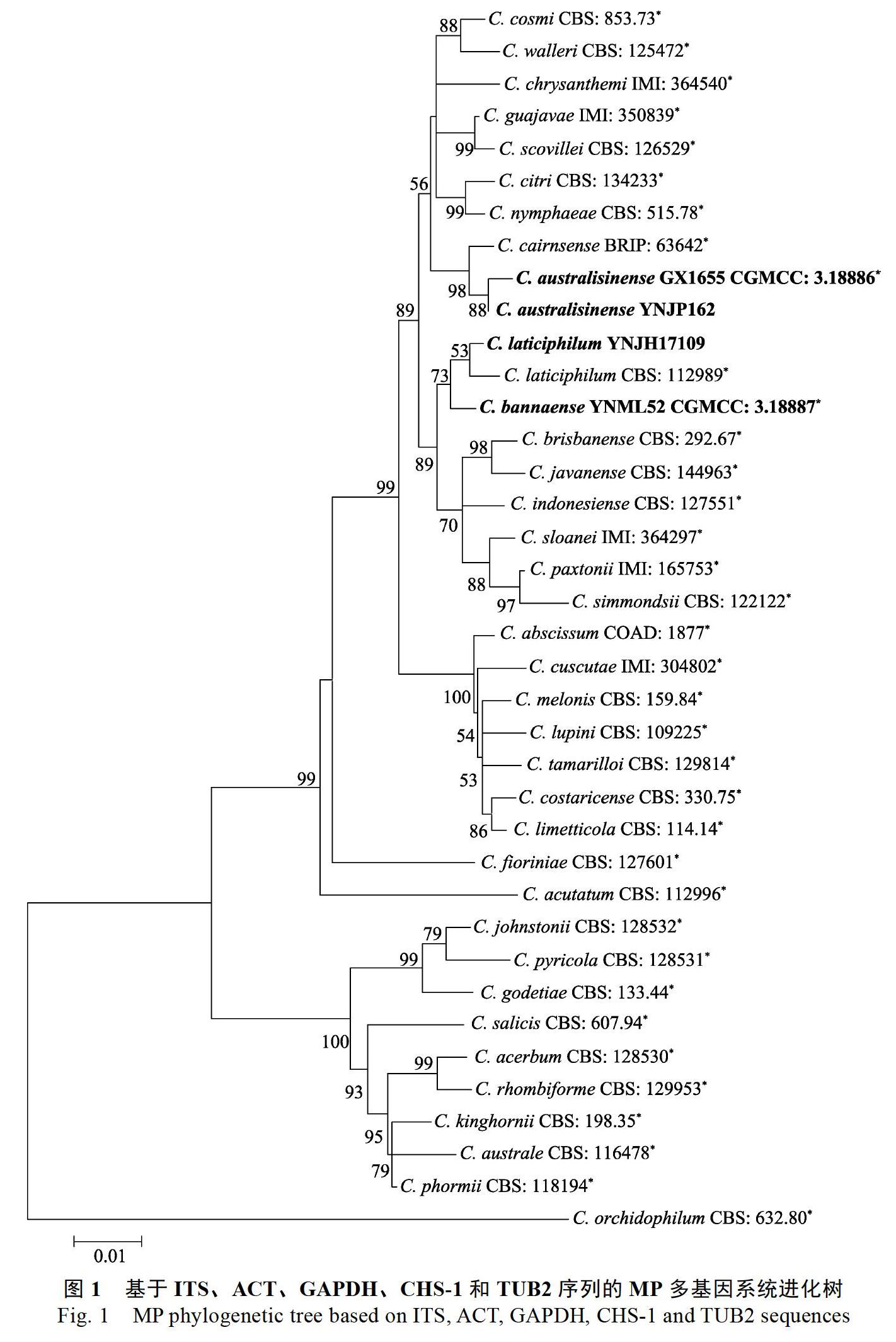
根据NCBI数据库中ITS序列的BLAST搜索结果显示,YNJH17109与尖孢炭疽复合种同源性达99%以上。图1展示了来源于橡胶树的尖孢炭疽(图中粗体表示)在尖孢炭疽复合种中的系统发育关系。36株菌的基因序列(ITS、TUB2、ACT、GAPDH和CHS-1)串联排列,以C. orchidophilum CBS 632.80作为外群。组合序列包含空白共1649个特征,其中各基因区间为:ITS:1~478,TUB2:479~961,GAPDH:962~1197,ACT:1198~1417,CHS-1:1418~1649。MRmodeltest v3.6預测最大似然树构建最佳模型为GTR+G。利用Mega V6.0构建最大似然树,1000次重复,各分支大于50%的后验概率标注于相应节点处。4株来自橡胶树的尖孢炭疽分属于3个独立分支。归属于华南炭疽的GX1655和YNJP162与C. cairnsense亲缘关系最近,版纳炭疽YNML52与C. laticiphilum聚为姐妹枝,YNJH17109则与C. laticiphilum聚在一个分支。
2.2 不同碳源、氮源对供试菌株菌丝生长的影响
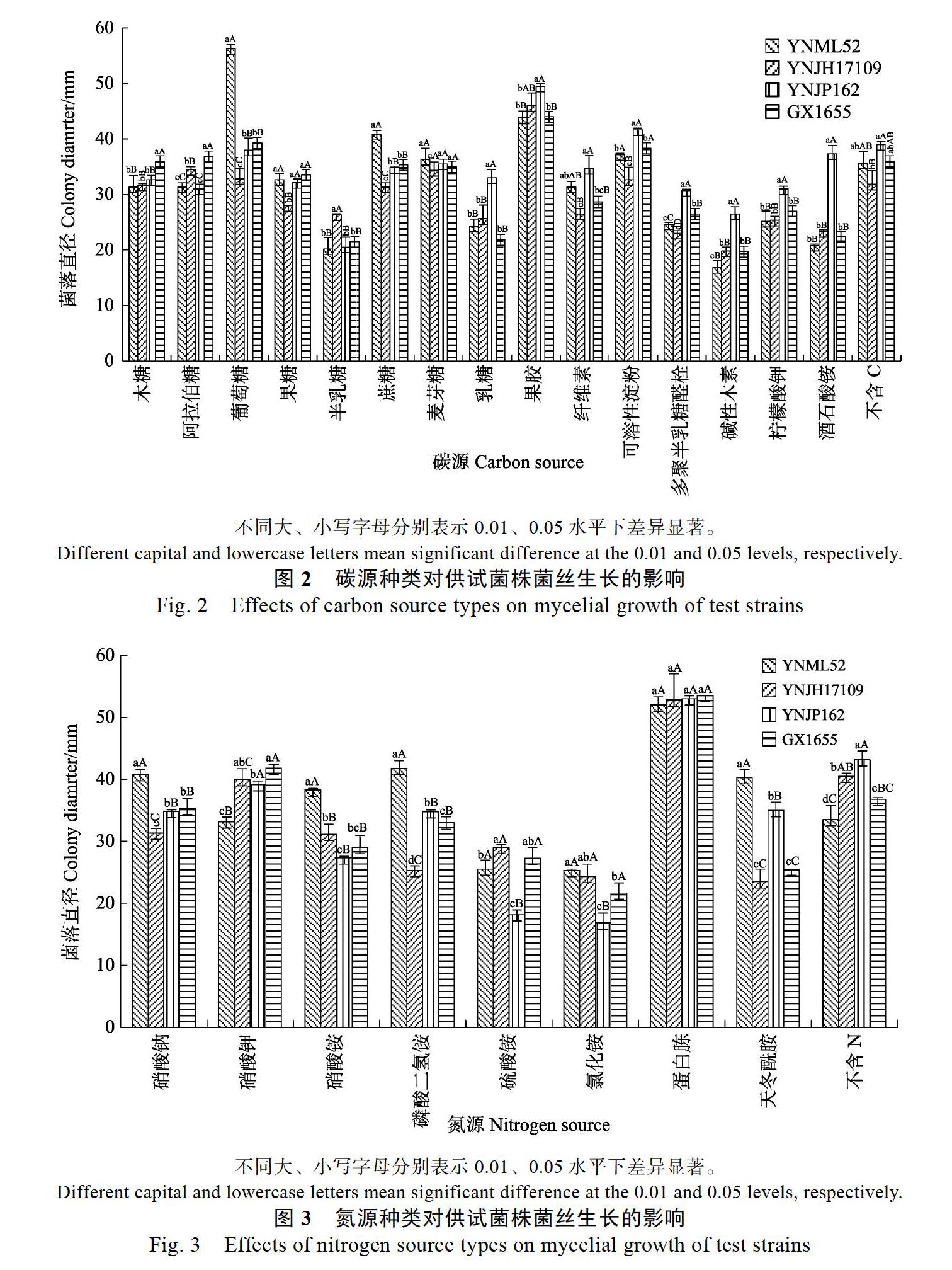
2.2.1 不同碳源对菌丝生长的影响 4株尖孢炭疽在供试的5种单糖、3种二糖、5种多糖和2种有机酸共15种碳源上均有生长,但不同碳源的影响程度有差异(图2)。半乳糖和乳糖分别是4株尖孢炭疽利用率最低的单糖和二糖;多糖中则果膠的利用率最高,碱性木素最低。其中,YNML52分别在葡萄糖、蔗糖为碳源时菌落直径最大,在碱性木素上最小;YNJH17109在半乳糖上最大,分别在葡萄糖、果糖、蔗糖、纤维素、可溶性淀粉和多聚半乳糖醛酸上最小;YNJP162分别在乳糖、果胶、可溶性淀粉、多聚半乳糖醛酸和碱性木素上最大;GX1655分别在木糖、阿拉伯糖上最大;以上差异均达到显著水平。此外,YNJP162对2种有机酸的利用率极显著大于另外3个菌株。
2.2.2 不同氮源对菌丝生长的影响 4株尖孢炭疽在供试的3种硝态氮、3种铵态氮和2种有机氮共8种氮源上均有生长,但存在差异,同类氮源间利用率也存在差异(图3)。硝态氮中,YNML52偏好利用硝酸钠,另外3株则偏好利用硝酸钾;YNML52在硝酸钾上生长最慢,但在硝酸铵上则最快;YNJH17109在硝酸钠上生长最慢。铵态氮中,YNML52在磷酸二氢铵上具有最大菌落直径;YNJH17109对磷酸二氢铵利用率最差;YNJP162在硫酸铵和氯化铵上生长最慢。蛋白胨是4株炭疽在包括有机氮在内的所有氮源中利用率最高的,且相互间生长量无明显差异;YNML52对天冬酰胺的利用率最强,YNJH17109和GX1655最弱。
2.3 不同温度对供试菌株菌丝生长的影响
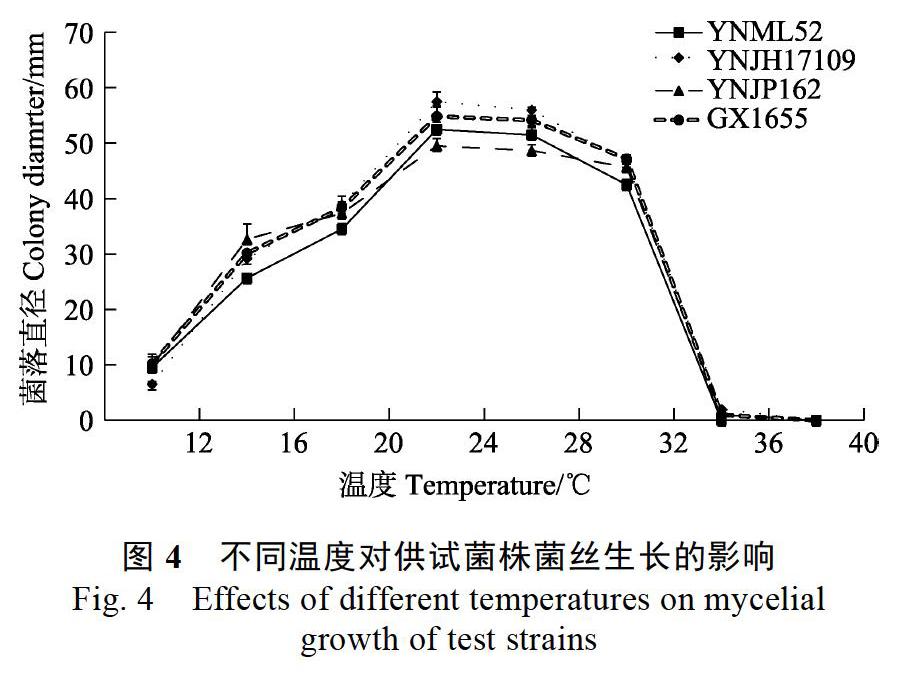
4株尖孢炭疽在供试的不同温度环境下生长情况不同(图4)。低温环境下(12~20 ℃),随着温度升高,4株炭疽的菌落直径均呈不同幅度的增大,其中YNJH17109的菌落直径增幅最大。适温环境内(24~28 ℃),温度升高各菌株间的菌落直径无明显差异,其中28 ℃下菌落直径最大的是YNJH17109,其后依次是GX1655、YNML52和YNJP162。高温环境中(32~40 ℃),32 ℃下4株尖孢炭疽的菌落直径均显著减小,YNML52的菌落直径明显小于另外3株,其中YNJP162的菌落直径减幅最小;升高温度至36 ℃,YNJH17109、YNJP162和GX1655仅呈现极其微弱的生长,而YNML52不能生长;40 ℃下,所有菌株均不能生长。总体而言,4株尖孢炭疽的最适生长温度均为24~28 ℃,YNML52的致死温度为36 ℃,其余3株的致死温度为40 ℃。
2.4 不同pH对供试菌株菌丝生长的影响
4株尖孢炭疽在供试的6个pH条件下均可生长,梯度间菌落变幅较小(图5)。YNML52在pH=7时菌落直径最大,pH<7时菌落直径随pH上升而增大,pH>7时则逐渐减小,最适pH为7;YNJH17109在pH为6~8时菌落直径均较大,pH为4~6时菌落直径逐渐增大,pH>8时则逐渐减小,最适pH为6~8;YNJP162在pH为7~8时菌落直径均较大,pH<7时菌落直径随pH上升而增大,pH>8时则逐渐减小,最适pH为7~8;GX1655则在pH为5~9时菌落直径均较大,pH为4时菌落直径最小,最适pH为5~9。
2.5 不同水活度对供试菌株菌丝生长的影响
不同水活度对4株尖孢炭疽生长的影响存在一定差异(图6)。对照生长8 d后,YNJP17109和GX1655的生长量明显大于YNML52和YNJP162。添加甘油替代一部分水后,各菌株生长速率均呈显著下降趋势。水活度为0.99时,YNJP162菌落直径最大,与对照相比菌落直径减幅最大的是YNJH17109和GX1655,减幅分别达到35.00、48.80 mm。水活度降至0.95时,YNJH17109和GX1655的生长量极显著小于YNJP162和YNML52,与对照相比菌落直径减幅最大的仍是YNJH17109和GX1655,分别减小了72.50、74.47 mm。当水活度降至0.93及以下时,所有菌株均不能生长。
2.6 供试菌株对不同橡胶品种的致病性评价
接种孢子悬浮液4 d后,4株炭疽对绝大部分橡胶品种均表现致病性,但致病程度存在差异(图7)。YNML52在PB235、PR107和热研7-33-97上未表现任何症状,在其余品种上潜伏期为2~ 3 d,发病后在IAN873和RRIC600上病斑扩展较快,分别在PB86、IAN873、GT1、文昌11和云研77-4上病斑直径最小。YNJH17109对所有供试品种均致病,潜伏期为1.5~2 d,热研7-33-97发病后病斑扩展较快,在RRIC100上的病斑直径最大。YNJP162不能侵染PR107,潜伏期为1~2.5 d,RRIC600、热研7-33-97接种1 d后即发病,侵染PB86后病斑扩展较快,在热研7-33-97上的病斑直径最大。GX1655侵染所有供试品种,潜伏期为1.5~2 d,RRIC600发病后病斑扩展较慢,在IAN873上的病斑直径最大。
2.7 供试菌株对4种作物的致病性评价
番木瓜叶片接种4 d后,健康叶片中YNJH-17109和GX1655可使其发病,形成褐色、萎蔫状病斑,前者病斑较大;刺伤叶片上除YNML52外均致病,YNJH17109病斑最大,GX1655最小。芒果叶片接种4 d后,健康叶片中仅YNML52不致病,其余均形成黑色、腐烂状病斑;刺伤叶片上均致病,YNJH17109和YNJP162病斑最大。番石榴叶片接种6 d后,健康叶片中仅YNJP162具有致病力,形成极小黑色点状病斑;刺伤叶片上除YNML52外均致病,YNJH17109病斑最大,GX1655最小。辣椒叶片接种6 d后,所有处理中仅YNJP162在健康叶片上形成直径2 mm的极小黑色点状斑;辣椒果实接种6 d后,仅见GX1655在刺伤条件下形成褐色、圆形、坏死状病斑,病斑达19.50 mm(图8)。
3 讨论
增加基因数目以提高构建复杂程度和准确性的多位点系统发育分析方法已成为当前刺盘孢属分类的一大趋势。本研究采用的5基因聚类分析结果支持将编号YNJH17109的菌株归入尖孢炭疽复合种中的C. laticiphilum,2012年[16]报道该种主要分布于哥伦比亚、斯里兰卡和印度。國内于2019年在西双版纳植胶区首次发现该种[10],与版纳炭疽同为省内特有种,两者相对于华南炭疽分布较为局限。就目前而言,云南是国内最早发现尖孢炭疽为害的区域,且物种多样性较高,一定程度上可能与其靠近东南亚、南亚等尖孢炭疽为害严重的植胶国有关。
病原真菌生物学特性的研究是病害防治中重要的理论来源,有些研究也将其作为物种划分的参考依据。已有文献[17-20]报道尖孢炭疽对果胶和蛋白胨的利用率最高,与本研究中的4株橡胶尖孢炭疽表现一致;张春霞等[21]发现尖孢炭疽更偏好利用乳糖,这与本研究结果明显相反;李菲菲[22]提出铵态氮会抑制尖孢炭疽生长,本研究中也观察到类似现象。真菌菌落生长速率是鉴别炭疽种群的重要特征[7]。YNML52分别在葡萄糖、蔗糖为碳源和硝酸钠、硝酸铵、磷酸二氢铵为氮源的基质上菌落直径明显最大;YNJH17109在半乳糖上最大,分别在磷酸二氢铵、天冬酰胺上最小;YNJP162分别在乳糖、果胶、可溶性淀粉、多聚半乳糖醛酸、碱性木素、柠檬酸钾和酒石酸钠上最大,分别在硫酸铵、氯化铵上最小;GX1655则分别在木糖和阿拉伯糖上最大。这可能成为橡胶树尖孢炭疽复合种内划分的一种有效方法。温度、pH和水活度是影响尖孢炭疽生长的重要因子。已有文献[18, 22]报道的尖孢炭疽适生温度与本研究总体一致,而YNJP162的适生温度相对较宽,YNML52对高温的耐受性最弱。胡美娇等[18]认为尖孢炭疽在弱酸至弱碱条件下均能生长,但最适pH范围差异较大,本研究中供试菌株对环境酸碱度的要求也不一致。Es-Soufi等[15]证实尖孢炭疽对环境中水含量变化响应强烈,本研究与其类似,正常水活度下生长较缓慢的菌株在少水条件下的生长量高于正常条件下生长较快的菌株,推测较高生长速率的菌株对自由水的需求更大。当前,随着复合种内分类地位逐步清晰,准确的种间差异情况将为开展病原识别、病害防控等研究提供必要指导。
明确橡胶树尖孢炭疽种间致病性和寄主范围的差异情况,结合各区域栽培品种和病原种群的分布信息,对炭疽病害的流行、监测和防治具有一定的参考价值。总体而言,4株尖孢炭疽对当前多数主栽品种均具有致病性。但YNML52对供试中的3个品种无致病性,在致病品种中发病病斑最小且潜伏期最长,因而版纳炭疽危害程度相对较小。已有研究认为,离体条件下的菌株致病程度受到孢子悬浮液浓度、潜伏期、菌斑生长速率、叶片面积大小等因素的共同影响[23]。李文杨等[24]报道橡胶品种PB260、IAN873、GTI、RRIC600、云研77-4对橡胶尖孢炭疽的抗性水平较低,可能会造成较为严重的病害流行,本研究与其相似;但PR107未被YNML52和YNJP162侵染,且另外2个菌株侵染后病斑扩展速率和平均直径也最小,推测其对尖孢炭疽具有一定程度的抗性。尖孢炭疽复合种的为害多见于热带果蔬作物[18, 20, 25],部分种寄主多样、致病谱广[16-17]。测试发现YNML52仅在刺伤的芒果叶片上表现致病,推测版纳炭疽的寄主专化性程度较高。YNJH17109和GX1655侵染健康的番木瓜和芒果叶片,而后者病斑远小于前者;但仅GX1655在刺伤条件下损毁辣椒果实,推测YNJH17109在果树类作物上致病力更强,GX1655则在果蔬类作物上危害更大。此外,YNJP162在多数处理下的致病程度均大于GX1655,且可能是番石榴和辣椒叶片的潜在病原;结合基础生物学特性及橡胶品种致病性方面表现的差异,推测YNJP162与GX1655并非同一物种,或是一新种,相关结论还需分子实验进一步验证。
参考文献
[1] 陈明文. 我国天然橡胶产业发展形势与因应策略[J]. 农业经济问题, 2016, 37(10): 91-94, 112.
[2] 黄贵修, 许灿光, 李博勋. 中国天然橡胶病虫草害识别与防治[M]. 2版. 北京: 中国农业科学技术出版社, 2018.
[3] 刘秀娟, 杨业铜, 冷怀琼. 我国植胶垦区橡胶树炭疽病菌的种型鉴定[J]. 热带作物学报, 1987(8): 93-101.
[4] Hunupolagama D M, Chandrasekharan N V, Wijesundera W S S, et al. Unveiling members of Colletotrichum acutatum species complex causing Colletotrichum leaf disease of Hevea brasiliensis in Sri Lanka[J]. Current Microbiology, 2017, 74(6): 747–756.
[5] 张春霞, 何明霞, 李加智, 等. 云南西双版纳地区橡胶炭疽病病原鉴定[J]. 植物保护, 2008, 34(1): 103-107.
[6] Marin-Felix Y, Groenewald J Z, Cai L, et al. Genera of phytopathogenic fungi: GOPHY 1[J]. Studies in Mycology, 2017(86): 99-216.
[7] Liu X B, Huang G X, Cai J M, et al. Diversity of Colletotrichum species causing anthracnose of rubber tree in China[J]. Scientific Reports, 2018(8): 10435.
[8] 林春花, 孙董董, 韩 丹, 等. 中国橡胶树苗圃2种炭疽病菌分子鉴定及分布分析[J]. 热带作物学报, 2014, 35(9): 1802-1808.
[9] 林春花, 杨 欢, 赵晓宇, 等. 海南橡胶树炭疽菌Colletotrichum siamense和C. fructicola的鉴定及系统发育分析[J]. 热带作物学报, 2018, 39(1): 129-136.
[10] Shi Y P, Liu Y X, Li L L, et al. First report of Colletotrichum laticiphilum causing anthracnose of rubber tree in China[J]. Plant Disease, 2019, 103(3): 579-580.
[11] Cao X R, Xu X M, Che H Y, et al. Distribution and fungicide sensitivity of Colletotrichum species complexes from rubber tree in Hainan, China[J]. Plant Disease, 2017, 101(10): 1774-1780.
[12] 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998.
[13] 孙广宇, 宗兆锋. 植物病理学实验技术[M]. 北京: 中国农业出版社, 2002.
[14] Prihastuti H, Cai L, Chen H, et al. Characterization of Colletotrichum species associated with coffee berries in northern Thailand[J]. Fungal Diversity, 2009(39): 89-109.
[15] Es-Soufi R, Kbiach M L E, Errabii T, et al. Biology and physiology of Colletotrichum acutatum strains causing strawberrys anthracnose[J]. Agricultural Sciences, 2018, 9(8): 974-990.
[16] Damm U, Cannon P F, Woudenberg J H C, et al. The Colletotrichum acutatum species complex[J]. Studies in Mycology, 2012, 73(1): 37-113.
[17] 夏 花. 辣椒上一种新病害病原鉴定及尖孢炭疽菌株比较研究[D]. 长沙: 湖南农业大学, 2012.
[18] 胡美姣, 李 敏, 杨凤珍, 等. 两种杧果炭疽病菌生物学特性的比较[J]. 西南农业学报, 2005, 18(3): 306-310.
[19] 杨佳文, 赵尊练, 张管曲, 等. 陕西线辣椒炭疽病原菌的鉴定及生物学特性研究[J]. 西北农业学报, 2017, 26(11): 1695-1705.
[20] 吳 松. 泾阳线辣椒炭疽病和叶斑病生物学特性研究及防控药剂筛选[D]. 杨凌: 西北农林科技大学, 2018.
[21] 张春霞, 李加智, 何明霞, 等. 两种橡胶炭疽病菌生物学特性的比较[J]. 西南农业学报, 2008(3): 667-670.
[22] 李菲菲. 柑橘炭疽病的生物学特性及其拮抗酵母菌的研究[D]. 武汉: 华中农业大学, 2009.
[23] Cabrera L, Rojas P, Rojas S, et al. Most Colletotrichum species associated with tree tomato (Solanum betaceum) and mango (Mangifera indica) crops are not host-specific[J]. Plant Pathology, 2018, 67(5): 1022-1030.
[24] 李文杨, 郑春耀, 李超萍, 等. 中国橡胶树主栽品系和部分种质对尖孢炭疽病的室内抗性评价[J]. 热带农业工程, 2009, 33(5): 35-40.
[25] 罗 霓, 何 凡, 范鸿雁. 海南省番木瓜主要真菌病害调查[J]. 中国热带农业, 2008(4): 48-50.
