丛枝菌根真菌对黄花蒿生长和根系分泌物化学组成的影响
2020-10-29孙晨瑜曾燕红马俊卿刘璐王文奇黄京华
孙晨瑜 曾燕红 马俊卿 刘璐 王文奇 黄京华
摘 要:研究盆栽条件下,接种与未接种丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)摩西球囊霉(Glomus mosseae)对黄花蒿(Artemisia annua L.)生长和根系分泌物化学组成的影响。结果表明,接种AMF黄花蒿的株高、苗干重和根干重均显著增加,增幅均达到20%以上;接种AMF也改善了黄花蒿的根系形态,除了根系半径以外,根长增加了87.0%、根表面积增加了97.0%、根体积增加了10.7%、根尖数增加了38.4%、根分叉数增加了75.6%、根系活力提高了19.6%,差异均达到极显著水平;与未接种AMF的黄花蒿基质中的根系分泌物(NM-S)相比,接种AMF下黄花蒿基质中的根系分泌物(AM-S)可溶性蛋白含量增加了74.38%,可溶性糖含量增加了16.13%,游离氨基酸含量增加了203%,有机酸的种类增多且含量显著提高;但接种AMF对黄花蒿水培液中根系分泌物含量的影响却呈现出了相反的作用。说明接种AMF有助于改善黄花蒿的根系形态,提高根系活力,在基质中促进根系分泌物的分泌,从而使黄花蒿汲取更多养分、提高生物量。
关键词:丛枝菌根真菌;黄花蒿;根系分泌物
中图分类号:S567.2 文献标识码:A
Abstract: The effects of arbuscular mycorrhizal fungi (AMF) Glomus mosseae on the growth index and the root exudates chemical composition of Artemisia annua L. were studied under potted conditions. The results showed that the height, shoot dry weight and root dry weight of A. annua inoculated with AMF increased significantly, with an increase of more than 20%; in addition to root radius, root length, root surface area, root volume, tips, forks and root activity of A. annua increased by 87.0%, 97.0%, 10.7%, 38.4%, 75.6% and 19.6%, respectively; compared with the root exudates obtained from the matrix of A. annua without AMF inoculation (NM-S), the content of soluble protein, soluble sugar and free amino acid in the root exudates obtained from matrix of A. annua with AMF inoculation (AM-S) increased by 74.38%, 16.13% and 203%, respectively, following the types and contents of organic acids increased significantly; but the effects of AMF on the root exudates of hydroponic solution showed an opposite trend. In the substrate, AMF may improve root morphology, root activity and secretion of the root exudates so that A. annua could absorb more nutrients and improve its biomass.
Keywords: arbuscular mycorrhizal fungi; Artemisia annua L.; root exudates
DOI: 10.3969/j.issn.1000-2561.2020.09.016
植物通过合成和释放根系分泌物对周围环境产生影响,目前已发现超过10万种植物次生代谢物质[1]。在自然界中,根系分泌物在植物种内和种间相互关系、群落演替和生物入侵等领域的重要作用近年来得到了广泛的关注,成为作物学和生态学领域的研究热点[2-3]。
黄花蒿(Artemisia annua L.)是一種具有解毒作用的草本植物,20世纪70年代青蒿素被从其体内成功提取分离出来[4]。青蒿素是世界卫生组织认定的治疗抗药性疟疾最有效的治疗药物,其也被证明有抗肿瘤特性[5]。由于青蒿素人工合成的生产成本很高,因此,目前仍然需要从黄花蒿中提取,而黄花蒿的野生资源已不能满足大量提取的需要,主要依靠人工栽培来生产。如何提高人工栽培黄花蒿的产量和质量就成为值得深入研究的问题。丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)在农业生产上的应用越来越受到重视,而且相关领域的研究越来越透彻,或许能应用于黄花蒿的人工栽培。AMF是一类非常常见的内生真菌,能同陆地80%以上的植物形成互惠共生体[6-7]。AMF侵染宿主植物根系之后,可以从宿主中汲取它自身代谢所需的碳源,与此同时,还能促进植物对土壤中营养成分的吸收,改善根系分泌活动,进而有利于植物的生长、增强植物的抗逆性[8-9]。Stefanowicz等[10]研究发现红蔷薇的入侵伴随着土壤中AMF生物量的增加,植物根系的次生代谢产物含量显著增加。Chen等[11]发现,在营养胁迫下,接种AMF摩西球囊霉(Glomus mosseae)可以改善甘草根系结构、提高类黄酮化合物的积累以及植物对P、K、Mg、Cu、Zn和Mn的吸收。黄京华等[12]研究表明,接种摩西球囊霉使黄花蒿吸收更多的N、P和K,促进其光合作用,增加青蒿素含量。但是,AMF促进黄花蒿养分吸收的机理还不清楚,是否与丛枝菌根共生介导的根系分泌物变化有关,有待进一步开展研究。
本文通过对黄花蒿接种AMF,探讨丛枝菌根共生对黄花蒿根系分泌物的影响,对揭示AMF促进黄花蒿养分吸收的机理有重要意义,并可为黄花蒿的生产提供理论依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 供试黄花蒿为‘酉青1号,种子购自重庆市富民青蒿科技有限公司。丛枝菌根真菌菌种为摩西球囊霉(Glomus mosseae),购自中国丛枝菌根真菌种质资源库(Bank of Glomeromycota in China,BGC,编号NM02A),由本实验室用盆栽沙培法扩繁。供试的培养基质:河沙(购自本地建材市场)、泥炭(丹麦Pindstrup公司)。乳酸、乙酸、甲酸、苹果酸、酒石酸、草酸、柠檬酸对照品,均购自Sigma公司。
1.1.2 仪器与设备 UV-2450紫外-可见分光光度计(日本岛津),Expression 11000xl根系扫描仪(日本Epson),PH100-DB800U-IPL光学显微镜(江西凤凰数码),Dionex ICS-5000离子色谱仪(美国Thermo Fisher)。
1.2 方法
1.2.1 盆栽试验设计 试验设2个处理:即接种丛枝菌根真菌摩西球囊霉(以AM表示)和未接种丛枝菌根真菌(以NM表示)。采用盆栽,以河沙和泥炭(体积比4:1)为培养基质。河沙过3 mm筛后,自来水流动冲洗,干燥后置于高压蒸汽灭菌锅121 ℃高温湿热灭菌1 h,以灭活基质中原本可能含有的丛枝菌根真菌及其孢子,冷却后备用。将黄花蒿种子用10% H2O2浸泡消毒2 min,蒸馏水冲洗3遍,室温干燥备用。塑料花盆用0.1%高锰酸钾溶液浸泡消毒后用自来水冲洗干净。取冷却的灭菌河沙作盆栽培养基质,以每盆3 kg的量装入塑料花盆。接种处理组每盆接种摩西球囊霉菌剂150 g,对照处理组则每盆添加灭菌沙150 g。接种菌剂均匀拌在盆栽培养基质表层,之后将黄花蒿种子均匀播撒在接种菌剂表层,覆盖一层约1 cm厚度的灭菌基质。播种后立即浇水淋透培养基质。每个处理各20个重复,共40盆,在网室大棚内随机摆放。播种后到出苗前适时浇水,出苗后每周浇Hoagland营养液2次,每次每盆浇200 mL,并适时浇水。出苗整齐后,间苗,每盆留长势一致的苗5株。
1.2.2 菌根侵染率的测定 在盆栽4个月后对黄花蒿进行根系取样,用直径为1.0 cm的打孔器,在各盆栽中随机打孔取根5次。将取出的根系洗净,用剪刀剪成1.0 cm长的根段,用酸性品红染色后,镜检并计算测定菌根侵染率,至少要观察200条根段[13]。
1.2.3 黄花蒿生长指标的测定 从植物根部到最高点测量株高。取完整的黄花蒿,用蒸馏水冲洗掉残留在根系的盆栽培养基质,用滤纸吸干残留的水分。使用根系扫描仪进行根系扫描,并用根系分析应用软件WinRHIZO来分析根系的根长(cm)、根表面积(cm2)、根直径(mm)、根体积(cm3)、根尖数和根分叉数。将整株黄花蒿置于40 ℃烘箱烘干至恒重,测定黄花蒿的苗干重和根干重。
1.2.4 根系活力的测定 根系活力的测定参照氯化三苯基四氮唑(TTC)法[14],用紫外-可见分光光度计在485 nm波长下测定。
1.2.5 根系分泌物的收集 黄花蒿盆栽4个月后,分别收集水培液和残留在基质中的根系分泌物。
(1)水培液中的根系分泌物收集。从盆中取出整株黄花蒿,用自来水冲洗除去残留在根系上的盆栽培养基质,尽可能不伤及植株。用冰盒将试验材料带回实验室后,用蒸馏水再冲洗根系3遍,用吸水纸吸干表面水滴,将植株根部放入0.5 mmol/L的CaCl2溶液中过渡30 min,然后转移至装有250 mL CaCl2溶液(0.5 mmol/L)的1.7 L遮光塑料容器中,溶液刚好浸没根系。在充足的光照条件下培养4 h,取出植株后用蒸馏水冲洗其根部3次,冲洗液与水培过植物的CaCl2溶液合并即为黄花蒿水培液根系分泌物,此溶液用真空抽滤装置过0.22 μm的水系滤膜,过滤后的溶液保存在20 ℃的冰箱中,备用。接种与未接种AMF下黄花蒿水培液中的根系分泌物样品分别标记为AM-W、NM-W。
(2)基质中的根系分泌物收集。把盆栽的黄花蒿植株取出,去除盆中培养基质里的残根,称取50.0 g的培养基质转移至150 mL的锥形瓶中,加入去离子水100 mL振荡浸提24 h,溶液经双层滤纸过滤2次,再用真空抽滤装置过0.22 μm的水系滤膜,过滤后的溶液保存在20 ℃的冰箱中,备用。接种与未接种AMF下黄花蒿基质中的根系分泌物分别标记为AM-S、NM-S。1.2.6 根系分泌物中可溶性蛋白、可溶性糖和游离氨基酸含量的测定 将收集到的根系分泌物用旋转蒸发仪蒸干,加10 mL灭菌超纯水溶解后用于测定可溶性蛋白、可溶性糖和游离氨基酸的含量。可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法[14];可溶性糖含量的测定采用蒽酮比色法[14];游离氨基酸含量的测定采用茚三酮显色法[14]。
1.2.7 根系分泌物中有机酸的测定 将收集的根系分泌物過已活化的阳离子交换树脂柱,收集洗脱液。洗脱液再用旋转蒸发仪蒸干,加5 mL灭菌超纯水溶解,再经0.45 μm水系滤膜过滤。之后采用离子色谱法[15]测定有机酸(乳酸、乙酸、甲酸、苹果酸、酒石酸、草酸和柠檬酸)的含量。
1.3 数据处理
采用R 3.6.0软件包对数据进行独立样本t检验并作图。
2 结果与分析
2.1 菌根侵染率的测定结果和AMF对黄花蒿生长的影响
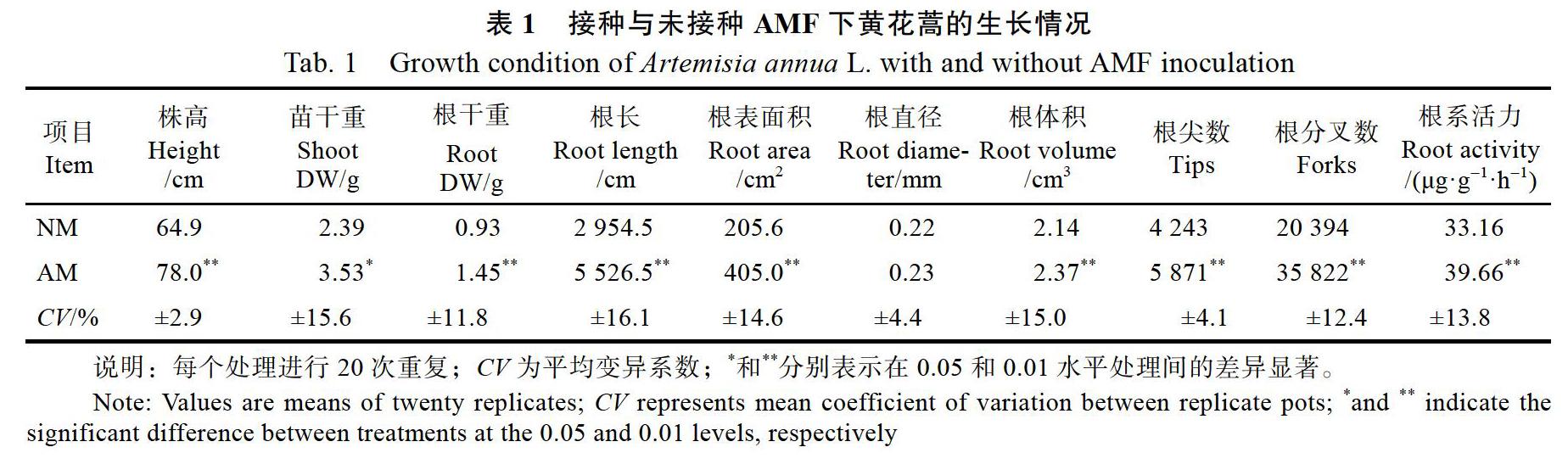
盆栽4个月后,AM菌根侵染率为52.8%,NM黄花蒿未被AMF侵染。由表1可知,与NM相比,AM的株高、苗干重和根干重均显著增加,增幅均达20%以上。接种AMF也改善了黄花蒿的根系形态,除了根系直径以外,根长增加了87.1%、根表面积增加了97.0%、根体积增加了10.7%、根尖数增加了38.4%、根分叉数增加了75.6%,根系活力提高了19.6%,与NM黄花蒿相比差异均达到极显著水平(P<0.01)。结果表明,丛枝菌根真菌能与黄花蒿形成良好的共生关系。丛枝菌根共生提高了黄花蒿的生物量,改善了根系形态并提高了根系活力。根系特性的改变会直接影响到根系分泌物的合成与分泌,基于此,黄花蒿根系分泌物的组成成分及含量也可能随着根系形态的改善与根系活力的提高而发生改变。
2.2 AMF对根系分泌物中可溶性蛋白含量的影响
从图1可知AMF对黄花蒿根系分泌物中可溶性蛋白含量的影响。接种AMF下黄花蒿水培液中的根系分泌物(AM-W)与未接种AMF下黄花蒿水培液中的根系分泌物(NM-W)相比,可溶性蛋白的含量下降了24.9%,存在极显著差异(P<0.01);而接种AMF下黄花蒿基质中的根系分泌物(AM-S)可溶性蛋白含量比未接种AMF下黄花蒿基质中的根系分泌物(NM-S)增加了74.38%,二者之间的差异也达到了极显著水平(P<0.01)。研究结果表明,接种AMF显著提高了基质根系分泌物中可溶性蛋白的含量,可能会促进黄花蒿根系合成与分泌更多的酶,从而有利于植物从基质中吸收更多的营养物质;在水培条件下,接种AMF对可溶性蛋白含量的影响却呈现相反的趋势,原因可能是水培缺氧胁迫对丛枝菌根共生体系极为不利。
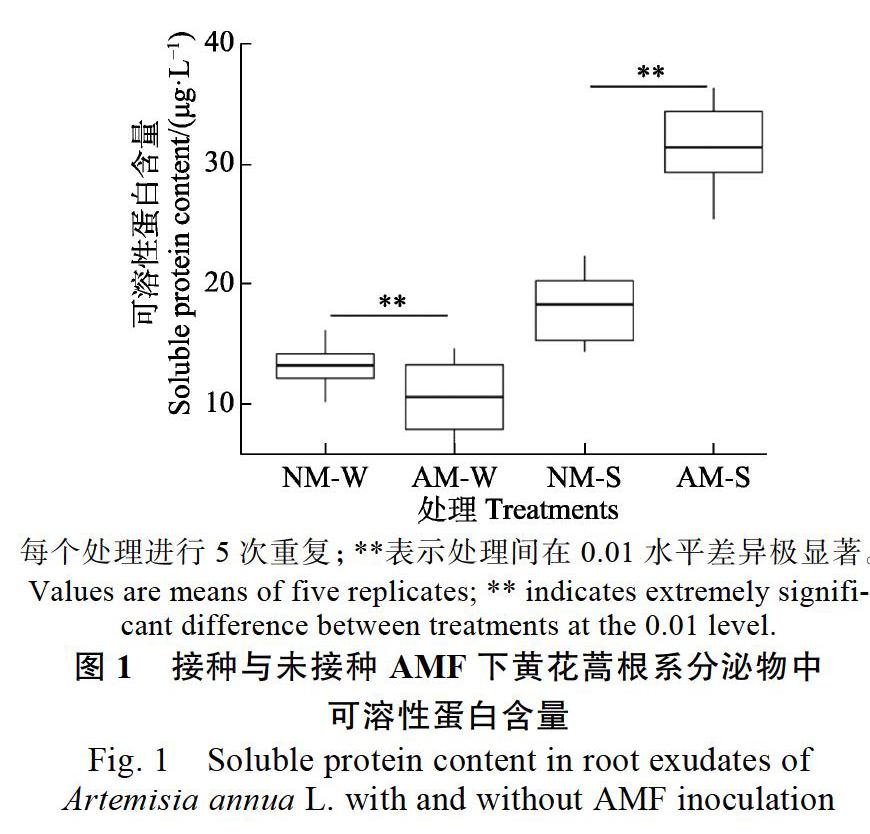
2.3 AMF对根系分泌物中可溶性糖含量的影响
由图2可知,接种AMF下黄花蒿水培液中的根系分泌物(AM-W)可溶性糖含量比未接种处理的(NM-W)少36.83%,两者存在极显著差异(P<0.01);而在盆栽条件下,AM-S可溶性糖含量比NM-S多16.13%,两者之间的差异也达到极显著水平(P<0.01)。研究结果表明,接种AMF显著提高了基质根系分泌物中可溶性糖的含量,从而有利于植物向基质中输送更多的碳源供土壤微生物吸收;而在水培条件下,可能是因为缺氧胁迫对丛枝菌根共生体系不利,导致AM-W可溶性糖含量低于NM-W。
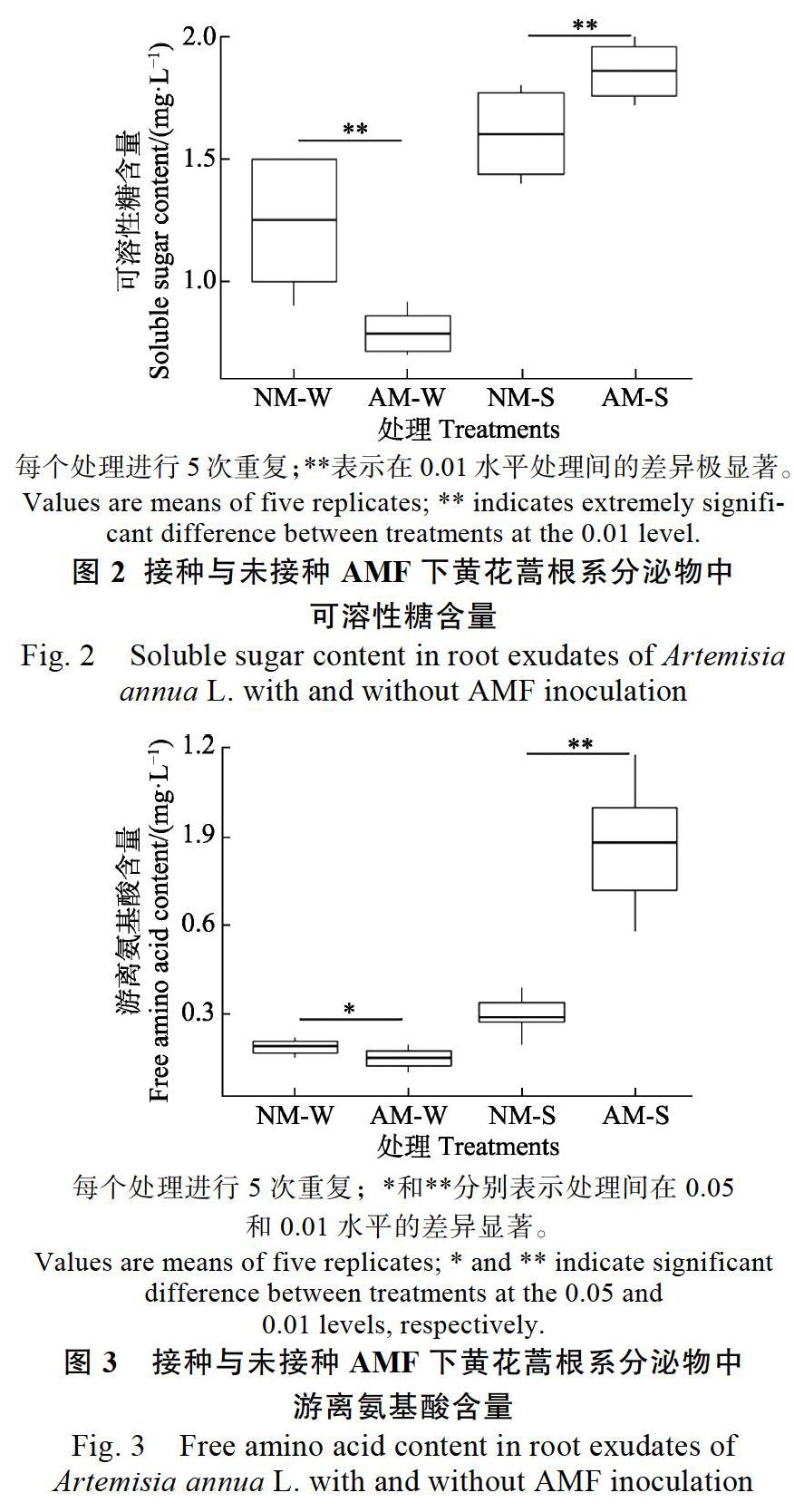
2.4 AMF对根系分泌物中游离氨基酸含量的影响
由图3可知,AM-W游离氨基酸含量比NM-W低3.33%,差异显著(P<0.05)。而AM-S游离氨基酸含量为NM-S的3.07倍,两者间的差异达到了极显著水平(P<0.01)。研究表明,接种AMF显著提高了基质根系分泌物中游离氨基酸的含量,从而供土壤微生物利用;而在水培条件下,可能是因为缺氧胁迫导致根系分泌物中可溶性糖含量偏低。
2.5 AMF对根系分泌中有机酸的影响
从表2可知,黄花蒿接种AMF后,其水培液根系分泌物中有机酸的种类和含量减少;但在盆栽条件下,其基质根系分泌物中有机酸的种类和含量显著增加,呈现出相反的趋势。NM-W检测出7种有机酸,而AM-W只检测出5种。两者均检测到的5种有机酸分别为甲酸、苹果酸、酒石酸、草酸和柠檬酸,NM-W有机酸的含量均高于AM-W,差异达到了极显著水平(P<0.01)。有机酸中,草酸的含量最高,NM-W与AM-W的草酸含量分别达72.36、67.65 mg/L。此外,与AM-W相比,NM-W中还检测到乳酸和乙酸。NM-S只检测到3种有机酸,而AM-S检测出4种。两者均检测到乳酸、甲酸和草酸,且AM-S中的有机酸含量均高于NM-S,两者有机酸含量的差异均达到极显著水平(P<0.01)。AM-S中还检测到乙酸,而NM-S中未检测到。结果表明,接种AMF显著提高了基质根系分泌物中有机酸的含量,有机酸可通过酸化、螯合、离子交换或还原等途径将难溶性物质转化为可被植物吸收利用的有效养分,从而提高根际土壤养分的有效性,促进了植物的生长发育。而在水培缺氧的条件下,植物根系分泌大量草酸对根系细胞有毒害作用,AM-W与NM-W相比显著降低了草酸的含量,表明接种AMF对缺氧胁迫有缓解作用。
3 讨论
研究表明,植物根系在与邻近植物和土壤微生物的互作中发挥着重要作用[16]。一方面,根系生物量和形态结构直接影响植物的生长和发育[17-18];另一方面,植物根系也可以合成和分泌化感物质,影响土壤微生物、改变土壤理化性质和抑制周围其他植物的生长[19-20]。Gealy等[21]利用稳定的13C同位素鉴别分析,发现根尖数和根生物量与水稻根系分泌物含量有重要联系。Zhu等[22]在车前草根中也观察到类似的情况,似乎根尖数越多、根系生物量越大越有助于根系分泌物的合成与分泌。在本研究中,黄花蒿接种AMF 4个月后,其根干重、根长、根表面积、根体积、根尖数、根分叉数和根系活力均显著提高,一方面有利于促进植物对土壤中营养成分的吸收,植株的苗高和苗干重随之增加,另一方面为根系分泌物的大量合成与分泌提供了基本条件。
可溶性蛋白、可溶性糖和游离氨基酸是植物根系分泌物的重要组成成分,具有调控根系生长以及为土壤微生物提供营养成分和能源物质的功能。AMF能促进植物对土壤中营养成分的吸收,改善根系分泌活动,进而有利于植物的生长、增强植物的抗逆性[8-9]。Feng等[23]研究发现,盐胁迫下AMF与植物形成共生关系后,显著增加了根系中可溶性糖的含量,改变了根系的渗透压,使得植物抵抗盐害的能力得以增强。包静[24]研究认为,盐胁迫的程度以及黄瓜不同的生长时期都会影响根系分泌物中可溶性糖的含量,盐胁迫同时还会使根系分泌物中氨基酸的含量和种类增加。Ohwaki等[25]研究发现,缺钾、缺锌胁迫也会使根系分泌物中的可溶性蛋白、可溶性糖和游离氨基酸的分泌量有所改变。接种AMF可能缓解植物所受的胁迫并提高根系分泌物中可溶性蛋白、可溶性糖和游离氨基酸的含量。本研究发现,接種AMF下的黄花蒿基质根系分泌物中可溶性蛋白、可溶性糖和游离氨基酸的含量均显著高于未接种AMF处理,这可能是因为AMF与黄花蒿共生后有利于植株吸收更多的营养元素,同时植物根系分泌更多的可溶性蛋白、可溶性糖和游离氨基酸,从而实现了真菌-植物和谐共生。但在黄花蒿水培液根系分泌物中却呈现出相反的结果,可能是由于水培缺氧的液体环境对植物根系有胁迫作用,且丛枝菌根共生下黄花蒿的根系生物量更大,需氧量更高,受到的胁迫作用更强。其中的原因有待进一步研究。
根系分泌物中的有機酸是良好的金属活化剂,它们在根际难溶性养分的活化和吸收等方面具有积极作用。在植物根际土壤中,根系分泌物通过酸化、螯合、离子交换或还原等途径将难溶性物质转化为可被植物吸收利用的有效养分,从而提高根际土壤养分的有效性,进而促进了植物的生长发育。Dinkelaker等[26]对白羽扇豆的研究中发现,在缺磷时,植物通过形成特殊的排根结构,并在排根处分泌大量的有机酸来活化难溶性磷以满足自身生长的需要。郭修武等[27]对连作葡萄接种AMF,研究发现AMF对葡萄的生长有促进作用,使叶片中SOD活性增强,MDA的含量降低,根系活力也增强,还提高了葡萄根系分泌物中有机酸的含量。刘进法等[28]研究发现,接种丛枝菌根真菌增加了枳实幼苗根系分泌有机酸的量,有机酸以苹果酸、柠檬酸和草酸为主。本研究发现,接种AMF下黄花蒿基质根系分泌物中有机酸的含量显著高于未接种AMF处理,表明接种AMF有利于黄花蒿植株分泌更多的有机酸,从而活化和吸收更多的根际难溶性养分。但在水培液缺氧的液体环境下,草酸的含量显著升高对黄花蒿根系有毒害作用,而丛枝菌根共生下根系分泌的草酸含量显著降低,表明AMF有缓解缺氧胁迫的作用。另外,有机酸易降解可能也会对试验结果产生影响。AMF对黄花蒿根系分泌物的作用机制有待更为深入的研究。
参考文献
[1] Inderjit, Wardle D A, Karban R, et al. The ecosystem and evolutionary contexts of allelopathy[J]. Trends in Ecology and Evolution, 2011, 26(12): 655-662.
[2] Fernandez C, Monnier Y, Santonja M, et al. The impact of competition and allelopathy on the trade-off between plant defense and growth in two contrasting tree species[J]. Frontiers in Plant Science, 2016, 7: 594.
[3] Zheng Y L, Feng Y L, Zhang L K, et al. Integrating novel chemical weapons and evolutionarily increased competitive ability in success of a tropical invader[J]. New Phytologist, 2015, 205(3): 1350-1359.
[4] Efferth T. From ancient herb to modern drug: Artemisia annua and artemisinin for cancer therapy[J]. Seminars in Cancer Biology, 2017, 46: 65-83.
[5] Li J, Feng W, Lu H, et al. Artemisinin inhibits breast cancer‐induced osteolysis by inhibiting osteoclast formation and breast cancer cell proliferation[J]. Journal of Cellular Physiology, 2019, 234(8): 12663-12675.
[6] Whiteside M D, Digman M A, Gratton E, et al. Organic nitrogen uptake by arbuscular mycorrhizal fungi in a boreal forest[J]. Soil Biology and Biochemistry, 2012, 55: 7-13.
[7] Wipf D, Krajinski F, Tuinen D V, et al. Trading on the arbuscular mycorrhiza market: From arbuscules to common mycorrhizal networks[J]. The New Phytologist, 2019, 223(3): 1127-1142.
[8] Lenoir I, Fontaine J, Lounès-Hadj Sahraoui A. Arbuscular mycorrhizal fungal responses to abiotic stresses: A review[J]. Phytochemistry, 2016, 123: 4-15.
[9] Parihar M, Meena V S, Mishra P K, et al. Arbuscular mycorrhiza: A viable strategy for soil nutrient loss reduction[J]. Archives of Microbiology, 2019, 201(6): 723-735.
[10] Stefanowicz A M, Zubek S, Stanek M, et al. Invasion of Rosa rugosa induced changes in soil nutrients and microbial communities of coastal sand dunes[J]. Science of the Total Environment, 2019, 677: 340-349.
[11] Chen M, Yang G, Sheng Y, et al. Glomus mosseae inoculation improves the root system architecture, photosynthetic efficiency and flavonoids accumulation of liquorice under nutrient stress[J]. Frontiers in Plant Science, 2017, 8: 931.
[12] 黄京华, 谭钜发, 揭红科, 等. 丛枝菌根真菌对黄花蒿生长及药效成分的影响[J]. 应用生态学报, 2011, 22(6): 1443-1449.
[13] 刘润进, 李晓林. 丛枝菌根及其应用[M]. 北京: 科学出版社, 2000.
[14] 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006.
[15] 曾燕红. 丛枝菌根真菌共生条件下黄花蒿根系及其分泌物化感作用研究[D]. 南宁: 广西大学, 2015.
[16] Laliberté E. Below-ground frontiers in trait-based plant ecology[J]. New Phytologist, 2017, 213(4): 1597-1603.
[17] Mallik A U, Biswas S R, Collier L C S. Belowground interactions between Kalmia angustifolia and Picea mariana: roles of competition, root exudates and ectomycorrhizal association[J]. Plant and Soil, 2016, 403: 471-483.
[18] Bardgett R D, Mommer L, De Vries F T. Going underground: Root traits as drivers of ecosystem processes[J]. Trends in Ecology and Evolution, 2014, 29(12): 692-699.
[19] Baetz U, Martinoia E. Root exudates: the hidden part of plant defense[J]. Trends in Plant Science, 2014, 19(2): 90-98.
[20] Tsunoda T, van Dam N M. Root chemical traits and their roles in belowground biotic interactions[J]. Pedobiologia, 2017, 65: 58-67.
[21] Gealy D R, Moldenhauer K A K, Duke S. Root distribution and potential interactions between allelopathic rice, sprangletop (Leptochloa spp.), and barnyardgrass (Echinochloa crus-galli) based on 13C isotope discrimination analysis[J]. Journal of Chemical Ecology, 2013, 39(2): 186- 203.
[22] Zhu X C, Skoneczny D, Weidenhamer J D, et al. Identification and localization of bioactive naphthoquinones in the roots and rhizosphere of Patersons curse (Echium plantagineum), a noxious invader[J]. Journal of Experimental Botany, 2016, 67(12): 3777-3788.
[23] Feng G, Zhang F, Li X, et al. Improved tolerance of maize plants tosalt stress by arbuscular mycorrhiza is related to higher accumulation of soluble sugars in roots[J]. Mycorrhiza, 2002, 12(4): 185-190.
[24] 包 靜. 盐胁迫对黄瓜根系分泌物及土壤微生物的影响[D]. 哈尔滨: 东北农业大学, 2009.
[25] Ohwaki Y, Hirata H. Differences in carboxylic acid exudation among p-starved leguminous crops in relation to carboxylic acid contents in plant tissues and phospholipid level in roots[J]. Soil Science and Plant Nutrition, 1992, 38(2): 235-243.
[26] Dinkelaker B, Romheld V, Marschner H. Citric acid excretion and precipitation of calcium citrate in rhizosphere of white lupin (Lupinus albus L.) [J]. Plant, Cell and Environment, 1989, 12(3): 285-292.
[27] 郭修武, 李 坤, 郭印山, 等. 丛枝菌根真菌对连作土壤中葡萄生长及根系分泌特性的影响[J]. 沈阳农业大学学报, 2009, 40(4): 392-395.
[28] 刘进法, 王 鹏, 罗 园, 等. 低磷胁迫下AM真菌对枳实生苗吸磷效应及根系分泌有机酸的影响[J]. 亚热带植物科学, 2010, 39(1): 9-13.
