27种丛枝菌根真菌接种对盆栽云木香生理生化及主要萜类成分的影响
2020-10-29阳文武郭冬琴曹纬国潘兴娇薛彦斌张杰周浓
阳文武 郭冬琴 曹纬国 潘兴娇 薛彦斌 张杰 周浓
摘 要:在室温盆栽实验条件下,研究了27种外源性丛枝菌根(arbuscular mycorrhiza,AM)真菌对云木香幼苗的根系菌根侵染率、生理生化特性、根生物量及萜类成分积累的影响。研究结果表明,云木香与AM真菌形成了良好的共生关系,但27种AM真菌菌株与云木香二者之间存在共生偏好性。与对照组(CK)相比,部分AM真菌提高云木香叶片中可溶性蛋白和可溶性糖含量及抗氧化酶活性,降低丙二醛含量,增强云木香抗不利环境的能力;部分AM真菌处理组云木香根生物量显著增加(P<0.05);大部分AM真菌处理组云木香根中木香烃内酯、去氢木香内酯及总内酯含量显著增加(P<0.05),也有部分AM真菌处理组差异不明显或降低。从综合接种效应来看,易误巨孢囊霉(Gigaspora decipiens,Gd)、美丽盾巨孢囊霉(Scutellospora calospora,Sca)、瑚状盾巨囊霉(Racocetra coralloidea,Rco)、沙荒球囊霉(Septoglomus deserticola,Sde)、哥伦比亚内养囊霉(Entrophospora colombiana,Ec)、巴西类球囊霉(Paraglomus brasilianum,Pb)等是人工栽培条件下接种AM真菌云木香幼苗的潜在优良菌株,可为提高云木香产量和品质开辟一条新的途径。
关键词:云木香;丛枝菌根真菌;接种效应;生理生化特性;萜类成分;共生偏好性
中图分类号:R282.2 文献标识码:A
Abstract: A pot experiment was conducted to investigate the effects of 27 exogenous arbuscular mycorrhizal (AM) fungi strains on the root mycorrhiza infection rate, physiological and biochemical characteristics, root biomass and terpenoids accumulation of Aucklandia lappa seedlings at room temperature. A. lappa had a good symbiotic relationship with AM fungi, but there was difference in the preference of 27 exogenous AM fungi species for A. lappa. Compared with CK, some AM fungi increased the soluble protein and soluble sugar content and antioxidant enzyme activity in the leaves of A. lappa, reduced the malondialdehyde content, enhanced the ability of A. lappa to resist adverse environment. Biomass of the roots of A. lappa increased significantly in some AM fungal treatment groups. In most AM fungi treatment groups, the content of costunolide, dehydrocostus lactone and total lactones in the roots of A. lappa increased significantly (P<0.05), while some AM fungi treatment groups showed no significant difference or decrease. According to the comprehensive inoculation effect, Gigaspora decipiens, Scutellospora calospora, Racocetra coralloidea, Septoglomus deserticola, Entrophospora colombiana, Paraglomus brasilianum are the potential strains to inoculate A. lappa seedlings under artificial cultivation conditions, which could help to improve the yield and quality of A. lappa.
Keywords: Aucklandia lappa; arbuscular mycorrhizal fungi; inoculation effect; physiological and biochemical characteristics; terpenoids; symbiotic preference
DOI: 10.3969/j.issn.1000-2561.2020.09.015
云木香(Aucklandia lappa Decne.)為菊科云木香属多年生草本植物,其干燥根是国内外著名的传统中药材“木香”,具有行气止痛、健脾消食等功效[1]。云木香在我国分布广泛,主产于云南、重庆、四川、湖北等省市。在国内,云木香种植面积最大在重庆市开州区[2-3]。萜类是云木香的主要有效成分,并以木香烃内酯和去氢木香内酯为代表,二者也是云木香药材质量控制的指标之一[1,4]。研究表明,萜类化合物具有抗肿瘤、抗炎、降血糖、利胆、促胃动力、抗胃溃疡、解痉镇痛、抗菌等生物活性[4-5]。目前,随着云木香道地药材产地扩散而栽培面积不断扩大,尽管在人工栽培技术方面取得了许多重要进展,但仍存在病虫害严重、入药品质不稳定等[2, 6]生产中迫切需要解决的问题。
菌根是自然界广泛存在的植物共生现象。丛枝菌根(arbuscular mycorrhiza,AM)真菌是一类在生物防治土传病害和提高植物抗/耐病性方面极具应用潜力的微生物资源[7-9]。以往的研究结果支持AM真菌能有效促进宿主植物对营养元素的吸收[10],有助于改善药用植物的生长发育[11],增强宿主植物对根腐病等病虫害的抗病性[12],增加宿主植物的生物量和影响植物的次生代谢过程[13]。课题组前期研究表明,AM真菌对云木香的光合生理、次生代谢产物均有显著影响[14-15],但关于不同AM真菌菌株对云木香生理生化和次生代谢产物影响的研究未见报道。为此,本试验采用可控实验,模拟大田生产进行促生试验,接种外源性27种AM真菌菌株,筛选出对云木香生长有益的优势AM真菌种类,探讨其对云木香生长发育的促进作用和改善土壤生态的效果,对实现云木香产业可持续发展具有重要意义。
1 材料与方法
1.1 材料
1.1.1 供试菌株与植物材料 (1)AM真菌菌株:微白巨孢囊霉(Gigaspora albida,Ga)、易误巨孢囊霉(G. decipiens,Gd)、巨大巨孢囊霉(G. gigantea,Gg)、球状巨孢囊霉(G. margarita,Gm)、玫瑰红巨孢囊霉(G. rosea,Gr)、美丽盾巨孢囊霉(Scutellospora calospora,Sca)、双紫盾巨孢囊霉(S. dipurpurascens,Sdi)、透明盾巨孢囊霉(S. pellucida,Spe)、异配盾孢囊霉(Dentiscutata heterogama,Dh)、瑚状盾巨囊霉(Racocetra coralloidea,Rco)、亮色盾巨孢囊霉(R. fulgida,Rfu)、沙荒球囊霉(Septoglomus deserticola,Sde)、黏质球囊霉(S. viscosum,Svi)、摩西球囊霉(Funneliformis mosseae,Fm)、明球囊霉(Rhizophagus clarus,Rcl)、根内球囊霉(R. intraradices,Rin)、孔窝无梗囊霉(Acaulospora foreata,Afo)、何氏无梗囊霉(A. koskei,Ako)、细凹无梗囊霉(A. scrobiculata,Asc)、刺无梗囊霉(A. spinosa,Asp)、象牙白多孢囊霉(Diversispora eburnea,De)、沾屑多孢囊霉(D. spurca,Ds)、哥伦比亚内养囊霉(Entrophospora colombiana,Ec)、巴西类球囊霉(Paraglomus brasilianum,Pb)、隐类球囊霉(P. occultum,Po)、薄壁两性囊霉(Ambispora leptoticha,Ale)、崔氏原囊霉(Archaeospora trappei,Atr),27株AM真菌均由國际丛枝菌根真菌菌种保藏中心(INVAM)提供,并经重庆三峡学院生物与食品工程学院郭冬琴副教授进行鉴定,作为本实验供试菌株。(2)木香种子:2012年10月22日,课题组在位于重庆市开县河堰镇的云木香种植基地,选取株高、株型一致的健壮植株,采其成熟、新鲜的种子,并经重庆三峡学院周浓教授鉴定为菊科植物木香Aucklandia lappa Decne。
1.1.2 主要试剂 木香烃内酯对照品(批号:110795-200806,含量99.0%)、去氢木香内酯对照品(批号:110757-200206,含量98.0%),中国食品药品检定研究院;甲醇(色谱纯),德国Merck公司;水为超纯水,其他试剂均为分析纯。
1.1.3 仪器与设备 LC-20A型高效液相色谱仪,日本岛津;BX51型显微镜,日本Olympus;SZX2型解剖显微镜,日本Olympus;KH-2000DB超声波清洗器(功率250 W,频率50 kHz),昆山禾创超声仪器有限公司;CP224S型万分之一天平,德国赛多利斯公司;ED53干燥箱,德国Binder公司;圣德利SDLA-B-1101型超纯水机,重庆圣德利医疗器械研究有限公司。
1.2 方法
1.2.1 接种处理及栽培管理 栽培用容器为15 cm×18 cm的棕色塑料花盆(用酒精擦拭3遍后用),栽培介质为园土和河沙按3∶1体积比混合制成,并经10目(2 mm)筛筛选,在121 ℃灭菌2 h。实验地点为重庆市万州区铁峰山国家森林公园室内,实验时间为2013年2月至2014年12月。
试验共设28个处理,设27组AM真菌处理组(育苗时单一接种AM真菌)和CK(对照)处理组(幼苗生长过程中不接种AM真菌),每处理组10个重复,每盆播种木香种子20粒,出苗后间苗5株。AM真菌接菌体均匀施于云木香种子(10%次氯酸钠溶液消毒15 min)的表土下,接种剂量为每盆300个孢子(接菌体带有孢子、菌丝及侵染后根系的栽培基质),同时播种紫云英(10%次氯酸钠溶液消毒15 min)混合培养,待云木香幼苗出土后除去紫云英植株。将盆栽放置于室温(自然光照)内,定期观察与分析,按照云木香的常规养护方法管理,每周浇1次Hoagland营养液。
1.2.2 样品采集与指标测定 (1)云木香叶片生理生化指标的测定。于2014年07月采集云木香幼苗叶片,利用张志良等[16]的方法检测超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、丙二醛(MDA)含量、可溶性糖含量和可溶性蛋白含量。
(2)云木香幼苗生物量的测定。于2014年12月份收获云木香根、须根,须根在冰水浴中洗净后剪成约1 cm长根段置于福尔马林-醋酸-酒精(FAA)固定液中固定,备用;根洗净后测定不同处理组新鲜生物量,于35 ℃烘箱中烘干至恒重,称定重量,计算折干率,折干率(%)=[干燥至恒重根重量(g)/新鲜根重量(g)]×100%,备用。
(3)AM真菌的侵染率测定。随机选取浸泡于FAA固定液中云木香须根50条,采用Philips等[17]的方法染色、制片、镜检,根据Trouvelot等[18]的方法统计菌根侵染率。
(4)木香烃内酯、去氢木香内酯的含量测定。按照2015年版《中华人民共和国药典》[1](一部)木香药材【含量测定】项下的方法,检测2种倍半萜内酯化合物的含量。
1.3 数据处理
每个指标重复测10次,结果以平均值±标准差表示。采用Excel 2003软件计算平均值、标准差,运用SPSS 22.0统计软件进行方差分析和显著性检验,使用Excel 2003软件绘图。
2 結果与分析
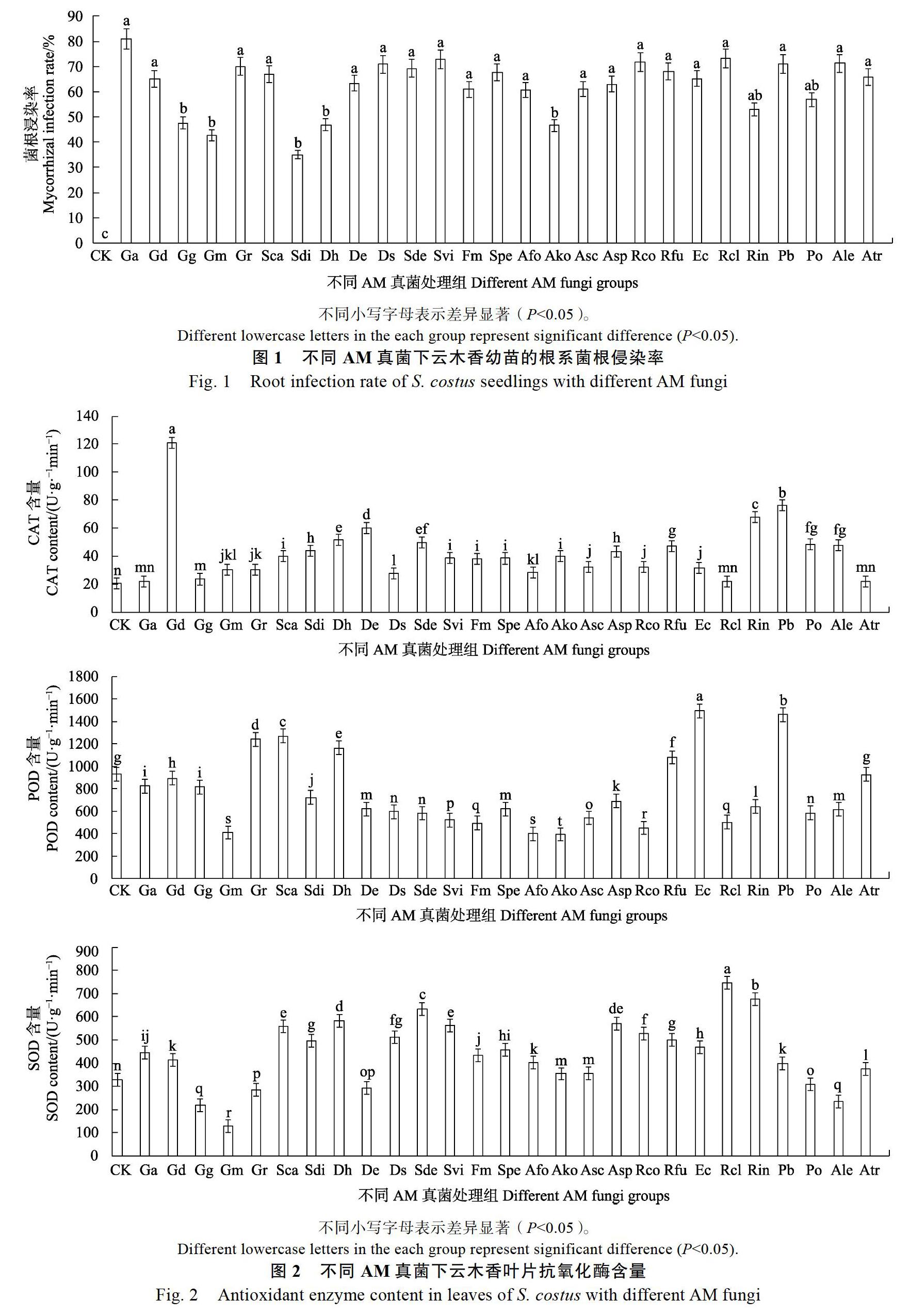
2.1 不同AM真菌处理下云木香幼苗根系侵染率
接种27种外源性AM真菌处理条件下,云木香幼苗的根系侵染率存在一定差异,与CK相比,均达显著性差异(P<0.05)(图1)。由图1可以看出,未接种AM真菌的处理组(CK组)未观察到明显的菌丝和囊泡结构,侵染率均为0,其中Ga、Gr、Sca、Rco、Sde、Svi、Rcl、Ds、Pb和Ale处理组的侵染率较高,均在70%以上,最低的Sdi处理组的菌根侵染率只有35.14%。27种AM真菌对云木香根系的侵染力不同,这说明AM真菌与云木香之间具有一定的偏好性。
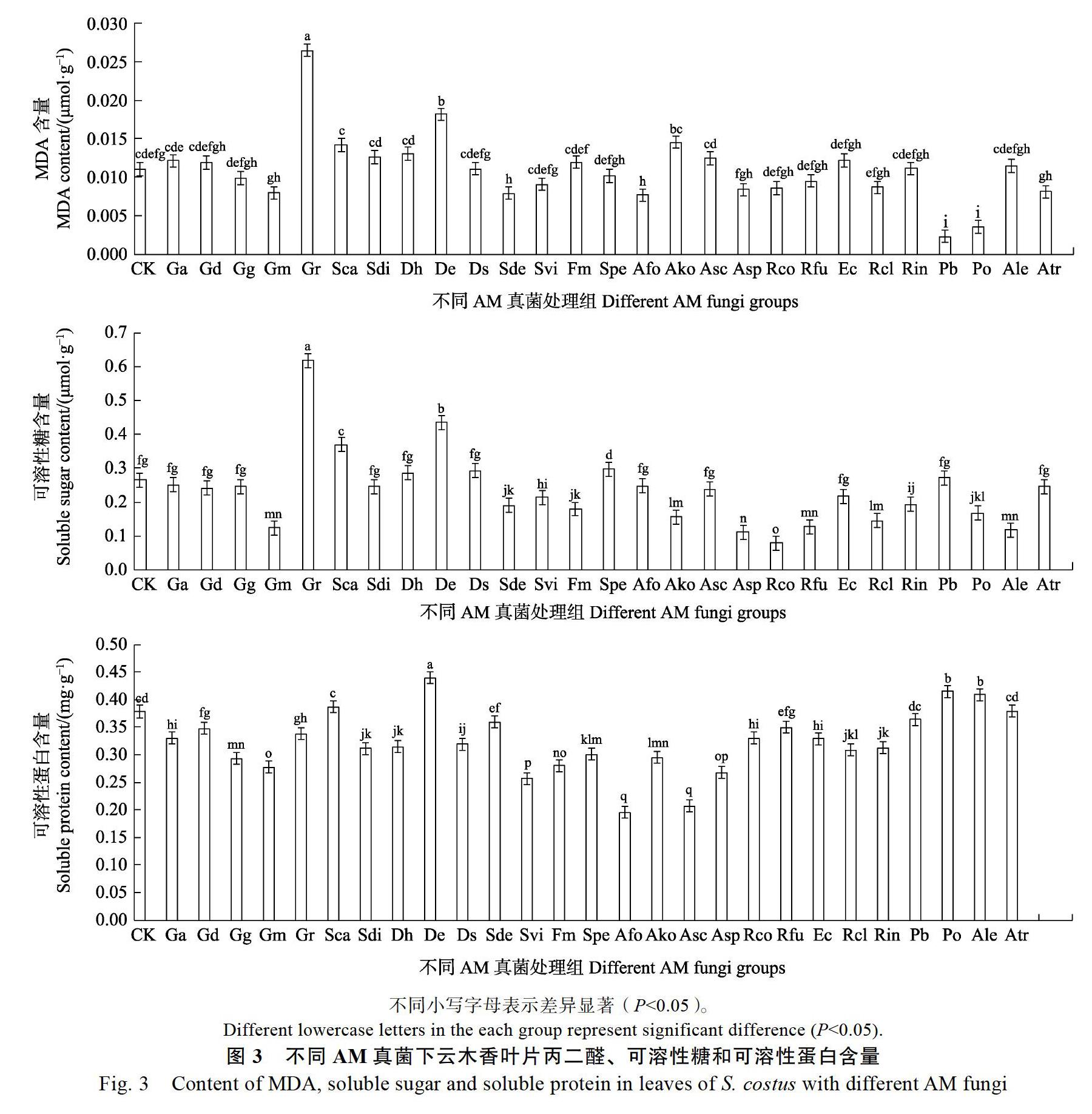
2.2 不同AM真菌处理下云木香叶片抗氧化酶活性
为了研究AM真菌对宿主植物生理水平的影响,测定了云木香接种AM真菌后抗氧化酶系统(CAT、POD和SOD)的活性变化(图2)。由图2可看出,接种27种外源性AM真菌对云木香幼苗叶片中过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性的影响不同,与CK相比,部分处理组差异显著(P<0.05)。
具体来说,与CK组相比,不同AM真菌处理对云木香幼苗叶片CAT活性均有所增加,除Ga、Rcl、Atr处理组外,其余处理组均达显著差异(P<0.05),其中活性最强的Gd处理组是CK组的5.9倍。同时,不同AM真菌处理对云木香幼苗叶片POD活性无明显规律,其中Gr、Sca、Dh、Rfu、Ec和Pb处理组显著增强了POD活性,并达显著差异(P<0.05);其余处理组POD活性均低于CK组,除Atr处理组外,均达显著差异(P<0.05);POD活性最高的Ec处理组是CK组的1.6倍,活性最低的Ako处理组仅为CK组的0.4。另外,除Gg、Gm、Gr、De、Po和Ale处理组外,其余AM真菌处理组SOD活性均有所增加,并达显著差异(P<0.05)。其中,SOD活性最高的Rcl处理组是CK组的2.3倍,活性最低的Gm处理组仅为CK组的0.4。总体来看,Sca、Dh、Rfu、Ec和Pb处理组均显著提高了CAT、POD、SOD活性。
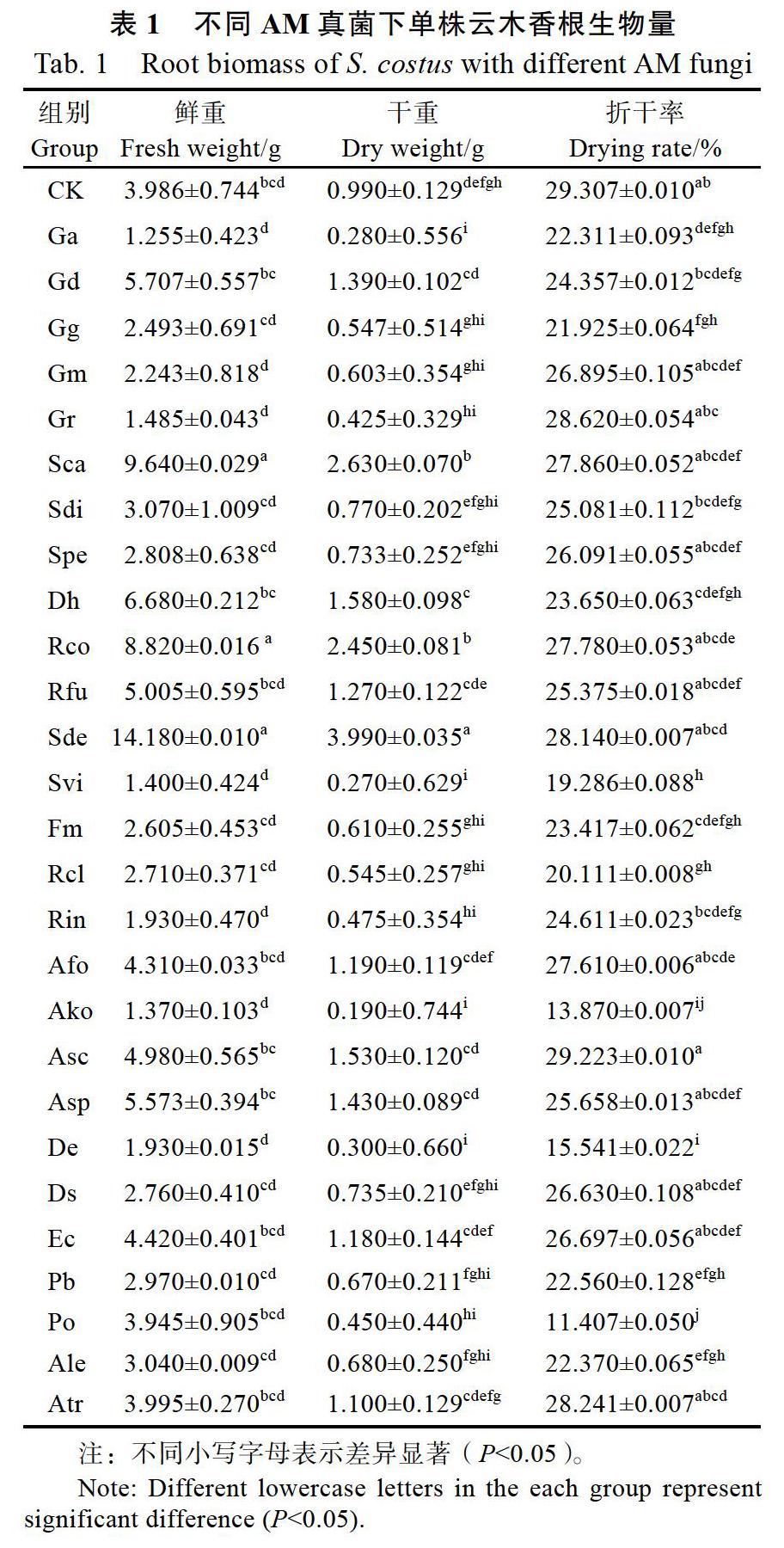
2.3 不同AM真菌处理下云木香叶片丙二醛、可溶性糖、可溶性蛋白含量
由图3可知,与CK组相比,除Gr和De处理组显著增加、Pb和Po处理组显著降低,并达不同小写字母表示差异显著(P<0.05)。
显著性差异(P<0.05)外,其余AM真菌处理组对云木香幼苗叶片中丙二醛(MDA)含量增加或降低幅度不一致,未达到显著性差异(P<0.05)。
同时,方差分析结果表明,接种不同AM真菌处理条件下,外源性AM真菌可调控(增减)云木香植株叶片可溶性糖和可溶性蛋白含量。其中,Gr、Sca、De、Spe处理组叶片中可溶性糖含量显著提高(P<0.05),Sca、De、Po和Ale处理组叶片中可溶性蛋白的含量显著增加(P< 0.05)。
2.4 不同AM真菌处理下云木香根生物量和折干率
由表1可知,与CK组相比,Gd、Sca、Dh、Rco、Rfu、Sde、Afo、Asc、Asp、Ec和Atr等11个处理组提高了云木香根的鲜重和干重,其中Sca、Rco、Sde处理组达差异显著(P<0.05)。此外,各AM真菌处理组云木香根折干率均不同程度地下降,其中Ga、Gd、Gg、Dh、Svi、Fm、Rcl、Ako、De、Pb、Po和Ale处理组显著降低了云木香幼苗根折干率(P<0.05),表示云木香根的生物量增加是通过AM真菌促进其吸收水分所致,进而降低根的折干率。
2.5 不同AM真菌处理下云木香根中倍半萜内酯类化合物含量
由表2可知,接种27种外源性AM真菌改变了云木香萜类化合物中2种主要组分的相对百分含量,均影响了云木香幼苗根中萜类化合物的代谢过程。与CK组相比,大部分AM真菌处理组云木香根中木香烃内酯、去氢木香内酯含量及总内酯含量显著增加(P<0.05),也有部分AM真菌处理组差异不明显或降低。
除Ga、Ako和De处理组降低了云木香根中木香烃内酯含量外,其余AM真菌处理组均提高了木香烃内酯含量,部分达显著性差异(P<0.05);除Ga、Svi、Ako、De和Ale处理组降低了云木香根中去氢木香内酯含量和总内酯含量外,其余AM真菌处理组均提高了去氢木香内酯含量和总内酯含量,部分达显著性差异(P<0.05)。整体来说,Gd、Sca、Rco、Sde、Rcl、Ec和Pb处理组总内酯含量显著增加,分别是CK组的4.57倍、4.75倍、4.78倍、5.32倍、4.53倍、4.28倍、5.51倍。可见,AM真菌的加入有利于人工栽培条件下云木香萜类化合物含量的提高。
2.6 不同AM真菌处理组下云木香幼苗根中木香内酯产量
由图4可以看出,与CK组相比,除Ga、Gr、De、Svi、Ako、Rin、Ale处理组外,其余AM真菌处理组提高了根中木香内酯产量(单株幼苗根中所含总内酯含量与其根产量的乘积),其中Gd、Sca、Dh、Sde、Afo、Asc、Asp、Rco、Rfu、Ec、Rcl、Pb和Atr处理组显著提高了云木香根中木香内酯产量(P<0.05)。这说明,大部分云木香根系丛枝菌根的形成有利于其根中木香内酯产量的积累,属于根中活性成分木香内酯含量和根生物量综合效应的增加。
3 讨论
大量研究表明,AM真菌能与宿主植物根系形成互利共生的丛枝菌根,有利于宿主植物的初生代谢产物和次生代谢产物积累,但不同AM真菌对宿主植物作用效果也不同[19-21]。本研究结果显示,不同的外源性AM真菌菌株均能侵染云木香幼苗根系从而形成共生关系,根系菌根侵染率能力因菌根真菌菌株不同而存在显著差异,说明云木香与AM真菌二者间具有明显的相互选择性,这与张杰等[13]在滇重楼幼苗上的研究结论一致。然而,AM真菌对云木香幼苗侵染率偏低,可能与其根系的严重木质化[22]、植物种类[23]、同一宿主植物的不同基因型品种[13]等差异有关。因此,人工接種外源性AM真菌对云木香的菌根生活力有差异,说明云木香与AM真菌良好匹配对于菌根化育苗的重要性。
AM真菌对宿主植物生理生化的影响是其生态效应的直接体现,而抗性酶活性、可溶性蛋白和可溶性糖含量等的变化可以间接反映宿主植物植株代谢功能的强弱[24]。本研究结果显示,接种外源性AM真菌后,部分AM真菌处理组云木香幼苗叶片内CAT活性、SOD活性和POD活性增强,可溶性糖和可溶性蛋白含量增加,MDA含量降低,从而减缓云木香幼苗叶片的细胞膜脂过氧化程度,增强其细胞质膜的稳定性,能有效增强自由基清除系统的活性,可提高云木香植株的抗性,这与潘兴娇等[14]、韦正鑫等[25]在云木香、滇重楼上得出的结论一致。因此,接种不同AM真菌处理后云木香幼苗在生理生化特性响应方面存在差异,亦是AM真菌菌株与云木香种质优良组合筛选的重要依据,表明接种AM真菌可培育具有较强生理活性和抗逆性的健壮云木香苗,具有广泛的应用前景。
27种供试AM真菌菌株均能够与云木香幼苗建立良好的共生关系,部分菌株能促进其生物量的增加和萜类化合物的积累。木香烃内酯、去氢木香内酯等倍半萜内酯是云木香萜类化合物的主要活性成分,常被作为云木香的品质评价指标[1]。课题组前期已证实,接种外源性AM真菌能明显促进云木香根生物量的积累和提高云木香根的品质[15],同时AM真菌种类对宿主植物次生代谢产物的影响不同[20],本实验结果也证明了这一点。与CK组相比,大部分AM真菌处理组云木香幼苗根中木香烃内酯、去氢木香内酯含量及总内酯含量显著增加(P<0.05),也有部分AM真菌处理组差异不明显或降低,间接提高了云木香的品质和产量。因此,在云木香的人工栽培实际应用中,可以考虑引入与云木香有共生偏好性的菌根真菌菌株,以期克服栽培过程中云木香的病虫害问题,提高云木香的栽培效率和品质、产量。
4 结论
综上所述,本研究以云木香幼苗(实生苗)的菌根侵染率、生理生化、保护酶活性、生物量和倍半萜内酯含量为综合评价指标,确定其产量和品质同步增长的易误巨孢囊霉(Gigaspora decipiens,Gd)、美丽盾巨孢囊霉(Scutellospora calospora,Sca)、瑚状盾巨囊霉(Racocetra coralloidea,Rco)、沙荒球囊霉(Septoglomus deserticola,Sde)、哥伦比亚内养囊霉(Entrophospora colombiana,Ec)、巴西类球囊霉(Paraglomus brasilianum,Pb)等是人工栽培条件下接种AM真菌云木香幼苗的潜在优良菌株。上述研究结果将为云木香菌根互作理论提供基础资料,为AM真菌促进菊科药用植物生长及其资源的可持续利用提供科学依据。
参考文献
[1] 国家药典委员会. 中华人民共和国药典: 2015年版 一部[S]. 北京: 中国医药科技出版社, 2015: 62-63.
[2] 薛倩倩, 尹显梅, 张开元, 等. 灰色关联度法分析产地扩散对木香道地性的影响[J]. 华西药学杂志, 2016, 31(3): 278-280.
[3] 史沁芳, 陈义娟, 张 雪, 等. 反相高效液相色谱法测定木香非药用部位药效成分含量[J]. 重庆师范大学学报(自然科学版), 2018, 35(6): 112-116.
[4] 魏 华, 彭 勇, 马国需, 等. 木香有效成分及药理作用研究进展[J]. 中草药, 2012, 43(3): 613-620.
[5] 钱 伟, 徐 溢, 王昌瑞, 等. 木香药材活性成分及其结构修饰研究进展[J]. 天然产物研究与开发, 2012, 24(12): 1857-1865, 1874.
[6] 韩 凤, 李巧玲, 余中莲, 等. 木香根腐病病原菌鉴定及生物学特性研究[J]. 中药材, 2017, 40(5): 1020-1025.
[7] 陈保冬, 于 萌, 郝志鹏, 等. 丛枝菌根真菌应用技术研究进展[J]. 应用生态学报, 2019, 30(3): 1035-1046.
[8] Tisseranta E, Malbreilb M, Kuo A, et al. Genome of an arbuscular mycorrhizal fungus provides insight into the oldest plant symbiosis[J]. Proceedings of the National Academy of Sciences, 2013, 110(50): 20117-20122.
[9] 汪 茜, 包 涵, 张金莲, 等. 不同丛枝菌根真菌种类对生姜生长的影响[J]. 热带作物学报, 2019, 40(7): 1272-1277.
[10] 陈运雷, 罗 静, 蔡开朗, 等. 接种丛枝菌根真菌对土沉香和降香黄檀营养元素吸收的影响[J]. 热带作物学报, 2018, 39(12): 2355-2362.
[11] 张春英, 张 杰, 黄军华, 等. 菌根真菌接种对盆栽杜鹃花生长的影响[J]. 热带作物学报, 2018, 39(12): 2363-2368.
[12] 刘芳洁. 菌根真菌提高紫苏根腐病抗性的机制研究[J]. 江苏农业科学, 2018, 46(11): 78-81.
[13] 张 杰, 周 浓, 潘兴娇, 等. 基于生物量和活性成分的滇重楼幼苗优良菌根真菌筛选[J]. 中草药, 2018, 49(8): 1897-1906.
[14] 潘兴娇, 张 杰, 黄兴容, 等. 接种AM真菌对木香幼苗生长及光合特性的影响[J]. 中药材, 2016, 39(10): 2178-2184.
[15] 张 杰, 潘兴娇, 罗 静, 等. 丛枝菌根真菌对云木香根产量及其木香烃内酯和去氢木香烃内酯含量的影响[J]. 中国药房, 2017, 28(16): 2179-2182.
[16] 张志良, 瞿伟菁, 李小方. 植物生理学实验指导[M]. 4版.北京: 高等教育出版社, 2009: 58-102.
[17] Philips J M, Hayman D S. Improved procedures for clearing and attaining parasitic and vesicular mycorrhizal fungi for rapid assessment of infection[J]. Trans Br Mycol Soc, 1970, 55(1): 158-162.
[18] Trouvelot A, Kough J L, Gianinazzi-Pearson V. Mesure du taux de mycorhization VA d'un système radiculaire. Recherchede méthodes d'estimation ayantune signification fonctionnelle[A]//Gianinazzi-Pearson V, Gianinazzi S. Physiological and genetical aspects of mycorrhizae[M]. Paris: INRA Publications, 1986: 217-224.
[19] 孙小玲, 许岳飞, 马鲁沂, 等. 植株叶片的光合色素构成对遮阴的响应[J]. 植物生态学报, 2010, 34(8): 989-999.
[20] 张 华, 孙纪全, 包玉英. 丛枝菌根真菌影响植物次生代谢产物的研究进展[J]. 农业生物技术学报, 2015, 23(8): 1093-1103.
[21] 周 浓, 丁 博, 冯 源, 等. 接种不同AM真菌對滇重楼菌根侵染率和入药品质的影响[J]. 中国中药杂志, 2015, 40(16): 3158-3167.
[22] 韩冰洋, 王科东, 周 浓, 等. 丛枝菌根真菌对腺花香茶菜萜类成分的影响[J]. 中药材, 2013, 36(2): 191-195.
[23] 左龙亚, 郭冬琴, 周 浓, 等. 8属22种AM真菌增殖技术的初步研究[J]. 资源开发与市场, 2014, 30(11): 1281-1283.
[24] 刘兆娜, 郭绍霞, 李 伟. AM真菌对百合生长和生理特性的影响[J]. 草业学报, 2017, 26(11): 85-93.
[25] 韦正鑫, 郭冬琴, 李海峰, 等. AM真菌对滇重楼光合参数及生理指标的影响[J]. 中国中药杂志, 2015, 40(20): 3945-3952.
