BML-111通过调节NLRP3炎症激活ROS产生来介导慢性阻塞性肺疾病的抗炎作用
2020-10-29张焱赵丹
张焱 赵丹
包头市第四医院呼吸内科014030
COPD 是一种常见的呼吸道疾病,可预防可治疗,以持续的呼吸道症状和持续的气流受限为主要特征[1]。气流受限是不完全可逆的,呈进展性发展,与肺部的香烟烟雾等有害气体和有害颗粒异常炎症相关联[2],COPD 与慢性支气管炎和肺气肿存在一定的关系,当患者出现咳嗽、呼吸困难症状和疾病危险因素接触时,临床上可以明确的诊断。COPD 发病原因很多,遗传因素α1-抗胰蛋白酶缺乏,气道高反应,吸烟、职业粉尘和化学物质,大气污染和感染因素等等[3]。目前全球40岁以上的成年人患病率已经达到9%~10%[4],因此COPD进程的发展一直是临床工作人员攻克的难题,NLRP3 炎性小体 (NACHT、LRR and PYD domains-containing protein 3,NLRP3)参与降低肺部功能和炎症细胞的浸润[5],1L-1β是下游的一个主要因素,在炎症发展中起着重要的作用,与COPD 严重程度呈正相关[6]。脂氧素受体激动剂(lipoxin receptor agonist,BML-111)已经被证实在抗炎过程中起着显著的作用[7]。转化生长因子β(transforming growth factor-beta,TGF-β)广泛存在于正常细胞和转化细胞中,参与创伤修复、肿瘤发展、免疫应答和纤维化等多种过程,但在COPD 中的相关报道较少。本研究建立小鼠COPD模型,探讨BML-111 脂氧素受体激动剂在小鼠COPD 模型中TGF-β和NLRP3炎性小体活化中的调控作用。
1 材料和方法
1·1 实验动物 挑选健康的SPF 级雄性清洁级小鼠32 只,购自吉林大学动物中心,实验动物合格证号: SCXK (吉) 2014-0006, 批 号:37001900000273,2~4 个月,体质量26~28 g,所有大鼠均按照实验动物管理和使用指南进行饲养和处理,于恒温环境中饲养,自由饮水和进食。实验经内蒙古自治区包头市第四医院伦理委员会核实批准。
1·2 实验试剂和仪器 BML-111 (美国cayman公司),兔抗小鼠NLRP3抗体(美国SantaCruz公司),蛋白测定试剂盒 (上海碧云天生物技术研究所),脂多糖 (北京碧云天公司),黄果树牌香烟(贵州工业中国有限责任公司),光学显微镜(上海永科光学仪器厂),高速冷冻离心机 (Roche 公司),石蜡切片机 (美国thermo公司),恒温水浴箱(美国Bio-Rad公司),电泳仪 (德国Sigma公司),多功能酶标仪 (北京六一仪器厂),熏烟箱(自制)。
1·3 方法
1·3·1 实验动物分组 将小鼠按随机数字法分成4组,每组8 只,正常组 (正常小鼠)、COPD 模型组 (建模COPD 小鼠)、BML-111 低剂量组(BML-111 1 mg/kg)、BML-111高剂量组(BML-111 10 mg/kg)。
1·3·2 动物建模 除正常组小鼠,其余3组共计24只小鼠均暴露于吸烟环境中,并且在气管内注入脂多糖 (lipopolysaccharide,LPS)建立COPD模型,第1 天和第14 天在小鼠气管内注入LPS 200μg/200μl,其他时间放在90 cm×40 cm×30 cm的熏烟箱内,被动吸烟10支,每周6 d,每天4次,每次1 h,烟雾浓度为10%/h,持续6个月,定量进食,每个月测量小鼠的体质量、身长和尾巴长度,正常组正常进食、进水。建模成功后,除正常组和模型组外,BML-111 低剂量组的小鼠通过腹腔注射1 mg/kg的BML-111,BML-111高剂量组的小鼠通过腹腔注射10 mg/kg 的BML-111,正常组和模型组的小鼠在腹腔注射10 mg/kg的生理盐水,然后进行麻醉,处死小鼠,分离肺组织,右肺叶用4%的多聚甲醛固定,待切片处理。左肺行肺泡支气管灌洗,用于细胞分类计数。
1·3·3 HE染色 分别把正常组、COPD 模型组、BML-111低剂量组、BML-111高剂量组肺部组织放在4%多聚甲醛中固定过夜,然后分别溶于100%、95%、80%和75%梯度乙醇中各2 min,放于水中冲洗3 min,石蜡包埋后,切片HE 染色2 min,再用二甲苯渗透切片,中性香脂固定,光镜下面观察其病理的变化。
1·3·4 Western blot检测NLRP3、1L-1β、TGF-β的蛋白的表达 分别取各组小鼠的肺组织,加入100μg的胰蛋白酶提取液,放于冰上30 min,匀浆离心处理,离心率为12 000 r/min,10 min (离心半径为8.0 cm),将悬液进行同源化,再将缓冲液煮沸5 min,使用BCA 蛋白检测试剂盒测定蛋白浓度,然后电泳和转膜处理,再加入5%的脱脂奶粉,然后放入NLRP3、1L-1β、兔抗TGF-β抗体并按照1∶100比例稀释,12 h后TBST 冲洗3次,加入1∶1 000的过氧化物酶标记二抗,重复洗涤步骤,在暗室中显影,以β-actin 做为内参,采用Quantity One 软件评估NLRP3、1L-1β、TGF-β蛋白表达水平。
1·3·5 支气管肺泡灌洗液 (bronchoalveolar lavage fluid,BALF)制备和不同的细胞计数 各组小鼠的左肺行肺泡支气管灌洗(2.5 m1×3次),然后回收BALF,将回收后的BALF 清洗3次后,进行离心处理,离心率为1 500 r/min,10 min(离心半径为8.0 cm),快速收集上清液,用0.5 ml的PBS 重悬细胞颗粒,再用Wright-Giemsa对细胞进行染色,然后对细胞进行分类计数。
1·3·6 氧化应激测定 取每组的肺组织,采用1∶9比例的生理盐水制备组织匀浆,然后进行离心处理,离心率为2 500 r/min,10 min (离心半径为8.0 cm),采集上清液按照试剂盒使用说明测定SOD 活性和MDA 的活性。
1·4 统计学分析 使用SPSS 21.0统计软件进行数据分析,测量数据以±s 表示,采用单因素方差分析和非参数方差分析,在所有的分析中,P <0.05为差异有统计学意义。
2 结果
2·1 小鼠COPD 建模情况观察 正常组无异常情况,COPD模型组、BML-111低剂量组、BML-111高剂量组毛发枯燥、活动量较少,饮食量下降出现打喷嚏和呼吸急促等现象,正常组无死亡发生,其余3组共计死亡1 只,正常组、COPD 模型组、BML-111低剂量组、BML-111高剂量建模前体质量别为 (26.78±1.52)g、 (27.01±1.49)g、(26.97±1.57)g、(27.11±1.51)g,建模后体质量为 (27.32±1.59)g、(23.15±1.59)g、(24.01±1.49)g、(23.06±1.53)g,正常组建模前后差异无统计学意义 (P =0.719),COPD 模型组、BML-111低剂量组、BML-111高剂量建模后体质量明显低于建模前的体质量(P =0.027)。
2·2 肺部组织病理学变化情况 正常组小鼠的肺组织中肺泡间隔比较薄,肺泡正常,没有炎性细胞浸润情况发生;COPD 模型组肺泡间隔受损,肺泡囊增大,炎性细胞浸润严重;BML-111 低剂量组注射1 mg/kg的BML-111后支气管黏膜上皮出现轻度的坏死脱落,炎性细胞浸润减少;BML-111高剂量组注射10 mg/kg的BML-111 后,支气管黏膜上皮出现大量的坏死脱落现象,炎性细胞浸润明显减少,见图1。

图1 肺部组织病理学变化 HE ×200 A:正常组;B:COPD模型组;C:BML-111低剂量组;D:BML-111高剂量组
2·3 NLRP3和炎性因子情况表达 COPD 模型组的NLRP3、1L-1β、TGF-β的蛋白表达明显高于正常组 (P =0.009),BML-111 低剂量组的NLRP3、1L-1β、TGF-β的蛋白表达低于COPD 模型组 (P =0.032),BML-111 高剂量组的NLRP3、1L-1β、TGF-β 的蛋白表达显著低于COPD 模型组(P =0.006),见图2。

图2 各组NLRP3和炎性因子情况表达
2·4 BALF中细胞计数情况 COPD 模型组中的白细胞计数明显高于正常组 (P =0.017),BML-111高剂量组淋巴细胞计数显著低于COPD模型组(P =0.036),中性粒细胞和嗜酸粒细胞各组间对比差异均无统计学意义 (P 值均>0.05),见表1。
2·5 BML-111对COPD 小鼠肺组织SOD 和MDA情况的表达 COPD 模型组的SOD 的活性明显低于正常组 (P =0.011),BML-111 低剂量组的SOD 的活性高于COPD 模型组 (P =0.028),BML-111高剂量组SOD 的活性显著高于COPD 模型组(P =0.009);COPD 模型组的MDA 的活性明显低高于正常组 (P =0.013),BML-111低剂量组的MDA 的活性低于COPD 模型组 (P =0.026),BML-111高剂量组的MDA 的活性显著低于COPD 模型组(P =0.005),见图3、4。
3 讨论
COPD 是一种破坏性的肺部疾病,是导致呼吸衰竭的主要病因[8],发病原因比较复杂,通常引起发病的主要原因是有害气体或者有害颗粒对肺部的异常侵害相关[9]。其中吸烟是导致COPD 的主要因素,同时被动吸烟也同样有害[10],所以COPD也是一种可以预防性的疾病。该病通常在冬季和春季发病率比较高,同时北方发病率高于南方[11],对于该病的发生早期预防是关键,戒烟是减少此类疾病发生的最好办法[12],烟雾会刺激肺部的巨噬细胞释放炎症介质和活性氧 (reactive oxygen species,ROS),导致中性粒细胞活化引起促炎因子的激活以及肺部损伤[13]。有研究证明ROS 是NLRP3炎性小体激活的重要危险因素,正常水平的ROS可以维持细胞的各项生理功能[14],但当细胞的ROS水平超过抗氧化机制的能力时,细胞就会发生氧化激反应,生物通过SOD 和MDA 等抗氧化屏障抵抗ROS诱导的脂质氧化,SOD 的水平与自由基清除能力相关,MDA 水平与自由基对细胞的损伤程度相关[15]。为了进一步探讨BML-111对COPD 小鼠的肺组织的抗炎作用,本章研究了NLRP3、1L-1β、TGF-β 的蛋白表达、SOD 和MDA 活性的影响。
本文研究成功构建了小鼠COPD模型,建模后发现,正常小鼠无异常情况,COPD 小鼠、BML-111 低剂量组、BML-111 高剂量组毛发枯燥、活动量较少,饮食量下降出现打喷嚏和呼吸急促等现象,正常小鼠无死亡发生,其余3组共计死亡1只,正常小鼠、COPD 小鼠、BML-111 低剂量组、BML-111高剂量建模前平均体质量与建模后平均体质量对比无明显差异 (P >0.05),正常小鼠建模前后差异无统计学意义 (P >0.05),用药后,COPD 小 鼠、BML-111 低 剂 量 组、BML-111高剂量建模后体质量明显低于建模前的体质量。正常小鼠小鼠的肺组织中肺泡间隔比较薄,肺泡正常,没有炎性细胞浸润情况发生;COPD 小鼠肺泡间隔受损,肺泡囊增大,炎性细胞浸润严重;BML-111低剂量组注射1 mg/kg的BML-111后支气管黏膜上皮出现轻度的坏死脱落,炎性细胞浸润减少;BML-111 高剂量组注射10 mg/kg 的BML-111后,支气管黏膜上皮出现大量的坏死脱落现象,炎性细胞浸润明显减少。
表1 BALF中细胞计数情况对比分析 (×100/L,±s)

表1 BALF中细胞计数情况对比分析 (×100/L,±s)
注:BALF为;BALF为支气管肺泡灌洗液;BML-111为脂氧素受体激动剂;与正常组相比,a P <0.05;与COPD 模型组相比,b P <0.05
组别鼠数白细胞 (×106/L)中性粒细胞 (%)淋巴细胞 (%)嗜酸粒细胞 (%)正常组8 0.781±0.125 0.327±0.298 0.697±0.571 0.052±0.038 COPD模型组8 2.912±1.545a 0.691±0.398 1.378±0.281a 0.091±0.063 BML-111低剂量组8 2.293±1.352 0.521±0.192 1.152±0.682 0.241±0.189 BML-111高剂量组8 1.069±0.403b 0.412±0.364 0.893±0.275b 0.103±0.112 F 值8.535 3.365 6.581 5.783 P 值0.017 0.073 0.036 0.069
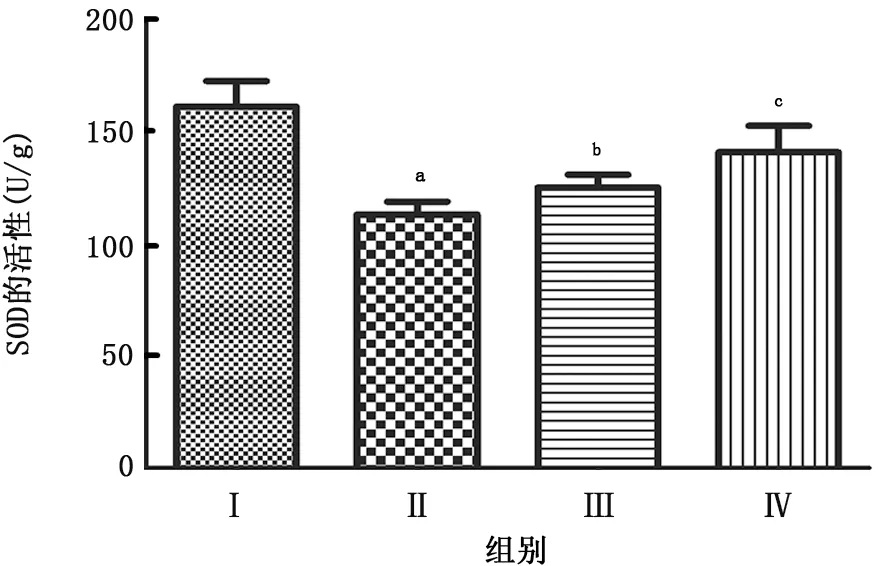
图3 BML-111对COPD小鼠肺组织SOD情况的表达
COPD 小鼠的NLRP3、1L-1β、TGF-β的蛋白表达明显高于正常小鼠,BML-111 低剂量组的NLRP3、1L-1β、TGF-β的蛋白表达低于慢性阻塞性肺病小鼠,BML-111 高剂量组的NLRP3、1L-1β、TGF-β的蛋白表达显著低于COPD 小鼠。模型组中的白细胞和淋巴细胞计数明显高于正常小鼠,BML-111高剂量组白细胞和淋巴细胞计数显著低于模型组,中性粒细胞和嗜酸粒细胞各组间对比无明显差异。说明BML-111在COPD 小鼠肺部炎症中可能具有抗炎作用,Fraser等[16]研究表明COPD 的病理变化与炎症反应之间关系密切。Labaki和Martinez[17]研究表明BML-111可降低肺部组织1L-1β和1L-6的表达,BML-111通过作用与脂氧素A4受体有效抑制急性的肺部损伤时炎症因子表达上调,来减轻炎症反应对肺部组织损伤程度。
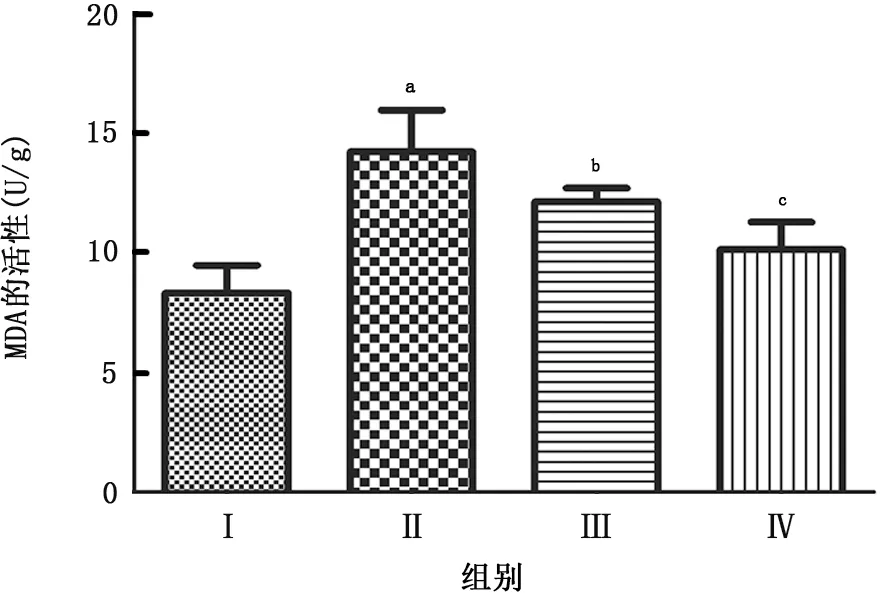
图4 BML-111对COPD小鼠肺组织MDA 情况的表达
COPD 小鼠的SOD 的活性明显低于正常小鼠,BML-111低剂量组的SOD 的活性高于COPD 小鼠,BML-111 高剂量组的SOD 的活性显著高于COPD 小鼠;COPD 小鼠的MDA 的活性明显低高于正常小鼠,BML-111 低剂量组的MDA 的活性低于COPD 小鼠,BML-111 高剂量组的MDA 的活性显著低于COPD 小鼠。Hollander等[18]研究表明抗氧化和上调Nrf-2,提高氧自由基的清楚能力,来提高SOD 的活性,降低MDA 水平,对小鼠的COPD 具有保护作用,可能抑制NLRP3炎症小体的活化,提高抗炎的作用。Janson等[19]研究表明,BML-111可以降低失血性休克大鼠的肺部炎症反应损伤程度,减少中性粒细胞的浸润和炎症因子的表达。
综合上述,BML-111可以通过降低NLRP3水平,提高SOD 活性,降低MDA 含量,提高氧自由基的清除能力,来抵抗COPD 的炎症发生。
利益冲突所有作者均声明不存在利益冲突
