双膦酸盐联合降糖药对2型糖尿病合并骨质疏松症大鼠BMP-2、TGF-β1、IGF-1的影响
2020-10-28孙杨周多奇高玮杨素琴
孙杨 周多奇 高玮 杨素琴
1.首都经济贸易大学体育部,北京 丰台 100070 2.安庆师范大学生命科学学院,安徽 安庆 246133 3.首都经济贸易大学校医院,北京 丰台 100070 4.北京市丰台区新村社区卫生服务中心全科,北京 丰台 100070
糖尿病合并骨质疏松症(diabetes osteoporosis,DOP)是指因各种原因引起胰岛素分泌绝对或相对不足导致慢性长期高血糖导致全身性骨组织显微结构受损、骨量减少、骨强度下降、骨脆性增加的一种代谢性疾病[1]。骨质疏松症(osteoporosis,OP)是糖尿病的主要并发症之一[2]。随着我国人口老龄化现象加剧,其发病率呈逐渐增长流行趋势,严重影响着人们的身体健康和生活质量。DOP作为糖尿病的常见复合性疾病,其发病率高、致残率高的临床特点使其成为当今医学界研究的热点[3]。因此,如何预防和延缓糖尿病患者发生骨质疏松尤为重要。本研究通过观察双膦酸盐联合降糖药物对2型糖尿病合并骨质疏松症大鼠BMP-2,TGF-β1,IGF-1表达的影响,探讨其防治DOP的作用机理,从而为防治DOP提供新思路新方法。
1 材料和方法
1.1 实验材料
阿仑膦酸钠(福善美,70 mg,默沙东制药有限公司),盐酸二甲双胍片(格华止,0.5 g,中美上海施贵宝制药有限公司),血糖仪购于美国强生公司,2000型糖化血红蛋白检测仪购于德国拜耳公司,双能X线骨密度仪器购于美国NORLAND公司,MTS-858型电子万能生物力学材料试验机购于美国MA公司,胰岛素(INS)试剂盒购于南京建成生物科技有限公司。兔抗鼠骨形态发生蛋白-2(BMP-2)、转化生长因子-β1(TGF-β1)、胰岛素样生长因子-1(IGF-1)多克隆抗体及生物素山羊抗兔IgG购于北京中杉金桥生物技术有限公司,RT-PCR逆转录试剂盒购于美国Promega公司。
1.2 方法
1.2.1实验动物及分组:80只SPF级健康SD大鼠,雌性,2.5月鼠龄,体重为(190~225)g,由首都医科大学动物实验中心提供,饲养条件:室内通风换气,室温(23.0±2.5)℃,相对湿度55%~70%,自由进食和饮水,日光交替照射,适应性饲养1 周。按随机数字法分为:对照组、模型组、阿仑膦酸钠组、二甲双胍组、联合组。对照组普通饲料常规饲养,其余4组先给予高脂饲料喂养6 周后改为普通饲料,并均行2型糖尿病性骨质疏松症造模。
1.2.22型糖尿病性骨质疏松症模型:参考张燕等[4]采用STZ造模联合双侧卵巢切除术构建2型糖尿病大鼠骨质疏松模型实验方法,造模成功评价标准:随机血糖≥300 mg/dL(16.7 mmol/L)或空腹血糖≥10 mmol/L;骨密度(BMC)峰值减少≥2.5 SD(标准差)。80只SD大鼠造模成功60只,造模成功率75 %。
1.2.3药物处理与干预:参考人与动物体表面积等效剂量比值,和《药理实验方法学》(第4版)[5],换算成大鼠给药剂量。对照组和模型组予0.9% NaCl灌胃,阿仑膦酸钠组:阿仑膦酸钠灌胃,二甲双胍组:盐酸二甲双胍,灌胃,联合组:阿仑膦酸钠联合盐酸二甲双胍,灌胃,连续给药6周。
1.2.4标本取材:实验结束时,尾静脉采血,检测血糖指标;10 %水合氯醛腹腔注射麻醉后,采用急性大失血法处死大鼠,收集血标本,离心,收集血清,于-20 ℃保存。逐层剥离大鼠右股骨,以0.9 % NaCl湿纱布和锡箔纸包裹,液氮冻透,-20 ℃保存备用;另取部分股骨4 %多聚甲醛固定24 h,15 %乙二胺四乙酸(EDTA)脱钙14 d,制备石蜡切片,保存备用。
1.2.5糖代谢参数:采用全自动生化分析仪检测空腹血糖(FPG)、餐后2 h血糖(2hBPG)、糖化血红蛋白(HbAlc),采用放射免疫法检测空腹胰岛素(FINS),严格按照试剂盒说明书进行操作。
1.2.6检测骨组织骨密度和骨生物力学指标:取出右侧股骨,采用LUNAR双能X线吸收扫描仪检测,应用软件分析计算骨密度值。采用MTS-858型电子万能生物力学材料试验机进行三点弯曲力学试验,记录载荷-变形曲线,计算最大载荷、最大应力和刚度。
1.2.7RT-qPCR检测骨组织BMP-2、TGF-β1、IGF-1 mRNA表达:取骨组织50 mg加入1 mL Trizol于液氮下充分研磨,加入氯仿0.2 mL,参照Trizol RNA提取试剂说明书提取总RNA,检测RNA浓度及纯度,加入反转录引物,反转录合成cDNA。加入相应PCR反应扩增体系(25 μL),PCR热循环仪扩增,扩增条件:96 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,70 ℃延伸30 s,45次循环扩增。SDS聚丙烯酰胺凝胶电泳,图像分析软件分析条带密度,采用2-△△Ct法计算基因的相对表达量。引物设计见表1。

表1 RT-PCR扩增引物序列Table 1 RT-PCR amplification primer sequence
1.2.8免疫组化检测骨组织BMP-2、TGF-β1、IGF-1蛋白表达:严格按照试剂盒说明书操作,分别加入一抗BMP-2(1∶200)、TGF-β1(1∶200)和IGF-1(1∶200),二抗生物素化山羊抗兔IgG(1∶200),光学显微镜观察并采集图片,胞浆被染成棕黄色或棕色为阳性。Image-Pro Plus 6.0图像分析软件分析,染色结果采用平均光密度值(IOD)表示。
1.3 统计学处理
2 结果
2.1 糖代谢指标
模型组血清FPG、2hBPG、HbAlc、FINS较对照组均显著升高(P<0.05),双膦酸盐组、降糖药组、联合组血清FPG、2hBPG、HbAlc、FINS较模型组均显著降低(P<0.05),以联合组最低。模型组血清FINS较对照组显著降低(P<0.05),双膦酸盐组、降糖药组、联合组血清FINS较模型组显著升高(P<0.05),以联合组最高。见表2。

表2 各组大鼠糖代谢指标比较Table 2 Comparison of glucose metabolism indicators in each group rats
2.2 骨组织骨密度和骨生物力学指标
模型组股骨骨密度、最大载荷、最大应力和刚度较对照组均显著降低(P<0.05),双膦酸盐组、降糖药组、联合组股骨骨密度、最大载荷、最大应力和刚度较模型组均显著升高(P<0.05),以联合组最高。见表3。

表3 各组大鼠骨组织骨密度和骨生物力学指标比较Table 3 Comparison of bone mineral density and bone biomechanical indexes of bone tissue in each group
2.3 骨组织BMP-2、TGF-β1、IGF-1 mRNA表达
模型组骨组织BMP-2、TGF-β1、IGF-1 mRNA表达较对照组均显著降低(P<0.05),双膦酸盐组、降糖药组、联合组骨组织BMP-2、TGF-β1、IGF-1 mRNA表达较模型组均显著升高(P<0.05),以联合组最高。见表4。

表4 各组大鼠骨组织BMP-2、TGF-β1、IGF-1 mRNA表达比较Table 4 Comparison of BMP-2, TGF-β1 and IGF-1 mRNA expression in bone tissue of rats in each group
2.4 骨组织BMP-2、TGF-β1、IGF-1蛋白表达
模型组骨组织BMP-2、TGF-β1、IGF-1蛋白表达较对照组均显著降低(P<0.05),双膦酸盐组、降糖药组、联合组骨组织BMP-2、TGF-β1、IGF-1蛋白表达较模型组均显著升高(P<0.05),以联合组最高。见图1、图2、图3和表5。

图1 各组大鼠骨组织BMP-2表达(400×)注:A 对照组;B 模型组;C 双膦酸盐组;D 降糖药组;E 联合组;注:A 对照组;B 模型组;C 双膦酸盐组;D 降糖药组;E 联合组Fig.1 BMP-2 expression in bone tissue of rats in each group (400×)
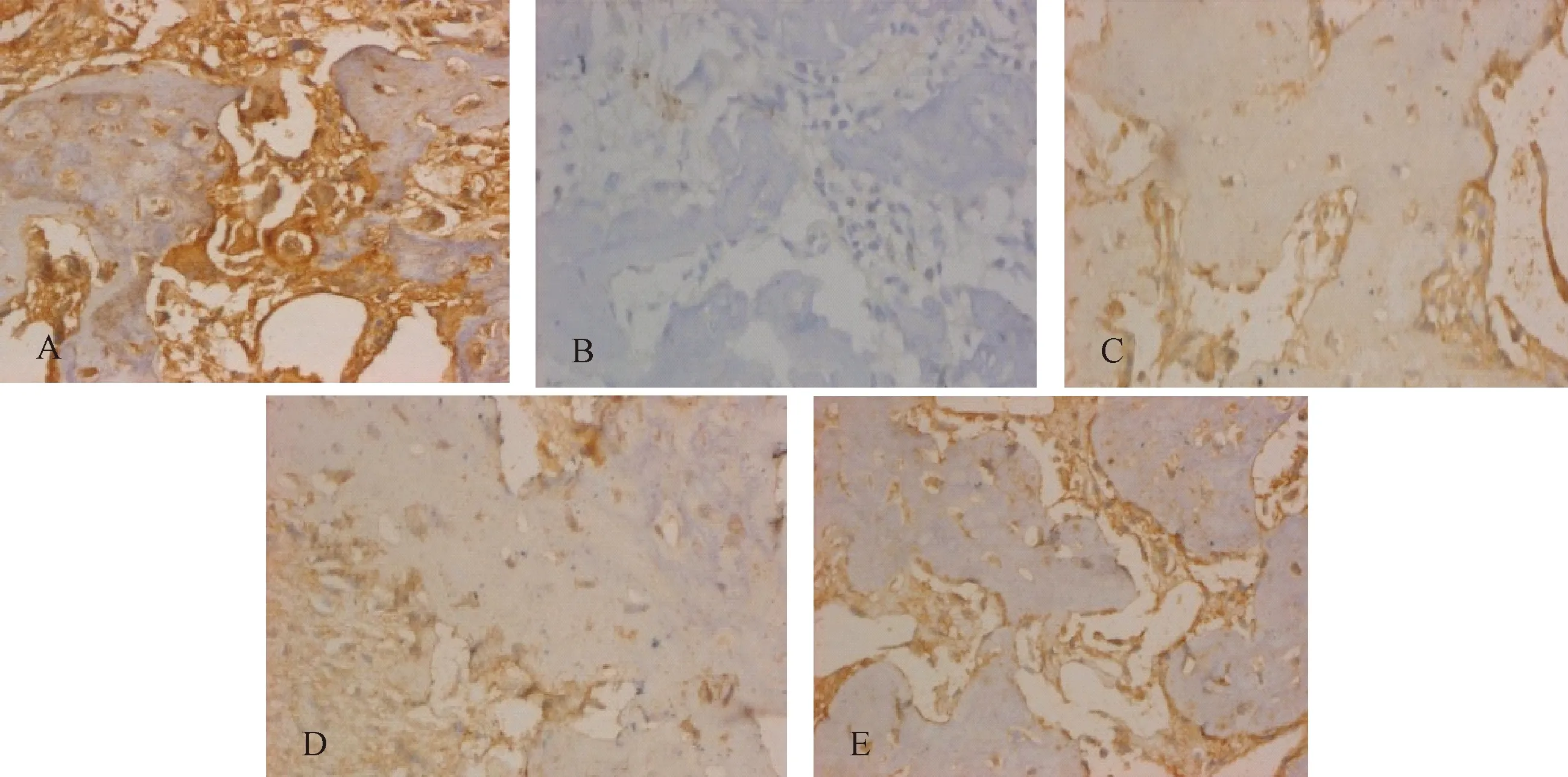
图2 各组大鼠骨组织TGF-β1表达(400×)注:A 对照组;B 模型组;C 双膦酸盐组;D 降糖药组;E 联合组Fig.2 TGF-β1 expression in bone tissue of each group (400×)
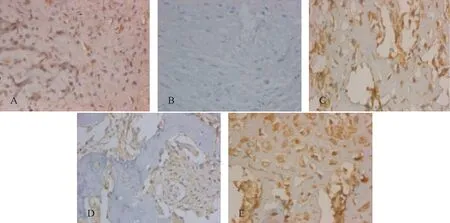
图3 各组大鼠骨组织IGF-1表达(400×)Fig.3 IGF-1 expression in bone tissue of rats in each group (400×)

表5 各组大鼠骨组织BMP-2、TGF-β1、IGF-1蛋白表达比较Table 5 Comparison of BMP-2, TGF-β1, IGF-1 protein expression in bone tissue of rats in each group
3 讨论
目前DOP的发病机制尚未完全阐明,除了性别、年龄、遗传、DM病程、体质等基本因素以外,还包括INS不足和(或)敏感性下降、高血糖、血清甲状旁腺素、骨钙素、高脂血症和性激素等因素[6]。近年研究发现BMP-2、TGF-β1、IGF-I在DOP发病机制中起重要作用[7]。BMP-2被认为是最强的骨诱导分化因子,能够诱导未分化的间充质细胞分化为成熟软骨细胞和成骨细胞,促进成骨细胞分化和成骨因子的表达[8-9]。TGF-β1属于TGF-β超家族成员之一,不仅可促进骨和软骨的形成,而且还可以控制间充质细胞、成骨细胞和成软骨细胞分化,对于骨的修复与保护发挥重要作用[10]。IGF是一种结构类似胰岛素的多肽,与糖代谢和骨代谢密切相关[11]。IGF-I不仅可以刺激骨细胞分化、增殖与代谢,而且也参与抑制胶原酶合成,减少胶原降解,促进骨基质合成与矿化[12]。
目前临床对于防治DOP包括治疗糖尿病原发病和改善骨质疏松症状,针对糖尿病主要以控制血糖,减少及延缓并发症为主;针对骨质疏松主要以抑制骨吸收、降低骨转换和促进骨形成两大类药物干预[13]。本研究通过观察双膦酸盐联合降糖药物对2型糖尿病合并骨质疏松症大鼠BMP-2、TGF-β1、IGF-1表达的影响,结果表明双膦酸盐组、降糖药组、联合组糖代谢指标较模型组均显著改善(P<0.05),双膦酸盐组、降糖药组、联合组骨组织骨密度和骨生物力学指标较模型组均显著升高(P<0.05),双膦酸盐组、降糖药组、联合组骨组织BMP-2、TGF-β1和IGF-1 mRNA和蛋白表达较模型组均显著升高(P<0.05)。分析其作用机制可能为阿仑膦酸钠联合二甲双胍通过调控2型糖尿病合并骨质疏松大鼠相关细胞因子BMP-2、TGF-β1、IGF-1表达,以改善糖代谢,增加骨密度,提高骨生物力学性能。同样,黄樱等[14]研究表明二甲双胍增加了阿仑膦酸钠治疗绝经后骨质疏松症合并2型糖尿病的临床疗效,提高骨密度、改善骨代谢指标和降低VAS评分。孙国庆等[15]研究显示DOP患者使用阿仑膦酸钠联合二甲双胍治疗,可有效改善其骨代谢及骨密度水平。黄锰等[16]研究表明二甲双胍联合阿仑膦酸钠治疗DOP患者,可降低患者糖代谢FPG、HbAlc水平,改善骨代谢指标ALP、BGP、TRAP-5b、s-CTX水平,提高骨密度。阿仑膦酸钠可有效抑制人机体内破骨细胞与成骨细胞的活性,抑制骨吸收和降低骨转换,同时具有抑制糖吸收,促进糖分解作用。二甲双胍控制血糖的同时,提高成骨细胞活性,改善其骨密度及成骨过程,两者联合应用于DOP,可同时改善其血糖及骨代谢水平,发挥有效防治DOP作用。
综上所述,本研究初步认为阿仑膦酸钠联合二甲双胍可能通过调控激活2型糖尿病合并骨质疏松大鼠相关细胞因子BMP-2、TGF-β1和IGF-1的表达,改善糖代谢,增加骨密度,提高骨生物力学性能,从而发挥DOP的防治作用。本研究结果为我们后续研究留下了广阔的研究空间,但具体详细作用机制还有待我们进一步深入研究,相信随着对此展开深入研究,将会为推动防治DOP研究进展提供新思路和新方法。
